大豆分离蛋白的限制性酶解及其功能性质研究1)
2014-09-14李胤静张娜杨宝柱刘雪梅陈迪
李胤静,张娜,杨宝柱,刘雪梅,陈迪
(哈尔滨商业大学食品工程学院,黑龙江省食品科学与工程重点实验室,哈尔滨150076)
大豆蛋白除了具有极高的营养价值外,还具有持水、乳化、吸油、凝胶、起泡、粘结等功能特性。由于其良好的功能特性、较高的营养价值和低廉的价格,使其被广泛应用于多种食品体系[1]。而大豆分离蛋白又是其中的代表性物质,所以有很多人用不同的研究方法对大豆分离蛋白进行处理[2-5],进而改善其功能性质,使其更广泛的应用于各个领域[6-10]。各种改性方法中酶修饰综合了其他反应的优点,被大家广泛认可,并进行各项研究,但现有的研究一般采用的是单一酶对大豆分离蛋白进行处理[11-12],可在此类研究的基础上进一步利用双酶更好的改善大豆分离蛋白的功能性。
本研究利用Alcalase碱性蛋白酶(内切酶)对大豆分离蛋白进行限制性酶解。通过对酶解过程的优化,利用电泳对酶解产品进行表征,并考察了酶解前后大豆分离蛋白的功能性,确定双酶酶解对大豆分离蛋白功能性质的改善程度,为大豆分离蛋白产品更好的应用提供研究基础。
1 材料和方法
1.1 材料和设备
材料:大豆分离蛋白(SPI,蛋白质含量90.1%,干质量)。Alcalase碱性蛋白酶(酶活2000U/g),其他试剂为分析纯,所用的水为去离子水。
主要仪器设备:全自动凯氏定氮仪(瑞士 Foss 公司);真空冷冻干燥机(上海医用分析仪器厂);高速离心机(上海安亭科技仪器厂);电子分析天平(塞多利斯科学仪器有限公司);精密 pH 计(上海雷磁仪器厂);电热恒温水浴锅(天津市泰斯特仪器有限公司);恒温干燥箱(上海东星建材实验设备有限公司)。
1.2 方法
1.2.1 大豆分离蛋白的酶解
用去离子水配制底物浓度为10%的大豆分离蛋白分散液,以酶活2000 U/g,温度60℃,pH为8.0,反应时间50min为基准条件,研究碱性蛋白酶各项单因素对水解度的影响,根据实验结果选择适当的实验条件制备酶解产物,经冷冻干燥,制备酶解产物的干粉。
1.2.2 分析方法
1.2.2.1 蛋白质水解度的测定
大豆分离蛋白酶解产物DH测定采用pH-stat 法[13]。
B:水解过程中消耗NaOH溶液的体积(mL);
N:NaOH溶液的浓度(mol/L);
α:大豆分离蛋白氨基的平均解离度;
M:底物蛋白质含量(g);
h:蛋白质中总的可被水解的肽键数(大豆蛋白为 7.8 mmol/g)。
1.2.2.2 氨基氮含量的测定
大豆分离蛋白酶解产物氨基氮含量的测定采用甲醛滴定法[14]。
V=样品耗用氢氧化钠标准溶液毫升数;
V0=空白耗用氢氧化钠标准溶液毫升数;
N=氢氧化钠标准溶液摩尔浓度。
1.2.2.3 大豆蛋白产品的溶解性评价
大豆分离蛋白的溶解性测定方法参考文献进行[15]。
NSI (%) = 可溶性氮/总氮×100
1.2.2.4 大豆蛋白产品的保水性评价
大豆分离蛋白的保水性测定方法参考Surówka K(2004)[16]。
1.2.2.5 大豆蛋白产品的吸油性评价
大豆分离蛋白的吸油性测定方法参考Moure Andrés(2005)[17]。
1.2.2.6 大豆蛋白产品的乳化活性评价
大豆分离蛋白的乳化活性测定方法参考Moure Andrés,2005[17]。
EAI(m2/g)=2[T×A0×稀释倍数/(C×Φ×L×10)]
T=2.303
A0=零时刻的吸光度值;
C=乳状液形成前配制的蛋白质浓度(g/L);
Φ=乳状液油相的体积分数;
L=比色杯厚度(cm)。
1.2.2.7 SDS凝胶电泳
采用不连续垂直板状凝胶电泳。具体实验方法参考郭尧君(1999)[18]。
2 结果与分析
2.1 大豆分离蛋白的限制性酶解工艺参数的优化
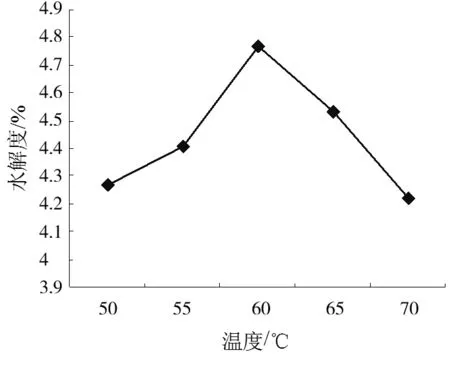
称取大豆分离蛋白样品30.00 g于锥形瓶中,加入蒸馏水270 mL,使其充分分散,配制成浓度10% (w/w)的大豆分离蛋白分散液,然后置于以酶活2000 U/g,温度60℃,pH为8.0,反应时间50min为基准条件,控制其中三项不变,分别改变其中一项,研究Alcalase碱性蛋白酶中各项单因素对水解度的影响,结果见图1。
由图1a反映出大豆分离蛋白的DH在20~200min内随反应时间的增加而增大,但增加的趋势减缓,所以选择时间时,综合时间利用率考虑可知不是时间越长越合适;在酶活500~2500 U/g内DH随着酶活的增加而增大,但增加趋势较为缓慢(图1b),说明在此范围内受酶活影响相对其他因素影响较小,故综合酶的使用率考虑不是酶活越大越合适;在pH值7.0~9.0范围内,DH随着pH值的增加而先增加后降低(图1c),在pH值为8.0左右达到最适值,说明Alcalase蛋白酶反应时pH值可选择在8.0左右;温度在50~70℃范围内,DH随着温度的增加而先增加后降低(图1d),在温度为60℃左右达到最适值,说明Alcalase碱性蛋白酶反应时温度可选择在60℃左右。
所以,综合成本,时间利用率等各项因素考虑,本研究选择酶活2000 U/g,温度60℃,pH为8.0的条件下,酶解1h的工艺参数,在该工艺参数下酶解大豆分离蛋白得到DH为4.97%的酶解产物。

(a)

(b)

(c)
(d)
2.2 大豆分离蛋白的酶解电泳分析
对经过限制性酶解的SPI产物与未酶解的SPI的进行SDS-聚丙烯酰胺凝胶电泳分析图如图2所示。
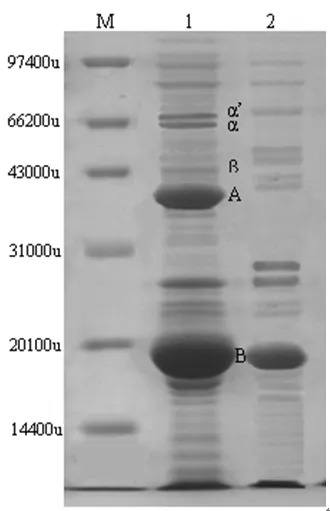
图2 SPI与酶修饰SPI的凝胶电泳图
大豆蛋白的主要组分是7S和11S球蛋白。7S组分主要含有3个亚基,分别是α、α’和β亚基;11S组分(A和B)是由酸性亚基和碱性亚基组成的六聚体,酸性亚基和碱性亚基间通过一个二硫键相连。从电泳分析结果可以看出:在Alcalase蛋白酶作用下,大豆蛋白的α亚基、α’ 亚基和β亚基均发生水解。11S不同水解片段集中31.0 kD和20.1 kD之间。
2.3 大豆分离蛋白酶解产物功能性质评价
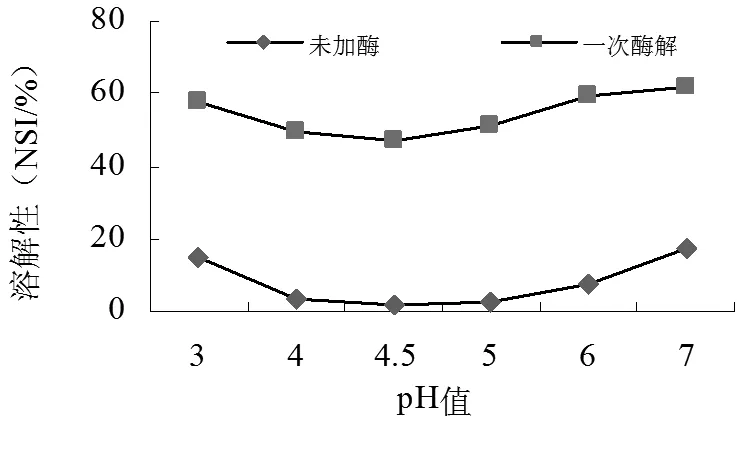
(a)
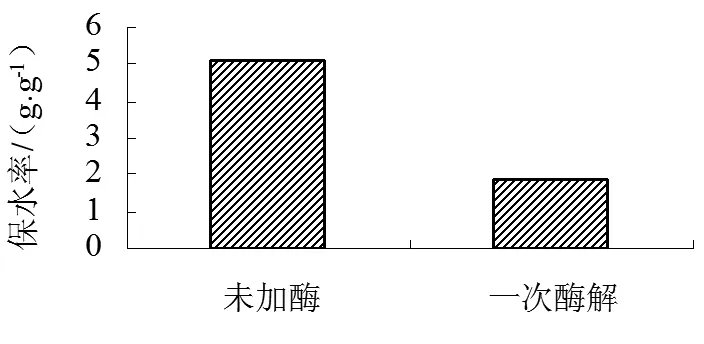
(b)

(c)
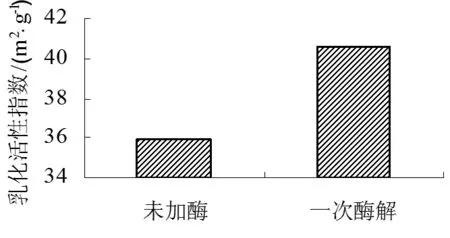
(d)
由图3(a)显示,SPI与酶修饰SPI的等电点都在 pH 4.5 附近,酶解处理明显提高了SPI的溶解性。未经过酶解的SPC在等电点的NSI为2.91%,经Alcalase碱性蛋白酶限制性酶解后,在等电点的NSI为49.50%。Alcalase碱性蛋白酶的催化作用位点较多,导致碱性蛋白酶修饰产品中短分子片段多,因此溶解性很大程度的提高。
由图3(b)显示,经过酶解修饰处理,明显地降低了酶解修饰分离蛋白的保水性。大豆分离蛋白的保水率为5.07g/g,而Alcalase碱性蛋白酶酶解保水率为1.89g/g。可能是由于随着DH的增加而形成很多的小分子,不利于形成蛋白质的网状结构(凝胶),导致保水性降低。
由图3(c)显示,SPI的吸油率最高,酶修饰后的SPI产物的吸油率都有不同程度的降低。SPI的吸油率为0.99g/g,经Alcalase碱性蛋白酶酶解后,吸油率为0.72g/g。蛋白质的溶解性取决于蛋白质分子的亲水性/疏水性的平衡,这种平衡取决于蛋白质分子的氨基酸组成,尤其取决于暴露于蛋白质分子表面的氨基酸组成[19]。Alcalase碱性蛋白酶水解作用的主要位点是 Tyr、Phe、Try 等芳香族疏水性氨基酸残基的肽键和Ala-,Leu,Val,所以随着水解的进行,疏水基团和亲水基团的数量发生改变,因此吸油率降低。
由图3(d)显示,SPI的酶解处理提高了酶解产品的乳化活性指数。SPI的乳化活性指数为35.97m2/g,经过Alcalase碱性蛋白酶处理,乳化活性指数为40.55m2/g。酶解使蛋白质分子变小、构象发生改变,一些包埋于蛋白质内部的疏水性残基暴露,利于其向水油界面扩散降低界面张力,同时,水解后的肽分子更易定位于水油界面,排列更为有序[20]。所以,酶解产品的乳化活性指数较SPI有一定的提高,但是较大水解度的产物中低分子质量的肽分子过多,所以会降低乳化活性指数的提高程度。
3 结论
利用Alcalase碱性蛋白酶对SPI在酶活2000U/g,温度60℃,pH为8.0的条件下,酶解1h,可制得水解度为4.97%的酶解产物。电泳分析结果表明:在双酶酶解下,α亚基、α’ 亚基和β亚基被水解,11S不同水解片段集中31.0 kD和20.1 kD之间。SPI经过酶解修饰后,其溶解性有很大程度的提高,在等电点 pH 4.5处,溶解性从2.91%增大至49.50%;而保水性则降低,保水率从5.07g/g降低到了1.89g/g;吸油率从0.99g/g变化为0.72g/g;乳化活性指数从35.97m2/g变化为40.55 m2/g,有一定程度的提高。结果表明,经过Alcalase碱性蛋白酶限制性酶解后,大豆分离蛋白的功能性质均有不同程度的改善。
[1]逯昕.酶改性制备专用大豆分离蛋白的研究[D].无锡:江南大学食品学院, 2008.
[2]Zhong F, Wang Z, Xu S,et al.Food Chemistry, 2007,100:1371-1376.
[3]尚新彬,豆康宁.菠萝蛋白酶水解大豆分离蛋白工艺优化研究[J].农业科技,2012,36:40-42.
[4]Wang X S, Tang C H, Li B S, et al.Food Hydrocolloids, 2008,22:560-567.
[5]王中江,江连洲,魏冬旭,等.pH值对大豆分离蛋白构象及表面疏水性的影响[J].食品科学, 2012,33(11):47-51.
[6]Sype J V D, Arudi R L.Preparation of coated powder[P].US patent, 0182855A1.2006-08-17.
[7]Wang H, Wang T, Johnson L A.Mechanism for refunctionalizing heat-denatured soy protein by alkaline hydrothermal cooking[J].Journal of the American Oil Chemists' Society, 2006, 83(1): 39-45.
[8]张春岭,潘思轶.化学改性对大豆分离蛋白表面疏水性的影响[J].中国粮油学报, 2009,24(6):26-30.
[9]赵新淮,侯瑶.大豆蛋白限制性酶解对乳化性质和吸油性的影响[J].农业机械学报,2009,40(12):159-163.
[10]刘大川,张维农.中国大豆蛋白工业现状及发展趋势[C].中国粮油学会第二届学术年会论文选编, 2002:17-19.
[11]孙欣,王璋,王莉,等.轻度酶解对大豆蛋白胶凝性和疏水性的影响[J].食品科学, 2005,26(12):37-39.
[12]侯瑶.大豆浓缩蛋白和大豆分离蛋白限制性酶解及功能性变化[D].哈尔滨:东北农业大学, 2008.
[13]Adler-Nissen J.Enzymatic hydrolysis of food proteins[M].Elsevier Applied Science Publishers, London and New York, 1986: 9-24.
[14]吴建中.大豆蛋白的酶法水解及产物抗氧化活性的研究[D].广州:华南理工大学, 2003.
[15]刘宏芳,侯瑶,赵新淮.大豆蛋白限制性酶解修饰与产品的溶解性和保水性变化[J].东北农业大学学报, 2009,40(1):97.

[17]Moure Andrés, Domlínguez Herminia, Parajó Juan Carlos.Fractionation and enzymatic hydrolysis of soluble protein present in waste liquors from soy processing[J].Journal of Agricultural and Food Chemistry.2005,53:7600-7608.
[18]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,1999:262-263.
[19]ANDRES M, SINEIRO J, HERMINIA D, et al.Functionality of oilseed protein products: a review[J].Food Research International, 2006, 39(9): 945-963.
[20]Nakai S.Structure relationship of food proteins with and emphasis on the import -ance of protein hydrophobicity[J].Journal of Agricultural and Food Chemistry, 1983, 31 (4):676-683.
