荧光介孔硅包覆铁氧化物神经干细胞标记研究
2014-09-14张波戚利坤李立新
张波,戚利坤,李立新
(1.青海省人民医院神经内科,青海西宁810007;2.青海省第五人民医院神经内科,青海西宁810007;3.南京医科大学,江苏南京210029)
荧光介孔硅包覆铁氧化物神经干细胞标记研究
张波1,戚利坤2,李立新3
(1.青海省人民医院神经内科,青海西宁810007;2.青海省第五人民医院神经内科,青海西宁810007;3.南京医科大学,江苏南京210029)
目的以介孔硅包覆磁颗粒M-MS 50与SHU-555A对比,标记永生化神经干细胞C17.2。方法采用了核磁共振,普鲁士蓝染色,流式细胞仪,原子发射光谱,弛豫仪等一系列检测手段,测定细胞对磁颗粒的吞腹量,磁颗粒对细胞毒性的影响,及其在细胞内的代谢情况,选择细胞标记的最优条件。结果在神经干细胞对荧光介孔硅包覆铁氧化物的吞噬行为实验结果来看,随着孵育时间增长,SHU-555A和M-MS 50都更多的被C17.2神经干细胞所吞噬,这表现出细胞标记的时间依赖性。而M-MS 50在较短时间内便可以对细胞有一定的标记率。在标记神经干细胞的MRI和ICP-OES定量分析中可以得出,C17.2神经干细胞对SHU-555A和M-MS 50均表现出浓度依赖性和时间依赖性,SHU-555A和M-MS 50与C17.2细胞孵育,都存在标记率随时间梯度和浓度梯度的增加而提高,直到平衡这一现象。而通过荧光介孔硅包覆铁氧化物细胞内分布和代谢研究,发现随着标记时间的增长和标记浓度的增加,C17.2神经干细胞的标记率逐渐增加;磁颗粒有没有从细胞中代谢出来,并且在培养多长时间之后,细胞对M-MS 50的代谢达到平衡。结论 介孔硅包覆氧化铁纳米颗粒M-MS 50在标记神经干细胞C17.2上相对SHU-555A有较明显的优势,而其多功能,特殊的介孔结构,又为以后进一步利用提供了更广阔的空间。M-MS 50能够有效地缩短周围质子的弛豫时间,提高弛豫信号强度,是一种非常优越的造影剂。
介孔超顺磁性氧化铁造影剂;核磁共振;神经干细胞
近年来,随着分子影像学和无创活体显影检测技术的发展,尤其是MR技术的不断进步,采用超顺磁性标记物作为分子探针,对干细胞进行体内示踪,在分辨率、空间示踪及示踪时间和示踪效果重复性方面较荧光标记法有极其明显的优势,具有较高的研究价值和广阔的应用前景[1-4]。超顺磁性氧化铁(superparamagnetic iron oxide,SPIO)纳米分子探针因良好的生物相容性和MR信号敏感性[5-7]作为最重要的顺磁性标记物,广泛运用于干细胞体内示踪实验。
1 材料与方法
1.1 材料 C17.2细胞系,HyClone(美国)公司。SHU-555A(Bayer Schering Pharma,Berlin,Germany),为经过美国食品与药品管理局(FDA)批准的磁共振造影剂SPIO,表面经羧基葡聚糖(carboxydextran)修饰形成,其平均水化粒径在60 nm左右;荧光介孔硅包覆铁氧化物(M-MS 50)由上海交通大学Med-X研究院纳米生物医学研究中心所提供。正置荧光显微镜DM2500 Leica,德国。
1.2 实验方法
1.2.1 C17.2神经干细胞的体外培养 将冻存的C17.2神经细胞复苏,于37℃水浴摇晃1min左右溶解,吸出细胞悬液移入装有5 mL培养基的无菌离心管中,1200 r/min离心5 min,弃上清,在细胞沉淀中加入1 mL DMEM培养基(含10%胎牛血清和5%马血清),轻轻吹打均匀,将细胞悬液移入装有10mL培养基的细胞培养瓶中。37℃,5%CO2恒温培育箱培养。5min左右待细胞贴壁后,更换新培养基;待细胞生长至铺满培养瓶底85%以上时,可以用于后续试验。
1.2.2 普鲁士蓝染色处理[8]首先将待标记的磁颗粒SHU-555A和M-MS50分别以一定浓度分散在无血清的DMEM中,将其稀释为目标浓度(Fe浓度分别为5、10、20、33μg/mL)以用于标记试验。将贴壁率达到80%以上的C17.2细胞的6孔板中培养基吸出,分别加入Fe浓度为10μg/mL的SHU-555A和M-MS 50与无血清DMEM混合液,放回培养箱(37℃,5%CO2)中孵育0.5、1、2、3 h。将贴壁率达到80%以上的C17.2细胞的6孔板中培养基吸出,分别加入SHU-555A和M-MS50与无血清DMEM混合液,Fe浓度分别为5、10、20、33μg/mL,放回培养箱(37℃,5%CO2)中孵育2 h。将标记好的细胞充分用PBS洗涤之后,4%多聚甲醛固定10 min,于空气中干燥15 min,确保干燥后的细胞可用于长期保存。用PBS再次浸润细胞5 min,加普鲁士蓝染液(与20%盐酸按1∶1充分混合)染色30 min。用纯水洗涤细胞,吸干表面水分,用10~20μL核固红染料对细胞核进行染色10~20min。最后将细胞用纯水,75%、95%无水乙醇中进行清洗,加盖玻片置于正置荧光显微镜下进行观察。
1.2.3 流式细胞仪检测细胞标记率 取1×106个FITC标记的C17.2细胞于流式管中,加入400μL PBS溶液充分分散,在FACSAriaII流式细胞仪上进行检测。
1.2.4 共聚焦激光扫描显微镜检测介孔磁颗粒M-MS 50在细胞内的位置[9]将C17.2神经干细胞铺在3.5 cm共聚焦小皿中,待其贴壁并长至80%之后,以M-MS 50用无血清DMEM稀释至Fe浓度为10μg/mL与神经干细胞C17.2共同孵育2 h,用1mL PBS和200μL胰酶共同快速洗涤细胞吸取洗涤液以除去细胞外壁粘附和培养液中未被细胞吞噬的磁颗粒,之后将其加入500μL DAPI染料在37℃下染15min,将样品用Leica TCS SP5共聚焦扫描激光显微镜扫描,30min内设定逐层扫描参数为50 nm,共扫描80个焦平面。
1.2.5 细胞中荧光介孔硅包覆铁氧化物的保持研究[10]将充分共育2 h的细胞中培养液吸出,每孔加入1 mL PBS缓冲液充分震荡洗涤3次,加入1 mL无血清的DMEM培养1 h,更换加入新鲜无血清DMEM,收集旧培养基采用mq60弛豫分析仪测量其信号强度。分别收集共育结束后的第3,6,12,24,48,72 h培养基进行检测。
1.2.6 ICP-OES定量测定细胞吞噬的铁含量[11]将待标记的磁颗粒SHU-555A和M-MS50分别以一定浓度分散在无血清的DMEM中,将其稀释为目标Fe浓度(5、10、20、33μg/mL)以用于标记试验。在生长良好的,长满80%~90%C17.2神经干细胞3.5 cm培养皿中分别加入SHU-555A和M-MS50与无血清DMEM混合液,Fe浓度分别为5、10、20、33μg/mL,放回培养箱(37℃,5%CO2)中孵育2 h。在生长良好的,长满80%~90% C17.2神经干细胞的3.5 cm培养皿中分别加入Fe浓度为10μg/mL的SHU-555A和M-MS 50与无血清DMEM混合液,放回培养箱(37℃,5%CO2)中孵育0.5、1、2、3 h。将制备的MRI样品常温下融化,离心除去上清PBS和明胶混合溶液,加1 mL浓硝酸,于37℃恒温箱静置24~48 h,待细胞完全被消化后,将样品定容至10m L,采用ICP-OES技术定量铁浓度C,测得数据单位mg/L。
1.2.7 MRI成像 本实验中采用37℃下浓度为2%的明胶溶液来分散细胞,制备可供体外磁共振成像的样品。将一定量(5×105)细胞收集入2 mL离心管中,离心去除上清液,用300μL明胶溶液充分分散细胞后置于冰块中30 min凝固,此过程应非常小心,避免产生气泡,后用明胶填充离心管内的其余空间。将上述方法处理过得细胞于冰箱中保存,扫描成像过程中,成像的细胞样品置于盛水的塑料盒中。M-MS 50和SHU555A在不同Fe浓度梯度(5、10、20、33μg/mL,2 h)和不同时间梯度(Fe浓度=10μg/mL,0.5、1、2、3 h)条件下标记细胞,取制备成在明胶中均匀分散的样品,在3 T磁共振扫描系统中显像的成像结果
2 结果
2.1 神经干细胞对荧光介孔硅包覆铁氧化物的吞噬行为
采用普鲁士蓝染色来定性分析SHU555A和M-MS 50 2种纳米磁颗粒对C17.2细胞的标记。图1是SHU555A和M-MS 50标记细胞的普鲁士蓝染色结果。图中红色是核固红染色的细胞核,蓝色是普鲁士蓝染色的氧化铁纳米颗粒。细胞吞噬磁颗粒进入细胞质中,留在细胞核的周围。A图所示为SHU-555A和M-MS 50以相同Fe浓度梯度孵育细胞2 h的结果。从中可以看出,在每一个浓度梯度,M-MS 50标记的C17.2神经干细胞比SHU-555A所标记的结果呈现出更多的蓝色,因而更多量的磁颗粒被细胞所吞噬;相同标记时间(2 h)情况下,磁颗粒浓度越高,细胞吞噬的磁颗粒含量越多,直到达到饱和。B图是SHU-555A和M-MS 50以Fe浓度10μg/mL共同时间梯度孵育细胞的结果。从氧化铁纳米颗粒所呈现蓝色的浓度看出,M-MS 50更易被细胞吞噬。而随着孵育时间增长,SHU-555A和M-MS 50都更多的被C17.2神经干细胞所吞噬,这表现出细胞标记的时间依赖性。而M-MS 50在较短时间内便可以对细胞有一定的标记率。
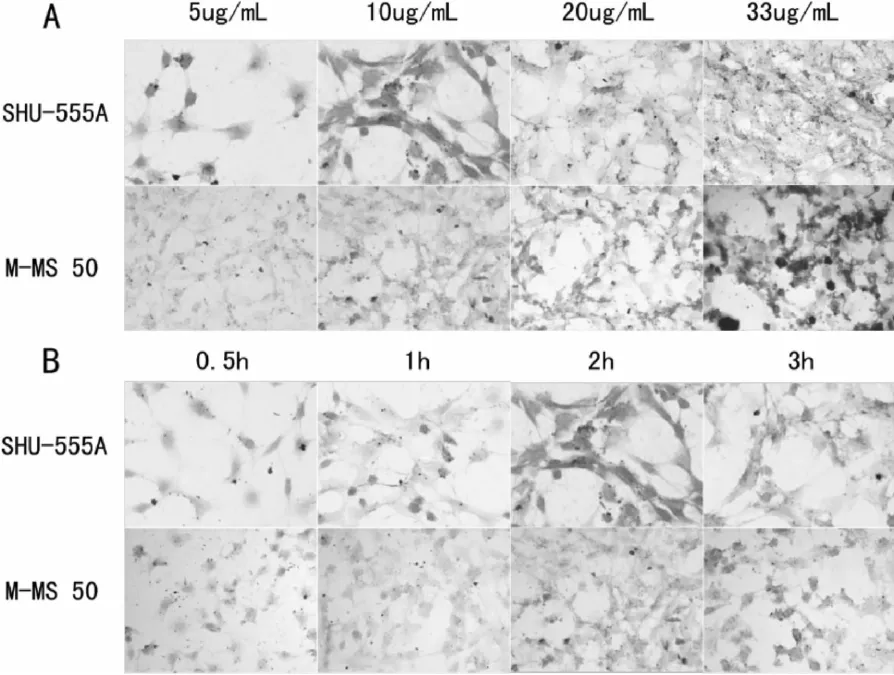
图1 SHU555A和M-MS 50标记细胞Fe浓度梯度(A)和时间梯度(B)的普鲁士蓝染色结果Fig.1 SHU555A and M-MS 50 Fe labeled cells in a concentration gradient(A)and time gradient(B)results of Prussian blue staining
2.2 标记神经干细胞的MRI和ICP-OES定量分析
2.2.1 MRI成像结果 M-MS50和SHU555A在不同Fe浓度梯度(5、10、20、33μg/mL,2 h)和不同时间梯度(Fe浓度=10 μg/mL,0.5、1、2、3 h)条件下标记细胞的MRIT2成像结果见图2。M-MS 50应用于细胞磁共振显像,能够显著改进细胞磁共振显像的灵敏度。在低浓度及相同浓度标记时间较短的时候,MMS 50能够显著缩短周围质子的弛豫时间,呈现低信号,证明M-MS 50能够在较短的时间内取得很明显的细胞标记率,且在起初较短时间内,标记率的差异性不大。而浓度较高的情况下,细胞标记效率非常明显,信号很高。整体来说,SHU-555A和MMS50与C17.2细胞孵育,都存在标记率随时间梯度和浓度梯度的增加而提高,直到细胞标记饱和,这与之前普鲁士蓝染色结果一致。证明C17.2神经干细胞对SHU-555A和M-MS 50均表现出浓度依赖性和时间依赖性。

图2 M-MS 50和SHU555A在不同Fe浓度梯度和不同时间梯度条件下标记细胞的MRIT2成像结果Fig.2 MRIT2 imaging results of the M-MS 50 and SHU555A in different Fe concentration gradient and different time gradient conditions labeled cells
2.2.2 ICP-OES对MRI样品内铁含量定量分析 图3为ICP-OES检测的Fe浓度结果,其单位为pg/cell。从中可以看出,随孵育时间增加,M-MS 50被C17.2神经干细胞吞噬的量明显高于SHU-555A被吞噬的量,但浓度梯度之间,与SHU-555A的吞噬量差异不大。较短的孵育时间内,C17.2神经干细胞对M-MS 50的吞噬量远高于SHU-555 A,达到13.58 pg/cell,而SHU-555A的细胞吞噬量仅为6.1 pg/cell。这证明M-MS 50在较短时间内就为细胞所吞噬,可以达到快速标记的目的。而随着浓度的增加,相同孵育时间下,M-MS 50为C17.2吞噬量均高于SHU-555A,而当Fe浓度达到33μg/mL时,M-MS 50的吞噬量显著高于SHU-555A,达到29 pg/cell,而SHU-555A仅为14 pg/cell。但整体来说,SHU-555A和M-MS 50与C17.2细胞孵育,都存在标记率随时间梯度和浓度梯度的增加而提高,直到平衡这一现象。

图3 MRI样品时间梯度(A)和浓度梯度(B)的ICP检测结果Fig.3 The MRIsample time gradient(A)and the concentration gradient(B)ICP detection results
2.3 荧光介孔硅包覆铁氧化物细胞内分布和代谢研究
2.3.1 流式细胞仪检测细胞标记率 图5为流式细胞仪检测细胞标记率。主要通过M-MS 50中所含的FITC平均荧光强度,来测定细胞中磁颗粒的标记率。从图中可以看出,随着标记时间的增长和标记浓度的增加,C17.2神经干细胞的标记率逐渐增加。但在时间较短和浓度较低的时候,其标记率较低,并且区别不大。与之前普鲁士蓝染色结果相比,然而流式细胞仪通过对FITC荧光强度的检测并未显示出较高的细胞标记率,仅为30%左右,可能是由于大量的M-MS 50在单个细胞内部团聚,造成细胞局部磁颗粒浓度较高,FITC浓度较高,进而导致荧光猝灭不利于检测[2-4]。证明随着标记时间的增长和标记浓度的增加,C17.2神经干细胞的标记率逐渐增加。

图5 流式细胞仪检测细胞标记率Fig.5 cellmarkers for the detection of flow cytometer rate
2.3.2 共聚焦激光扫描显微镜测M-MS 50在细胞内的分布 图6为M-MS 50以10μg/mL与C17.2神经干细胞共同孵育2 h后的共聚焦照片。其中绿色荧光为M-MS 50中的FITC,蓝色荧光为DAPI染的细胞核。结合明场照片,可以清晰看出细胞形态没有显著变化,磁颗粒主要分布在细胞质中,并不能进入细胞核。通过三维剖面图可以清楚地定位磁颗粒是在细胞的胞质中的。

图6 M-MS 50(10μg/mL)与C17.2神经干细胞孵育2 h后的共聚焦照片A:C17.2神经干细胞明场照片;B为细胞的DAPI染色结果;C为M-MS 50的FITC荧光照片;D为B,C的叠合图;E为A,B,C的叠合;F为细胞层扫过程中所获得的三维立体剖面图Fig.6 M-MS 50(10 mu g/m L)and C17.2 neural stem cells were incubated for 2 h by confocal picturesA:Bright field photographs of C17.2 neural stem cells.B:Results the cells DAPI staining.C:FITC fluorescent pictures of M-MS 50.D:B,C compositemap. E:A,B,C compositemap.F:Three dimensional profile obtained in the process of cell layer scan
2.3.3 弛豫仪测M-MS 50在细胞中的保持 通过弛豫仪检测M-MS 50被C17.2细胞吞噬后细胞内的保持情况。通过弛豫信号是否增加,可以推断出磁颗粒有没有从细胞中代谢出来,并且在培养多长时间之后,细胞对M-MS 50的代谢达到平衡[12-14]。图7为M-MS 50被C17.2细胞吞噬后换成新鲜无血清培养基中弛豫信号的改变情况。由图中可以看出,细胞与磁颗粒结束共同孵育试验之后,由于换了新鲜的无血清DMEM,可能存在培养液与细胞内磁颗粒的浓度差异,从而促进胞吐作用。在结束孵育试验的前8 h内,细胞胞吐作用比较旺盛,而8 h之后,基本上磁颗粒不再被细胞从体内代谢出来。

图7 M-MS 50被C17.2细胞吞噬后换成新鲜无血清培养基中弛豫信号的改变情况Fig.7 M-MS 50 C17.2 cells after phagocytosis was replaced with fresh medium without changing the relaxation signal serum culture
3 讨论
本文主要以介孔硅包覆磁颗粒M-MS50与SHU-555A对比,标记永生化神经干细胞C17.2。由于2种磁颗粒粒径相似,体外的普鲁士蓝染色试验定性的证明M-MS 50对神经干细胞C17.2在浓度梯度上(≤33μg/mL)标记效率比SHU-555A高得多,而时间梯度,在短时间(5 h以内),标记效率略高于SHU-555A,而长时间标记之后,其可能通过较为强烈的胞吐作用被代谢出来,因而标记效率不如SHU-555A。普鲁士蓝染色结果证明C17.2神经干细胞对磁颗粒的吞噬都表现为浓度依赖性和时间依赖性。
体外MRI实验证明,M-MS 50应用于细胞磁共振显像,能够显著改进细胞磁共振显像的灵敏度。在低浓度及相同浓度标记时间较短的时候,M-MS 50能够显著缩短周围质子的弛豫时间,呈现低信号,而标记时间较长之后,相较于SHU-555A,M-MS 50并不能发挥其弛豫时间短,信号强度高的优势。但整体来说,SHU-555A和M-MS 50与C17.2细胞孵育,都存在标记率随时间梯度和浓度梯度的增加而提高,直到平衡这一现象。对应的ICP定量分析,印证了上述实验结果,且当高浓度Fe(33μg/mL)孵育C17.2时,M-MS 50的吞噬量显著高于SHU-555A。这与之前普鲁士蓝染色结果一致。对M-MS 50在C17.2神经干细胞内部标记率,分布和代谢,分别用流式细胞仪,共聚焦激光扫描显微镜和弛豫仪完成[15]。流式细胞仪结果证明M-MS 50对C17.2神经干细胞的标记率还有非常大的提高空间。共聚焦激光扫描显微镜的图像能够确定M-MS 50进入C17.2神经干细胞内部,主要分布在胞质中。弛豫仪结果说明M-MS 50在标记C17.2神经干细胞之后8 h内面临较为旺盛的细胞胞吐过程,如何提高M-MS 50在细胞内不被代谢出来,还需要进一步的研究。
[1]Walter GA,Santra S,Thattaliyath B,et al.(Super)paramagnetic nanoparticles:applications in noninvasive MR imaging of stem cell transfer[M].In:Bulte JWM,Modo MMJ,editors.Nanoparticles in biomedical imaging.New York:Springer,2008,102:91-144.
[2]Lindvall O,Kokaia Z.Stem cells for the treatment of neurological disorders[J].Nature,2006,441:1094-1096.
[3]McKay R.Stem cells-hype and hope[J].Nature,2000,406(6794):361-374.
[4]Deans RJ,Moseley AB.Mesenchymal stem cells:biology and potential clinical uses[J].Exp Hematol,2000,28(8):875-884.
[5]Weissleder R,Mabmood U.Molecular imaging[J].Radiology,2001,219(2):316-333.
[6]Lauterbur PC.Image formation by induced local interactions Examples employing nuclear magnetic resonance[J].Nature,1973,142:190191.
[7]熊国欣,李立本.核磁共振成像原理[M].北京:科学出版社.
[8]李坤成.中国医用磁共振产业和技术发展现状[J].磁共振成像,2011,2(1):5-6.
[9]Rinck PA.Magnetic Resonance in Medicine,4th ed[M].BWV Vienna,2001.
[10]程昌明.面向磁共振成像应用的Fe3O4纳米颗粒/团簇的可控制备[D].上海:上海交通大学化学化工学院,2010.
[11]肖研.磁共振成像造影剂的研究进展[M].分析化学(FENXI HUAXUE),2011.
[12]刘迎春,许妙琼,朱文祥.医疗诊断新技术-磁共振成像术[J].化学教育,2005(5):4-7.
[13]许乙凯,磁共振造影剂及临床应用[M].人民卫生出版社.2003:16-56.
[14]Hapgspiel KD,Neidl KF,Eichenbeger AC,et al.Detection of liver metastases:Coparision of superparamegnetic iron oxide-enchanced and unenchanced MR imaging at 1.5T with dynamic CT,intraoperative US,and percutaneous US[J].Radiology,1995,196(2):471-478.
[15]Laurent S,Elst L,et al.Structure,synthesis and characterization of contrast agents for magnetic resonance molecular imaging[J].NMRMRI,MSR and Mossbauer Spectroscopies in Molecular Magnets,2007(1):71-87.
(编校:吴茜)
Research on fluorescentmesoporous silica-coated iron oxide labeled neural stem cell
ZHANG Bo1,QILi-kun2,LILi-xin3
(1.Department of Neurology,People's Hospital of Qinghai Province,Xining 810007,China;2.Department of Neurology,Fifth People's Hospital of Qinghai Province,Xining 810007,China;3.Nanjing Medical University,Nanjing 210029,China)
ObjectiveTo compare M-MS 50 with SHU-555A ofmesoporous silica-coated magnetic particles,label the immortalized neural stem cells C17.2.MethodsSwallowing abdominal volume of cells,the effectofmagnetic particles on cell toxicity and itsmetabolism in cellswere determined by a series of tests such as nuclearmagnetic resonance,Prussian blue staining,flow cytometry,atomic emission spectrometry,relaxation instrument.The optimal conditionswas screened according to the above-mentioned experimental result.ResultsThe resultsof phagocytic behavior ofneural stem cells on the fluorescentmesoporous silica-coated iron oxide showed thatmore and more SHU-555A and M-MS 50 were phagocytosed by neural stem cells C17.2 with the incubation time increased,which illuminated the time dependence of cell labeling.While M-MS 50 could have a certain rate of cells labeling in a relatively short period of time.In MRIand ICP-OES,Phagocytization of neural stem cells C17.2 on SHU-555A and M-MS50 showed a concentration and time dependent manner,SHU-555A and M-MS 50 incubated with C17.2 cells showed labeled rates increased with the increase of time and concentration gradients,until the balance.Intracellular distribution and metabolism research of,fluorescentmesoporous silica-coated iron oxide showed that neural stem cell C17.2 labeling rate increased with the increase of time and concentration gradients,gradually.Conclusion Mesoporous silicacoated iron oxide nanoparticles of M-MS 50 has obvious advantages over SHU-555A in labeling neural stem cells C17.2,but itsmultifunctional,special mesoporous structure provideswider space for further use.M-MS 50 could effectively shorten the relaxation time of surrounding proton,improve the relaxation signal strength,which is a very excellent contrast agent.
mesoporous silica-coated SPIO contrast agent;MRI;neural stem cell
张波,女,本科,主治医师,研究方向:神经内科常见病、多发病及神经重症医学,E-mail:qch1821460057@163.com。
R730.5
A
1005-1678(2014)08-0060-05
国家自然科学基金(81171147)
