PPARγ、脂联素抑制肝星状细胞增殖
2014-09-13车媛梅
车媛梅 张 一 应 杰
(南昌大学第一附属医院传染科,江西 南昌 330006)
肝纤维化是各种原因引起慢性肝损伤共有的病理改变,也是进一步向肝硬化发展的中间环节,其病理的中心环节是肝星状细胞(HSC)表型转换后产生大量细胞外基质。在肝纤维化发生过程中,过氧化物酶体增殖物液活受体(PPAR)γ衰竭是HSC转分化的关键分子变化机制之一。研究表明脂联素不但在脂质及葡萄糖代谢中具有作用,同时具有抗肝纤维化作用,是否PPARγ能上调脂联素表达、协同抗纤维化目前研究甚少。本研究通过PPARγ激动剂和(或)拮抗剂作用于活化的HSC,在mRNA及蛋白质水平分析PPARγ与脂联素表达的关系,及其对HSC增殖的影响,为肝纤维化治疗提供新思路。
1 材料与方法
1.1主要试剂 大鼠HSC-T6,上海中医药大学肝病研究所徐列明教授;罗格列酮购自瑞士Alexis公司;GW9662购自美国Sigma公司;兔抗大鼠PPARγ抗体及兔抗大鼠Adiponectin抗体购自武汉博士德公司;小鼠抗大鼠β-actin抗体、辣根酶标记山羊抗兔二抗、辣根酶标记山羊抗小鼠二抗购自北京中杉金桥公司;总RNA提取试剂盒及RT-PCR试剂盒购自北京全式金公司;总蛋白提取试剂盒购自普利莱基因技术有限公司;四甲基偶氮唑盐(MTT)购自北京Solavbia公司。
1.2细胞培养 大鼠HSC-T6用含10%胎牛血清及浓度为100 U/ml双抗的高糖DMEM培养液培养细胞,放于37℃、5%CO2及饱和湿度孵箱中培养,每天观察细胞生长情况,隔天换液,待细胞生长至80%~90%密度时传代。
1.3实验方法
1.3.1分组 根据文献报道的最佳浓度给药〔1〕,分为罗格列酮组(10 μmol/L),GW9662阻断组(1 μmol/L),罗格列酮+GW9662组(10 μmol/L罗格列酮 + 1 μmol/L GW9662),空白对照组(单纯用含10%FBS的高糖DMEM培养液培养细胞)。
1.3.2MTT法检测各组对HSC-T6细胞增殖的影响 取对数生长期细胞,胰酶消化后培养24 h,弃净培养液,按照实验分组加入药物每孔200 μl;对照组用含10%胎牛血清的DMEM培养液培养,每组设5个复孔,分别培养24 h后,加入无菌MTT溶液(5 mg/ml)20 μl及150 μl二甲基亚砜,振荡10 min。采用492 nm波长,在酶标仪上测定各孔光吸收值(A值),计算细胞的增殖率,增殖抑制率=〔(对照组A值-实验组A值)/对照组A值〕×100%。
1.3.3逆转录聚合酶链反应(RT-PCR)检测PPARγ和脂联素mRNA的表达 总RNA的提取及cDNA的合成按试剂盒说明书操作。引物由上海生物工程公司合成。PPARγ扩增片段222 bp,上游5′-3′CCC TGG CAA AGC ATT TGT AT,下游5′-3′ACT GGC ACC CTT GAA AAA TG;脂联素扩增片段178 bp,上游5′-3′GTT CTC TTC ACC TAC GAC CAG,下游5′-3′GGA AGA GAA GAA AGC CAG TAA。参照 β-actin扩增片段522 bp,上游5′-3′TGG GAC GAT ATG GAG AAG AT下游5′-3′ATT GCC GAT AGT GAT GAC CT;扩增后电泳,凝胶成像系统扫描,脂联素、PPARγ 与β-actin的比值为各自mRNA的相对表达水平,实验重复3次。
1.3.4蛋白质免疫印迹(Western印迹)检测脂联素和PPARγ蛋白的表达 细胞中总蛋白提取按试剂盒说明书操作,十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,用Umax2100XL扫描仪拍照,并用Quantity-One凝胶分析软件分析目的条带的灰度值,脂联素、PPARγ 与β-actin的比值为各自蛋白的相对表达水平,实验重复3次。
1.4统计学方法 应用SPSS17.0统计学软件,采用Pearson相关分析。
2 结 果
2.1MTT法检测HSC-T6细胞增殖的结果 GW9662组(0.893±0.027)、GW9662+罗格列酮组(0.779±0.027)及空白对照组(0.998±0.029)的A值均较罗格列酮组(0.678±0.029)明显升高(t值分别为16.331、21.975、19.5,均P<0.01)。
2.2RT-PCR检测HSC-T6细胞脂联素和PPARγ mRNA表达 ①罗格列酮组脂联素mRNA相对表达量(1.273±0.045)较空白对照组(0.693±0.065)、GW9662组(0.653±0.075)、GW9662+罗格列酮组(0.633±0.093)升高(t值分别为12.264、10.733、12.690,P<0.01)。②罗格列酮组PPARγ mRNA相对表达量(1.633±0.015)较空白对照组(0.457±0.015)、GW9662组(0.403±0.015)、GW9662+罗格列酮组(0.450±0.026)升高(t值分别为8.619、7.089、4.343,P<0.01)。③GW9662能同时阻断罗格列酮对PPARγ及脂联素mRNA的表达。④PPARγ和脂联素mRNA表达有正相关关系(相关指数为0.970,P=0.000)。见图1。
2.3Western印迹检测HSC-T6细胞脂联素和PPARγ蛋白表达 ①罗格列酮组(1.124±0.007)脂联素蛋白相对表达量较空白对照组(0.734±0.043)、GW9662组(0.744±0.082)、GW9662+罗格列酮组(0.744±0.064)升高(t值分别为7.969、10.240、15.274,P<0.01)。②罗格列酮组PPARγ蛋白相对表达量(1.036±0.028)较空白对照组(0.649±0.005)、GW9662组(0.655±0.006)、GW9662+罗格列酮组(0.648±0.004)升高(t值分别为23.450、24.208、23.990,P<0.01)。③GW9662能同时阻断罗格列酮对PPARγ及脂联素蛋白的表达。④PPARγ和脂联素蛋白表达有正相关关系(相关指数为0.966,P=0.001)。见图2。
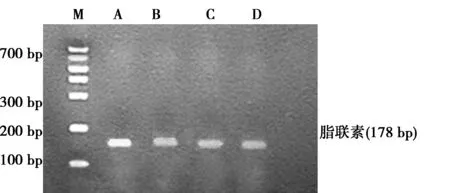
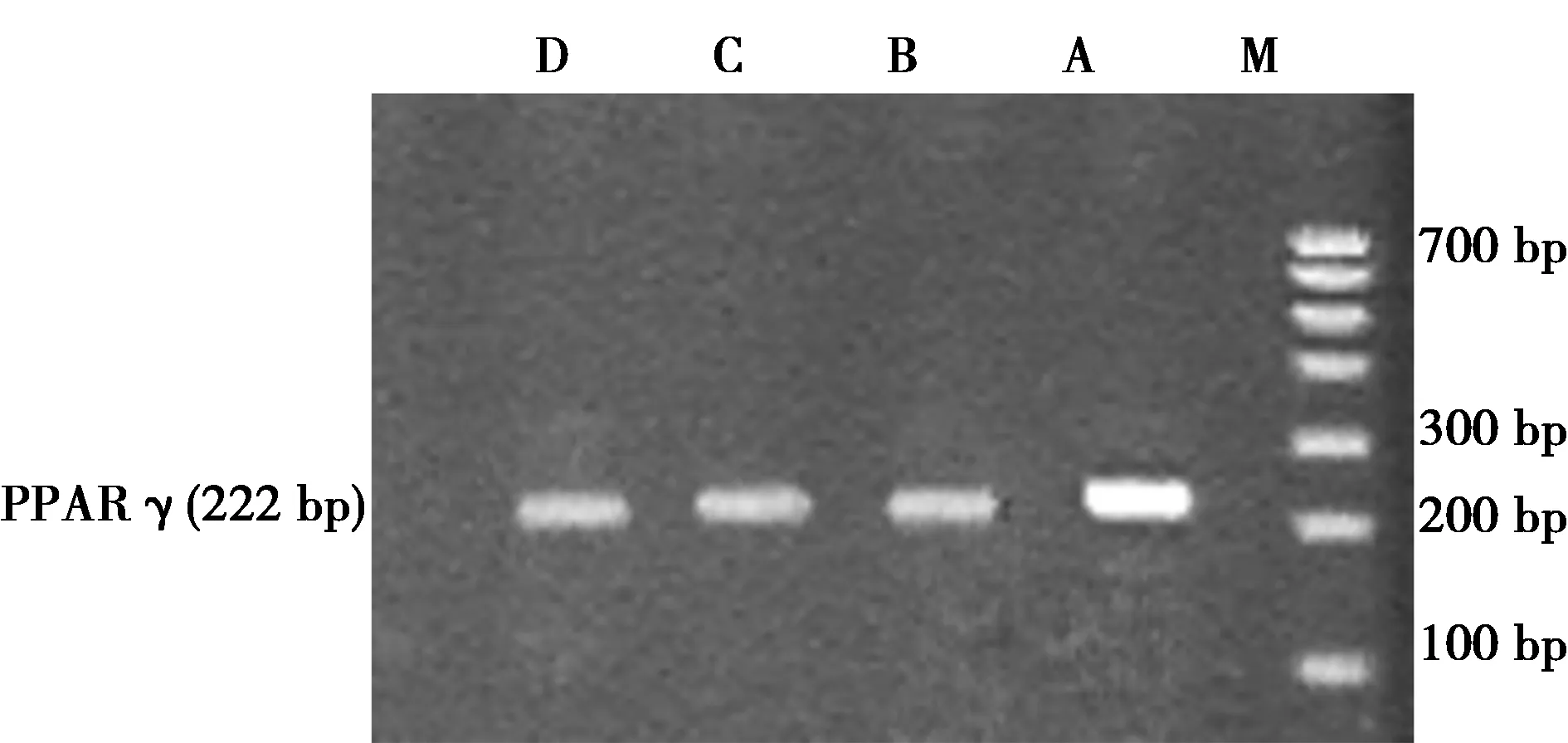
M:相对分子质量标准;A:罗格列酮组;B:GW9662组;C:罗格列酮+GW9662组;D:空白对照组;下图同
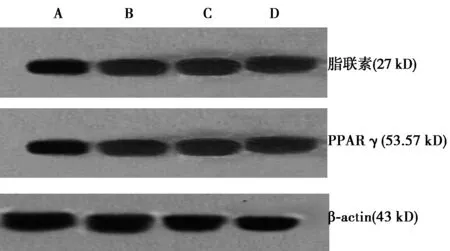
图2 Western印迹检测HSC-T6细胞脂联素、PPARγ蛋白表达
3 讨 论
脂肪组织是一个活跃的内分泌器官,其分泌的细胞因子如脂联素和瘦素参与肝纤维化发展。在病毒性肝炎及非酒精性脂肪性肝病研究中发现,脂联素参与肝脏脂肪变、炎症活动、纤维化〔2〕。Musso等〔3〕报道脂联素水平与肝脏纤维化程度呈负相关。Kaser 等〔4〕报道各种病因的肝纤维化患者血浆脂联素水平均明显升高,且其血浆浓度与Child-Pugh 分级相关。Sohara等〔5〕报道38例肝硬化患者血清脂联素水平与肝功能Child-Pugh分级呈正相关。Ding 等〔6〕在大鼠HSC培养过程中发现,静息的HSC可以表达合成脂联素,脂联素可以减少增殖细胞核抗原的表达而抑制活化的HSC增殖及迁移,并促进活化的HSC 凋亡以抑制肝纤维化的发生发展。Adachi等〔7〕报道高分子量脂联素通过丝裂原活化蛋白激酶(MAPK)途径抑制HSC增殖。
近年来研究发现,PPARγ可通过多途径、多层次维持HSC静止表型,各途径间有多种交互作用,形成错综复杂的信号调节网络。研究发现,将生理浓度的脂联素与人单核细胞来源的巨噬细胞共同孵育,脂联素呈剂量依赖性地增加基质金属蛋白酶组织抑制因子-1(TIMP)-1mRNA的表达,而PPARγ激动剂能诱导人巨噬细胞上脂联素受体的表达〔8,9〕。本实验结果说明罗格列酮激动PPARγ的表达,同时也上调脂联素的表达,且这种激动作用可被特异性阻断剂GW9662阻断,提示罗格列酮的激动作用是通过PPARγ途径实现的。相关性分析结果提示在HSC中细胞核内转录因子PPARγ与脂联素的表达调控有一定相关,与文献报道PPARγ的靶基因是脂联素一致〔10〕。
综上所述,本研究进一步证实脂联素具有抑制肝纤维化的作用,其机制可能与PPARγ的转录与调控有关,通过提高PPARγ与脂联素的表达,从而抑制HSC增殖,达到阻断肝纤维化进展的目的。
4 参考文献
1郭晏同,赵景明,柏 楠,等.PPARγ特异配体抑制肝星状细胞活化〔J〕.中华肝胆外科杂志,2008;14(11):786-9.
2Mandal P,Park PH,McMullen MR,etal.The anti-inflammatory effects of adiponectin are mediated via a heme oxygenase-1-dependent pathway in rat kupffer cells〔J〕.Hepatology,2010;51(14):1420-9.
3Musso G,Gambino R,Biroli G,etal.Hypoadiponectinemia predicts the severity of hepatic fibrosis and pancreatic Beta-cell dysfunction in nondiabetic nonobese patients with nonalcoholic steatohepatitis 〔J〕.Am J Gastroenterol,2005;100(11):2438-46.
4Kaser S,Moschen A,Kaser A,etal.Circulating adiponectin reflects severity of liver disease but not insulin sensitivity in liver cirrhosis 〔J〕.J Intern Med,2005;258(3):274-80.
5Sohara N,Takafi H,Kakizaki S,etal.Elevated plasma adiponectin concentrations in patients with liver cirrhosis correlate with plasma insulin levels〔J〕.Liver Int,2005;25(1):28-32.
6Ding X,Saxena NK,Lin S,etal.The roles of leptin and adiponectin:a novel paradigm in adipocytokine regulation of liver fibrosis and stellate cell biology 〔J〕.Am J Pathol,2005;166(6):1655-69.
7Adachi M,Brenner DA.High molecular weight adiponectin inhibits proliferation of hepatic stellate cells via activation of adenosine monophosphate-activated protein kinase〔J〕.Hepatology,2008;47(2):677-85.
8Chinetti G,Zawadski C,Fruchart JC,etal.Expression of adiponectin receptor in human macrophages and regulation by agonists of the nuclear receptors PPARalpha,PPARgamma,and LXR〔J〕.Biochem Biophys Res Commun,2004;314(1):151-8.
9Gustafson B,Jack M,Cushman SW,etal.Adiponectin gene activation by thiazolidinediones requires PPAR gamma 2,but not C/EBP alpha-evidence for differential regulation of the aP2 and adiponectin genes〔J〕.Biochem Biophys Res Commun,2003;308(4):933-9.
10Iwaki M,Matsuda M,Maeda N,etal.Induction of adiponectin,a fat-derived antidiabetic and antiatherogenic factor,by nuclear receptors〔J〕.Diabetes,2003;52(7): 1655-63.
