老年类风湿关节炎患者骨密度变化及应用骨折危险性评估工具评估其骨折危险性
2014-09-13康日辉陈君敏叶德富曾晓虹
康日辉 薛 原 陈君敏 叶德富 郑 擎 曾晓虹
(福建医科大学附属第一医院风湿血液内科,福建 福州 350005)
类风湿关节炎(RA)可引起不同程度的骨量丢失,骨质破坏,晚期关节变形脱位,甚至致残。本文通过测定老年RA患者双股骨颈、腰椎1~4骨密度(BMD)与T值的变化,BMD与血清类风湿因子(RF)、环瓜氨酸肽抗体(CCP)、C-反应蛋白(CRP)、钙(Ca2+)、磷(P3-)、碱性磷酸酶(ALP)含量、红细胞沉降率(ESR)、28个关节活动指数评分(DAS28)及病程等指标的相关关系以及老年RA组患者双手关节X线正位片不同分期时的BMD变化,考查老年RA患者的BMD的变化情况。同时采用世界卫生组织(WHO)骨折危险性评估工具(FRAX)〔1〕评估老年RA患者10年内发生髋部骨折和主要骨质疏松性骨折的概率,观察其骨折的危险性。
1 对象与方法
1.1对象 老年RA组:2010年10月至2012年4月,在我院住院诊治的老年RA患者43例,男17例,女26例,年龄≥60岁,平均(67.25±11.71)岁,病程5.36±3.18年,均符合2009年ACR/EULAR修订的RA分类标准。排除标准:使用过糖皮质激素、肝肾疾病、内分泌疾病等患者。非老年RA组:同期在我院住院诊治的非老年RA患者41例,男16例,女25例,年龄<60岁,平均(35.75±10.62)岁,病程(4.22±2.01)年,均符合2009年ACR/EULAR修订的RA分类标准。排除标准:使用过糖皮质激素、肝肾疾病、内分泌疾病等患者。健康老年对照组:我院老年健康体检人员40例,男16例,女24例,年龄≥60岁,平均(65.76±11.66)岁。RA组与健康老年对照组相比,在年龄、性别构成、体重、吸烟、饮酒、内分泌疾病等指标差异均无统计学意义(P>0.05)。见表1。

表1 基础临床等情况比较±s,n=124)
1.2方法
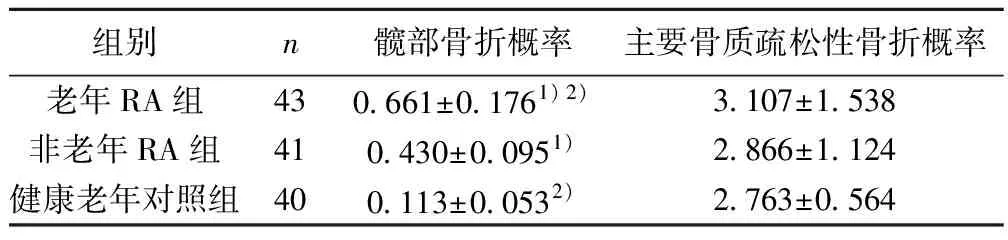
1.2.1BMD测定 使用美国GE LUNAR公司的prodigy型骨密度仪,通过双能X线吸收法(DEXA)测定老年RA组、非老年RA组与健康老年对照组双股骨颈、腰椎1~4BMD值。同时得出T值,根据WHO确定的诊断标准〔1〕,定义T>-1.0为正常,-2.5 1.2.2实验室测定 患者均检测血清RF、CCP、CRP、Ca2+、P3-、ALP含量及ESR。 1.2.3RA28个关节疾病活动指数(DAS28)。 1.2.4双手关节X线平片分期〔2〕Ⅰ期:关节周围软组织肿胀影、关节端骨质疏松;Ⅱ期:关节间隙变窄;Ⅲ期:关节面出现虫蚀样改变;Ⅳ期:关节半脱位,关节破坏后的纤维性和骨性强直。 1.2.5骨折危险性评估〔1〕根据FRAX的要求测定老年RA组、非老年RA组与健康老年对照组10年内发生髋部骨折和主要骨质疏松性骨折的概率。FRAX软件可通过登陆http://www.shef.ac.uk/FRAX/网站直接获取。 1.3统计学方法 应用SPSS10.0软件进行t检验,相关分析及方差分析。 2.1三组双股骨颈及腰椎1~4BMD检测结果 双股骨颈BMD值均显著降低,其差异具有统计学意义(P<0.05)。老年RA组与非老年RA组、健康老年对照组比较,双股骨颈及腰椎1~4BMD值均显著降低(P<0.05)。见表2,表3。 2.2老年RA组双股骨颈、腰椎1~4T值检测结果 见表4。由表4可见,老年RA组双股骨颈、腰椎1~4骨质疏松及骨量减少分别占67.70%和62.79%。 2.3老年RA组双股骨颈、腰椎1~4BMD与各指标的相关性 见表5。由表5可见双股骨颈BMD值与血清Ca2+含量呈正相关(r=0.435,P<0.05),腰椎1~4BMD值与血清Ca2+含量呈正相关(r=0.566,P<0.01);而与血清CRP、P3-、ALP 含量、ESR及病程均未见相关性。 表2 三组双股骨颈BMD检测结果±s,g/cm2) 表3 三组腰椎1~4BMD检测结果±s,g/cm2) 表5 老年RA组双股骨颈、腰椎1~4BMD与各指标的相关性(n=43) 2.4老年RA组双手关节X线平片分期BMD值的检测结果 老年RA组第Ⅳ期双股骨颈和腰椎1~4BMD值明显低于与第Ⅰ和Ⅱ、Ⅲ期(P<0.01;P<0.05)。见表6。 2.5评估老年RA组与对照组10年内髋部骨折概率与主要骨质疏松性骨折概率 见表7。老年RA组髋部骨折概率显著高于健康老年对照组(P<0.05);而主要骨质疏松性骨折概率差异未见统计学意义(P>0.05)。 表6 老年RA双手关节X线平片不同分期的双股骨颈和腰椎1~4BMD值的检测结果±s,g/cm2) 表7 评估老年RA组与对照组10年内髋部骨折概率与主要骨质疏松性骨折概率(%) 老年RA可引起BMD的变化,主要是出现骨质疏松(OP)或骨量减少,本组资料显示,老年RA患者存在骨质丢失的情况。国外的研究早已证实RA患者中存在较高的OP的发生率,2000年Haugeberg等〔3〕首次进行大样本的研究,报道RA患者中OP的发生率是正常人的2倍。本文与陆竞秋等〔4〕发现RA患者中骨量减少和骨质疏松的发生率分别为39. 6%和34. 0%的结果相似,提示RA患者的骨量丢失较正常人更为明显,其OP的发生率为正常人的1.52 倍,此与国外的研究结果相近〔5,6〕。Shibuoya〔7〕发现,与绝经后骨质疏松不同,RA相对来说脊柱骨质丢失较少,而外周关节骨丢失明显。Haugeberg等〔3〕与Eggelmejer等〔8〕的研究结果显示RA组L2~4BMD与正常人无差别,而以全髋部位BMD降低为主。本文提示RA患者BMD下降可能与钙丢失有关。骨质疏松随着RA病程的发展而加重。 老年RA并发OP或骨量减少的机制比较复杂,可能与以下因素有关:Yasuda等〔9〕发现了一种新的破骨细胞分化所必需的因子,即细胞核因子κB 受体活化因子配体(RANKL),另外一种受体是护骨素(OPG) ,OPG 与RANKL 的结合能力比RANK强,均可使RANKL表达上调。而在RA患者体内,T细胞和成纤维细胞等活化增殖,释放骨吸收因子如TNF-α、IL-6、IL-17、PTH 等,导致RANKL的大量释放,进而激活破骨细胞的分化与成熟,促进破骨而导致骨质的丢失。RA 所引起的骨质疏松,与疾病所处的阶段和疾病的活动程度有关。在Roldan 等〔10〕发现RA患者掌骨密度的下降在RA早期最为明显,而随着时间的推移,掌骨密度的下降逐渐减慢;同样随着疾病活动程度的增加,随着ESR的上升,下降幅度也是明显的加快。研究提示,RA 患者的骨质疏松与疾病的病程及活动程度呈正相关〔11〕。在疾病的早期(6个月至1年),患者可经历一个较明显的骨量下降;而且CRP升高的患者其BMD较低。本组资料未发现BMD与病程、血沉及CRP的关系,与有关文献报道不一致。 长期使用糖皮质激素可导致骨质疏松,它可抑制肠道对钙的吸收和促进尿钙的排泄从而导致血钙降低,促进骨吸收;并可抑制成骨细胞的矿化活性和胶原合成,增加破骨细胞的活性〔12〕。被认为是引起RA患者骨质疏松的一个重要原因。但是目前临床研究的结果存在差别,特别是小剂量的糖皮质激素(泼尼松≤7.5 mg/d)对RA患者BMD的影响存在争议〔13,14〕,因此对于RA 患者,小剂量激素引起BMD下降的风险应具体分析。 FRAX测评系统由WHO开发,用于评估患者10年内髋部骨折概率和10年内主要骨质疏松性骨折概率。英国的Kanis教授是这个工具的主要推广者和使用者〔15〕。本文提示髋部是RA患者骨折的好发部位,老年RA患者存在不同程度的BMD的降低,导致OP或骨量减少,FRAX测评结果显示老年RA患者10年内发生髋部骨折的危险性明显增加,应引起医生与患者的足够重视,积极采取必要的防治措施。 4 参考文献 1中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南〔J〕.中华医学会骨质疏松和骨矿盐疾病杂志,2011;4(1):2-17. 2陆再英,钟南山.内科学〔M〕.第7版.北京:人民卫生出版社,2008:848-55. 3Haugeberg G,Uhlig T,Filch JA,etal.Bone mineral density and frequency of osteoporosis in female patients with rheumatoid arthritis: result from 394 patients in the olso county rheumatoid arthritis register〔J〕.Arthritis Rheum,2000;43(7):522-30. 4陆竞秋,张林杰,徐胜前,等.类风湿关节炎患者的骨质疏松及其相关影响因素〔J〕.临床军医杂志,2008;36(4):499-501. 5Deodhar AA,Woolf AD.Bone mass measurement and bone metabolism in rheumatoid arthritis:a review〔J〕.Br J Rheumato J,1996;35(3):309-22. 6Urbanek R,Tlustochowicz W,Patola J,etal. Incidence of osteoporosis in patients with rheumatoid arthritis〔J〕.Przegl Lek,2000;57(1):103-7. 7Shibuya K,Hagino H,Morio Y,etal.Cross-sectional and longitudinal study of osteoporosis in patients with rheumatoid arthritis〔J〕.Clin Rheumatol,2002;21(1):150-8. 8Eggelmejer F,Camps JA,Valkema R,etal.Bone mineral density in ambulant,nonsteroid treated female patients with rheumatoid arthritis〔J〕.Clin Exp Rheumatol,1993;11(4):381-5. 9Yasuda H,Shima N,Nakagawa N,etal. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis inhibitory factor and is identical to TRANCE/RANKL〔J〕.Proc Natl Acad Sci USA,1998;95(1):3597-602. 10Roldan JF,Del Rincon I,Escalante A,etal.Loss of cortical bone from the metacarpal diaphysis in patients with rheumatoid arthritis: independent effects of systemic inflammation and glucocorticoids〔J〕.J Rheumatol,2006;33(5):508-16. 11Goldring SR ,Gravallese EM. Mechanisms of bone loss in inflammatory arthritis: diagnosis and therapeutic implications〔J〕. Arthritis Res,2000;2(1):33-7. 12Lane NE.An update on glucocorticoid-induced osteoporosis〔J〕.Rheum Dis Clin North Am,2001;27(4):235-53. 13Laan RF,van Riel PL,van Erning LJ,etal.Vertebral osteoporosis in rheumatoid arthritis patients:effect of low dose prednisone therapy〔J〕.Br J Rheumatol,1992;31(2):91-6. 14Haugeberg G,Strand A,Kvien TK,etal.Reduced loss of hand bone density with prednisone in early rheumatoid arthritis:results from a randomized placebo-controlled trial〔J〕.Arch Intern Med,2005;165(11):1293-7. 15Kanis JA,Johnell O,Johansson H ,etal. The use of clinical risk fractures the performance of BMD in the prediction of hip and osteoporotic fractures in men and women 〔J〕 . Osteoporotic Int,2007;18(2):1033-46.2 结 果




3 讨 论
