琐琐葡萄齐墩果酸对Aβ25~35诱导PC12细胞损伤的保护作用
2014-09-13袁芳刘涛马龙
袁 芳 刘 涛 马 龙
(新疆医科大学,新疆 乌鲁木齐 830011)
中药及保健功能性食物预防和治疗阿尔茨海默病(AD)的作用日益受到重视〔1〕。国内外研究显示,葡萄提取物能预防AD,对原花青素、白藜芦醇等葡萄提取物的抗痴呆作用报道较多,但未见对葡萄提取的三萜类物质研究〔2~4〕。琐琐葡萄为葡萄科葡萄属植物山葡萄,我国主产于新疆吐鲁番、和田、鄯善等地,是医药文献如《神农本草经》、《维吾尔药志》等所记载的药用葡萄品种之一。齐墩果酸(OA)是一种五环三萜类化合物,在琐琐葡萄提取的总三萜中的平均含量为65.52%。本研究通过建立AD大鼠模型,发现琐琐葡萄提取的总三萜具有抗AD作用〔5〕。本研究利用Aβ25~35诱导PC12细胞,制备具有拟AD样病理变化的体外细胞模型,研究OA对神经细胞的保护作用。
1 材料与方法
1.1药品试剂与仪器 琐琐葡萄购自新疆维吾尔自治区吐鲁番维药市场,新疆药物研究所鉴定。课题组提取OA,二甲亚砜(DMSO)溶解,0.22 μm尼龙滤膜过滤除菌,-20℃避光保存,临用时用完全培养基稀释,DMSO浓度低于1‰。DMEM培养液(美国Hyclone公司);胎牛血清(杭州四季青公司);Aβ25~35(Sigma公司);CCK-8检测试剂盒(武汉博士德生物工程有限公司);乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒(南京建成生物研究所);Annexin V-FITC细胞凋亡检测试剂盒(BioVision);Trizol(Invitrogen);逆转录试剂盒(TaKaRa),荧光定量(Invitrogen)。垂直流超净化台(美国Thermo公司),二氧化碳培养箱(美国Thermo公司),全自动酶标仪(美国Bio-Rad公司),流式细胞仪(BD LSRⅡ),倒置荧光显微镜(LEICA DFC490,德国),实时PCR仪(7700型,美国ABI公司)。
1.2Aβ25~35诱导 PC12 细胞损伤模型的建立 PC12细胞(高分化)购自中国科学院上海细胞生物学研究所。细胞常规培养,DMEM高糖培养基含10%灭活胎牛血清、100 U/ml青霉素、100 μg/ml链霉素,置37℃、5% CO2饱和湿度的恒温培养箱,隔天换液,3~4 d传代。取对数生长期的PC12细胞,计数后5×104/ml接种于96孔板,每孔100 μl,培养至贴壁后,分别加入0、10、20、30、40 μmol/L的Aβ25~35(1 mmol/L的Aβ25~35置于37℃老化7 d,临用前稀释),在孵箱中继续培养24 h后检测细胞的存活率。
1.3CCK-8试剂盒测定细胞存活率 对数生长期的PC12细胞5×104/ml接种于96孔板,保护组加入OA,终浓度为20、40、80 μg/ml,预处理4 h后,除对照组外加入Aβ25~35,使之终浓度为20 μmol/L,继续培养24 h,每孔加入CCK-8 10 μl,继续培养1 h,酶标仪450 nm测定吸光度,计算PC12细胞存活率。
1.4LDH检测 Aβ25~35诱导24 h后,分别收集各组细胞上清液,按试剂盒说明书操作,计算各组细胞上清液LDH活性。
1.5SOD、MDA检测 按上述方法收集各组细胞上清液,按试剂盒说明书操作,分光光度计测定吸光度,每组设5个复孔,实验重复3次。
1.6流式细胞术检测细胞凋亡 细胞接种于6孔板,按上述方法分组并培养细胞,将各组的细胞消化后收集,1 000 r/min离心5 min,用冷DMEM洗涤2次,结合缓冲液中重悬成单细胞悬液,密度为1×106/ml,室温下加入5 μl Annexin V-FITC和5 μl PI染料,轻轻振荡、混匀,室温下避光孵育15 min,流式细胞仪测定细胞凋亡率。
1.7实时荧光定量PCR检测NF-κB p65基因表达 细胞接种6孔板,按上述方法分组培养细胞,Trizol法提取各组细胞总RNA,紫外分光光度计分析RNA浓度和纯度。逆转录合成cDNA。cDNA 加入荧光定量PCR反应体系。根据GenBank序列,引物和探针设计软件Primer 5.0设计引物序列。所用的引物及内参β-actin引物由鼎国昌盛生物技术有限责任公司合成。数据采用双标准曲线法处理,样本的相对定量=目的基因含量/内参基因含量,计算待测组目的基因相对于对照组的表达差异倍数。引物序列见表1。

表1 引物序列
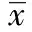
2 结 果
2.1Aβ25~35对PC12细胞活性的影响 终浓度分别为10、20、30、40 μmol/L的Aβ25~35与PC12细胞作用24 h后,与对照组(100%)细胞比较,细胞存活率逐渐降低,其IC50约为20 μmol/L。本课题后续实验采用20 μmol/L的Aβ25~35作用PC12细胞24 h制备AD细胞模型。
2.2OA对PC12细胞存活率的影响 与对照组比较,模型组细胞生长受到抑制,细胞存活率下降为68.03%(P<0.01);与模型组相比,OA保护组细胞存活率有明显增加(P<0.05)。见表1。
2.3OA对Aβ25~35诱导的PC12细胞LDH、SOD、MDA的影响 与对照组比较,模型组细胞的LDH活性明显增加、SOD活性明显下降、MDA含量增高(P<0.01);与模型组相比,OA组细胞LDH活性明显降低、SOD活性增加、MDA含量降低(P<0.01)。见表2。
2.4OA对PC12细胞凋亡率的影响 对照组细胞凋亡率(4.58%)明显低于模型组凋亡率(35.18%)(P<0.01);与模型组相比,80、40、20 μg/ml OA组凋亡率(8.88%、12.94%和15.15%)均明显下降(P<0.05)。
2.5NF-κB p65 mRNA表达 与对照组相比,模型组NF-κB p65表达上调(3.53±0.51 vs 1.00±0.00,P<0.01);与模型组相比,80、40、20 μg/ml OA保护组NF-κB p65表达降低(0.99±0.07、1.73±0.02、0.60±0.19,P<0.01)。

表1 OA对Aβ25~35诱导的PC12损伤的影响±s,n=4)

表2 OA对Aβ25~35诱导的PC12细胞SOD、MDA活性的影响±s,n=5)
3 讨 论
Aβ分子中决定其毒性的主要片段在25~35,常用于诱导AD的体外细胞模型〔6,7〕。PC12细胞为大鼠肾上腺髓质嗜铬细胞瘤克隆化的细胞株,1976年由Greene等建立,具有较典型的神经内分泌细胞特性,已广泛用作神经细胞体外模型〔8,9〕。本研究采用20 μmol/L Aβ25~35作用于PC12细胞24 h,结果显示模型组细胞存活率下降至58%,细胞凋亡率显著增加,表明此模型可以作为评价OA神经保护效果的神经损伤体外模型。
CCK-8试剂盒是检测细胞增殖、细胞毒性的试剂盒,为MTT法的替代方法,具有灵敏度高、数据可靠、重现性好的优点。LDH是细胞内标志酶,当细胞膜的完整性遭到破坏,胞质中LDH大量释放到细胞外,其漏出量与细胞受损程度相平行。因此,它们是检测细胞功能状态、受损程度和存活数量的重要指标。本实验结果表明OA对神经细胞的损伤具有保护作用。
在正常情况下,机体内自由基的产生和清除系统处于动态平衡状态,Aβ可通过诱导产生氧自由基使脑细胞膜系统的脂质和蛋白被氧化修饰,使活性氧增加,促进氧化反应和过氧化物形成,诱导氧化应激损伤,降低抗氧化作用,自由基损伤是Aβ发挥细胞毒性的方式之一。氧自由基也可促进生成Aβ,二者具有相互促进效应。神经细胞丢失是AD的一个重要特征,细胞凋亡是丢失的重要前提,Aβ能引起神经细胞的凋亡。SOD和MDA是反映自由基损伤最具有代表性指标。本实验结果提示细胞损伤与脂质过氧化有关,OA可能通过抗氧化、抗凋亡起到对神经细胞损伤的保护作用。
核因子-κB(NF-κB)是具有多向转录调节作用的蛋白质,NF-κB/IκB信号转导途径被认为是炎症及凋亡信号转导的关键。Aβ可以直接或间接产生氧自由基(ROS),ROS可激活神经元内的 NF-κB,进而通过炎症反应、氧化应激和细胞的凋亡等多途径参与 AD 的发病过程〔10〕。本研究提示Aβ25~35通过激活NF-κB信号通路,诱导NF-κBp65 mRNA过度表达,引起细胞凋亡;OA可降低Aβ诱导的NF-κB表达,抑制细胞凋亡,保护神经细胞。
本研究表明OA对AD细胞模型具有保护作用,通过其抗氧化活性增强清除氧自由基能力,减少脂质过氧化反应,调节NF-κBp65 mRNA的表达抑制神经细胞凋亡。OA作为一种天然化合物,不仅毒副作用低,而且可通过抗氧化、抑制细胞凋亡多方面保护神经细胞损伤,具有开发为抗痴呆、抗衰老药物前景,本实验为维药琐琐葡萄防治AD等神经系统疾病提供科学依据,为促进维药的理论发展,同时也为充分利用新疆丰富的葡萄资源,研发安全、有效、价廉AD民族新药提供新思路。
4 参考文献
1马 涛,张文生,王永彦.天然药物治疗阿尔茨海默病的研究进展〔J〕.北京中医药大学学报,2009;32(9):641-5.
2Wang J,Ho L,Zhao W,etal.Grape-derived polyphenolics prevent Aβ oligomerization and attenuate cognitive deterioration in a mouse model of Alzheimer′s disease〔J〕. J Neurosci,2008;28(25):6388-92.
3Ono K,Condron MM,Ho L,etal.Effects of grape seed-derived polyphenols on amyloid-protein self-assembly and cytotoxicity〔J〕. J Biol Chem,2008;283(47):32176-87.
4曹霞飞,郑 翔,吴 俊,等.白藜芦醇对甲醛诱导PC12细胞氧化损伤的影响〔J〕.中国老年学杂志,2011;31(8):3062-5.
5洪 玉,马 龙,周晓辉,等.葡萄皮提取物对拟痴呆模型大鼠干预作用的研究〔J〕.中国老年学杂志,2005;25(2):195-7.
6Vine HL,Walker LC.Molecular polymorphism of Aβ in Alzheimer′s disease〔J〕.Neurobio Aging,2010;31(4):542-8.
7王文君,李大金,李 君,等.中药复方更年春含药血清及其主要单体对β淀粉样蛋白所致细胞损伤的保护作用〔J〕.中西医结合学报,2010;8(1):67-71.
8Greene LA,Tischler AS.Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor〔J〕.Proc Natl Acad Sci U S A,1976;73(7):2424-8.
9Silva JP,Gomes AC,Coutinho OP.Oxidative DNA damage protection and repair by polyphenolic compounds in PC12 cells 〔J〕.Eur J Pharmacol,2008;601(1):50-60.
10Lee SY,Lee JW,Lee H,etal.Inhibitory effect of green tea extract on beta-amyloid-induced PC12 cell death by inhibition of the activation of NF-kappaB and ERK/p38 MAP kinase pathway through antioxidant mechanisms〔J〕.Brain Res Mol Brain Res,2005;140(1/2):45-54.
