复方健耳剂对DBA/2J小鼠耳蜗组织超氧化物歧化酶1表达的影响
2014-09-13黄正团周仲昭宣伟军
宣 毅 黄正团 周仲昭 宣伟军
(School of Engineering,Tufts University,Medford,Massachusetts 02155,USA)
细胞凋亡被认为是衰老的重要因素之一〔1〕,也是耳蜗损害的重要机制之一〔2〕。铜(Cu)、锌(Zn)、超氧化物歧化酶(SOD)是耳蜗最重要的自由基代谢酶,构成耳蜗抗氧化关键防御系统〔3〕。复方健耳剂具有对抗小鼠老年性耳蜗毛细胞、螺旋神经节神经元凋亡及疆孔神经纤维退变的作用〔4,5〕,本研究应用Real-Time PCR技术,以幼龄即开始出现听力衰退的DBA/2J小鼠作为试验对象〔6,7〕,观察复方健耳剂对小鼠耳蜗组织SOD1基因表达的影响。
1 材料与方法
1.1主要试剂与仪器 美国GeneCopoeia 公司提供: mRNA合成单链扩增的反转录试剂盒First Strand cDNA Synthesis Kit(Cat.No.C0210A );PCR(染料法)试剂All-in-OneTMQ-PCR Mix(Cat.No.D0101A);荧光定量PCR引物All-in-OneTMQ-PCR Primer(Cat.No.HQP006940) 。由美国Invitrogen公司提供总RNA抽提试剂TRIzol (Cat.No 15596-018)。美国Bio-Rad实时定量PCR检测系统:MyiQ5 Real Time PCR Detection System。日本TaKaRa常规PCR仪:PCR Thermal Cycler。美国Thermo Fisher Scientific紫外分光光度计:NanoDrop ND-1000。
1.2动物及分组 选择断奶1月龄、SPF级、健康DBA/2 J小鼠共10只,实验动物由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪)2007-0005。动物的雌雄不拘,随机平均分为对照组和中药组各5只。对照组小鼠食用小鼠常规饲料和饮用自来水。中药组小鼠食用相同的小鼠常规饲料,但饮用中药水煮溶液以代替日常饮水,各组均待小鼠成长至5月龄时终止实验,然后断头取两侧耳蜗置液氮中冰冻备用。
1.3实验药物及喂药 本次实验所用中药复方健耳剂选自原健耳Ⅱ号中成药胶囊配方,由黄芪、女贞子、丹参、郁金、绞股蓝等药组成,但改为原始汤剂口服液,即水煮3次,过滤,浓缩至1∶1.22,相当于1.22 ml含1 g生药材量。按照《中药药理研究方法学》〔8〕小鼠与成人用量换算法计算出小鼠用量应为,复方健耳剂0.7 ml·kg-1·d-1,并加上适量水配兑(一般为1 ml药液加20 ml水),盛在动物自吸喂养瓶内供小鼠饮用。在无其他水源供应的条件下,动物基本因口渴可饮下每日内服中药剂量。
1.4检测方法 选择PCR内参引物序列GAPDH:正义链(5′-3′):CTTGGGCTACACTGAGGACC,反义链(5′-3′):CATACCAGGAAATGAGCTTGAC。PCR目标引物序列SOD1:正义链(5′-3′)GGGTTCCACGTCCATCAGTA,反义链(5′-3′):AGTCACATTGCCCAGGTCTC。每组5对耳蜗标本在液氮中充分研磨成粉末状,加入到TRizol液中,震荡混匀,加入氯仿,振荡混匀,离心,相分离,取最上层,获得RNA样品,置入冷冻异丙醇的新离心管(DEPC处理管)中混匀,离心,RNA沉淀,冷冻75%乙醇,离心,RNA洗涤,去上清液,风干挥发乙醇,加入DEPC水,在Nanodrop上测定RNA浓度和OD 260/280比值,确认RNA没有蛋白等污染。RNA-Primer Mix 配制反应,离心,65℃RNA变性,在RNA-Primer Mix反应管内加入反转录反应液,离心后37℃孵育,85℃灭活处理,灭菌水稀释,-20℃保存反转录产物待用。制备PCR反应混合液,加入96孔板中,离心,确保所有反应液在反应孔底部。在MyiQ5 Real Time PCR Detection System中经温度梯度分别进行预变性、变性、退火、延伸等反应处理,测出内参基因GAPDH和目的基因SOD1在不同样本中扩增的Ct值。
1.5统计学方法 采用SPSS16.0软件行t检验。
2 结 果
对照组耳蜗组织SOD1表达量为1.624±0.425较中药组(5.114±2.432)明显降低(t=-3.817,P<0.019)。
3 讨 论
氧自由基升高或耗竭内源性抗氧化剂可导致神经细胞凋亡〔9~11〕。氧自由基诱导细胞凋亡的确切机制目前尚未完全阐明,一般认为,活性氧自由基(ROS) 可以通过脂质过氧化损伤DNA,影响信号传导以及参与调节细胞凋亡相关基因而诱导细胞凋亡。原癌基因Bcl-2是线粒体死亡途经中调控细胞凋亡的关键基因, Bcl-2抗凋亡的机制是通过抗氧化途径。在各种癌组织中,Bcl-2表现为过度表达,其抗细胞凋亡的功能大小与其表达水平密切相关。ROS是重要的细胞内分子传导信号,能够调控Bcl-2表达,从而影响Bcl-2的功能。研究已证实超氧化物阴离子(O2-)能够下调或降低Bcl-2表达,进而诱使蛋白酶体介导泛素依赖性的蛋白酶解反应,降解细胞质中的目标蛋白以及核内蛋白,导致细胞凋亡〔12〕。也有研究认为〔13〕,氧自由基能够引起DNA损伤,导致DNA 模板的构象变化,即 mtRNA 氧化损伤后可造成碱基片段丢失,碱基修饰及插入突变,导致多聚ADP 核糖聚合酶(PARP)活化,使糖氧化分解、电子传递和ATP 形成减慢,导致细胞内ATP池枯竭,DNA修复无效并发生片段化,成为细胞凋亡的触发因子,引起细胞凋亡。
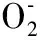
研究表明老年性聋与耳蜗感音神经细胞线粒体ROS积累并攻击损害细胞密切相关〔20〕。现代中药药理研究表明中药复方健耳剂所选药物具有广泛药理作用,符合针对老年性聋的现代多种病因学说。其中改善血循环,调节物质代谢,清除自由基可能是其有效保护耳蜗老年性退变的主要药理效应。自由基影响学说是机体衰老的重要机制之一。一方面氧自由基产生和积累过多,作用于生物膜上的多不饱和脂肪酸,产生脂质过氧化产物,从而破坏生物膜的完整性,引起毛细胞等代谢障碍〔21〕,或细胞内线粒体DNA损伤,导致基因突变,引起老年性聋〔22〕。复方健耳剂中已知所选药物如黄芪、女贞子、丹参、郁金、绞股蓝等能明显提高机体超氧化物歧化酶和谷胱苷肽酶含量和活性,和细胞膜Na+,K+-ATP酶活性,促进抗氧化,增强机体清除自由基能力,阻止细胞膜和线粒体膜脂质过氧化损伤,从而起到保护细胞膜和线粒体膜的作用〔23,24〕。本研究结果提示复方健耳剂能够促进抗氧化,增强细胞清除自由基能力,从而有效保护细胞膜和线粒体膜,起到对抗和延缓老年性聋的作用。因此,复方健耳剂对SOD1的表达影响可能是其有效对抗老年性耳蜗感音神经性损害的重要机制之一。
4 参考文献
1Seidman MD.Effects of dietary restriction and antioxidants on presbyacusis〔J〕.Laryngoscope,2000;110(5 Pt 1):727-38.
2Ikeda K,Sunose H,Takasaka T.Effects of free radicals on the intracellular calcium concentration in the isolated outer hair cell of the guinea pig cochlea〔J〕.Acta Otolaryngol,1993;113(2):137-41.
3Pierson MG,Gray BH.Superoxide dismutase activity in the cochlea〔J〕.Hear Res,1982;6(2):141-51.
4宣伟军,黄正团,丁大连.中药健耳Ⅱ号胶囊对抗C57BL/6J小鼠老年性耳蜗损害的实验研究〔J〕.听力学及言语疾病杂志,2007;15(1):47-50.
5宣伟军,丁大连.中药聪耳胶囊干预老年性耳蜗螺旋神经节和疆孔神经损害的实验研究〔J〕.中华中医药杂志,2007;22(6):355-9.
6Zheng QY,Johnson KR.Hearing loss associated with the modifier of deaf waddler (mdfw) locus corresponds with age-related hearing loss in 12 inbred strains of mice〔J〕.Hear Res,2001;154(12):45-53.
7Johnson KR,Zheng QY,Erway LC.A major gene affecting age-related hearing loss is common to at least ten inbred strains of mice〔J〕. Genomics,2000;70(2):171-80.
8陈 奇.中药药理研究方法学〔M〕.北京:人民卫生出版社,1993:1103-5.
9Franklin JL.Redox regulation of the intrinsic pathway in neuronal apoptosis〔J〕.Antioxid Redox Signal,2011;14(8):1437-48.
10Patten DA,Germain M,Kelly MA,etal.Reactive oxygen species:stuck in the middle of neurodegeneration〔J〕.J Alzheimers Dis,2010;20(Suppl 2):S357-67.
11Niizuma K,Yoshioka H,Chen H,etal.Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia〔J〕.Biochim Biophys Acta,2010;1802(1):92-9.
12Azad N,Iyer A,Vallyathan V,etal.Role of oxidative/nitrosative stress-mediated Bcl-2 regulation in apoptosis and malignant transformation〔J〕. Ann N Y Acad Sci,2010;1203:1-6.
13Matés JM,Sánchez-Jiménez FM.Role of reactive oxygen species in apoptosis:implications for cancer therapy〔J〕.Int J Biochem Cell Biol,2000;32(2):157-70.
14Balaban RS,Nemoto S,Finkel T.Mitochondria,oxidants,and aging〔J〕. Cell, 2005;120(4):483-95.
15Sun J,Folk D,Bradley TJ,etal.Induced overexpression of mitochondrial Mn-superoxide dismutase extends the life span of adult Drosophila melanogaster〔J〕.Genetics,2002;161(2):661-72.
16Runko AP,Griswold AJ,Min KT.Overexpression of frataxin in the mitochondria increases resistance to oxidative stress and extends lifespan in Drosophila〔J〕.FEBS Lett,2008;582(5):715-9.
17Schriner SE,Linford NJ,Martin GM,etal.Extension of murine life span by overexpression of catalase targeted to mitochondria〔J〕.Science,2005;308(5730):1909-11.
18Tabuchi K,Hoshino T,Hirose Y,etal.Age-related hearing loss and expression of antioxidant enzymes in BDF1 mice〔J〕.Acta Otolaryngol,2011;131(10):1020-4.
19McFadden SL,Ding D,Salvi R.Anatomical,metabolic and genetic aspects of age-related hearing loss in mice〔J〕.Audiology,2001;40(6):313-21.
20Someya S,Prolla TA.Mitochondrial oxidative damage and apoptosis in age-related hearing loss〔J〕.Mech Ageing Dev,2010;131(7-8):480-6.
21Dehne N,Lautermann J,Ten Cate WJ,etal.In vitro effects of hydrogen peroxide on the cochlear neurosensory epithelium of the guinea pig〔J〕. Hear Res,2000;143(1-2):162-70.
22Bai U,Seidman MD,Hinojosa R,etal.Mitochondrial DNA deletions associated with aging and possibly presbycusis:a human archival temporal bone study〔J〕.Am J Otol,1997;18(4):449-53.
23王浴生,邓文龙,薛春生.中药药理与应用〔M〕.第2版.北京:人民卫生出版社,2000:125-7,190-200,669-71,983-98.
24王本祥.现代中药药理学〔M〕.天津:天津科学技术出版社,1999:1228-30.
