基于VSIG4的腺病毒对1型糖尿病的治疗
2014-09-13石雁冰张兰举邢立志张媛媛马桂洁李树法
石雁冰 张兰举 邢立志 张媛媛 马桂洁 李树法
(贵阳中医学院第一附属医院门诊部,贵州 贵阳 550002)
1型糖尿病(T1DM)是由淋巴细胞介导的以胰岛β 细胞特异性损伤导致胰岛素生成绝对不足为特征的一种自身免疫性疾病〔1, 2〕。目前T1DM以胰岛素终身替代疗法和非特异性免疫抑制为主要治疗手段,其费用高昂且副作用大,急需寻找一种特异性免疫干预策略〔3, 4〕。研究表明,诱导自身反应性CD8+T细胞的免疫耐受是一种有效的T1DM治疗策略,可减缓甚至完全阻断T1DM的发生和发展〔5, 6〕。含V-set和免疫球蛋白域4(VSIG4)是一种新发现的B7家族相关蛋白,具有抑制T细胞活化的作用,是一个有力的T细胞活化负调节分子〔7〕。在本实验中,制备VSIG4腺病毒,并观察对NOD小鼠的CD8+T 细胞的抑制效应和血糖水平的调节作用。
1 材料与方法
1.1材料 8月龄NOD小鼠购自北京医科大学动物实验中心。重组VSIG4 (Ad-VSIG4) 腺病毒和携带β-半乳糖苷酶(LacZ) 基因的重组腺病毒(Ad-LacZ) 由上海生工制备。CD8+T 细胞分离试剂盒购自Miltenyi 公司。ELISPOT检测干扰素(IFN)-γ试剂盒购于法国DIACLONE公司。其他为常用试剂。
1.2动物免疫 分别用含1×109pfu的Ad-VSIG4或Ad-LacZ的重组腺病毒及磷酸盐缓冲液(PBS)分三组免疫8月龄NOD小鼠。背侧尾根部皮下注射3次,间隔1 w。
1.3小鼠脾脏淋巴细胞悬液制备 NOD小鼠最后一次免疫后1 w,颈椎脱臼法处死小鼠,无菌分离小鼠脾脏放于冷Hank液中,剪碎并反复碾磨通过200目的无菌铜网,收集悬液并用红细胞溶解液去除红细胞,再用大量Hank's 液洗涤细胞2次,1 200 r/min离心10 min,用RPMI1640培养液重悬,计数。
1.4免疫磁珠分选(MACS) 纯化CD8+T细胞 取4×107细胞,1 200 r/min 离心10 min,去上清液后用160 μl 缓冲液重悬,加40 μl 抗体Cocktail 充分混匀,4℃孵育10 min。加160 μl缓冲液,1 200 r /min离心10 min,去上清液,再加入320 μl 缓冲液、80 μl磁性微珠,充分混匀,4℃孵育15 min。用适量缓冲液冲洗,1 200 r /min离心10 min。吸除上清液,用500 μl 缓冲液重悬细胞, 200 目筛网过滤成无气泡的单细胞悬液。将MACS细胞分离柱置于MACS 磁力架上,先用500 μl 缓冲液洗柱,再将细胞悬液通过MACS 柱,1 500 μl 缓冲液洗涤,收集流出液体,离心收集细胞,计数。
1.5ELISPOT检测 参照ELISPOT(IFN-γ)试剂盒使用说明书进行检测。调整细胞为1×106个/ml,于96孔培养板中每孔加入100 μl细胞悬液,各设3个复孔,孵育48 h。阴性对照不加细胞孵育,计数各孔出现的色斑数目。
1.6淋巴细胞增殖能力检测 调整细胞为1×106个/ml,于96孔培养板中每孔加入100 μl细胞悬液,加入终浓度为IFN 100 μg/ml的insulin蛋白,培养72 h。每孔再加入0.1 ml浓度为1×103μCi/L的3H-胸腺嘧啶核苷(3H-TdR) 溶液,继续培养12 h,用PBS漂洗细胞3次,甲醛固定10 min,再用4℃预冷的体积分数为5%的三氯醋酸溶液漂洗3次,每孔加入0.5 ml浓度为0.3 mol/L的NaOH溶液,60℃水浴反应30 min,冷却至室温,转移入闪烁瓶中,加入5 ml 闪烁液,用液体闪烁计数器计数每分钟的闪烁次数(cpm),测定DPM 值(反映细胞DNA 合成速率),重复测定3 次。
1.7NOD小鼠血糖水平检测 NOD小鼠最后一次免疫后1 w, 每2 w检测血糖浓度,当连续2次的血糖浓度>11.1 mmol/L时,定义为糖尿病。
1.8统计学方法 应用SPSS10. 0软件行t检验。
2 结 果
2.1ELISPOT检测结果 实验组小鼠CD8+T细胞的IFN-γ分泌数量为(44±6)个,而Ad-LacZ和PBS对照组的IFN-γ分泌数量为(99±14)个和(107±19)个。实验证明VSIG4腺病毒能有效抑制NOD小鼠淋巴细胞的活化。
2.2淋巴细胞增殖结果 实验组小鼠CD8+T细胞的cpm值为(36 700±2 900),而Ad-LacZ和PBS对照组的cpm值为(50 600±5 700)和(53 500±6 600)。实验证明VSIG4腺病毒能有效抑制NOD小鼠CD8+T细胞的增殖。
2.3血糖水平抑制结果 实验组小鼠18周龄开始出现血糖异常,30周龄的糖尿病发病率为30%,而对照组小鼠12周龄开始出现血糖异常,30周龄的糖尿病发病率高达80%。实验证实VSIG4腺病毒病能够有效延迟NOD小鼠糖尿病的发病时间,并降低糖尿病的发病率。见图1。
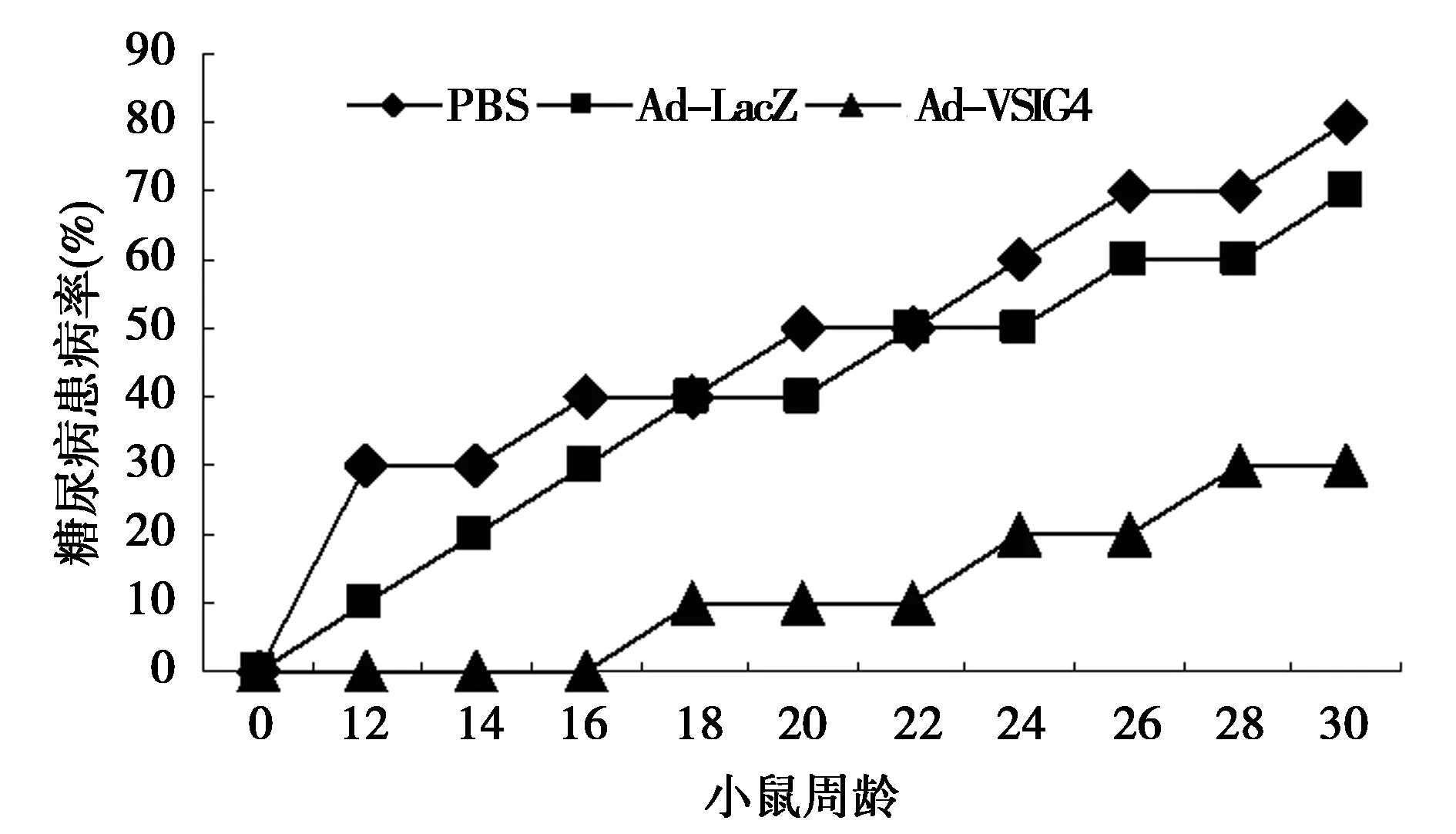
图1 各实验组NOD小鼠的糖尿病发病率
3 讨 论
目前普遍认为T1DM是在遗传和环境因素共同作用下,由T淋巴细胞介导的器官特异性自身免疫性疾病〔8, 9〕。主要是由于免疫系统的异常,CD4+和CD8+T淋巴细胞对胰岛的浸润,引发胰岛炎症并导致对胰岛β细胞的损伤,使胰岛素分泌绝对减少,引起体内胰岛素绝对缺乏从而导致血糖持续升高,产生T1DM〔10, 11〕。多种免疫机制参与T1DM的发病,为糖尿病的预防提供了途径和方向。研究数据表明,应用免疫调节药物和细胞等手段可以抑制胰岛炎症作用,减少β细胞的免疫破坏及凋亡,诱导特异性免疫耐受,从而达到预防及阻止糖尿病发病。
VSIG4又称补体受体免疫球蛋白超家族分子CRIg,是一种新发现的B7家族相关蛋白。VSIG4的mRNA高表达于成人肺、胎盘、肝和心脏等组织,但VSIG4主要局限表达于巨噬细胞,在单核细胞中几乎没有表达,并且当巨噬细胞受外来刺激活化后VSIG4表达下调〔12〕。既往研究发现,VSIG4是巨噬细胞上的补体受体,可结合补体C3的降解片段C3b和iC3b,对于病原体的吞噬起重要作用〔13〕。最近的研究显示,VSIG4有抑制T细胞活化的作用,且作用强于PD-Ls/PD-1途径,是一个有力的T细胞活化负调节分子〔14〕。但目前未有VSIG4抑制T1DM中CD8+T 细胞的活化的报道。
综上所述,VSIG4腺病毒能抑制NOD小鼠体内CD8+T细胞介导的免疫应答,为T1DM的免疫耐受诱导治疗提供了理论依据。
4 参考文献
1Tisch R, McDevitt H. Insulin-dependent diabetes mellitus〔J〕. Cell,1996;85(3):291-7.
2Castano L, Eisenbarth GS. Type-I diabetes: a chronic autoimmune disease of human, mouse, and rat〔J〕. Ann Rev Immunol,1990;8():647-79.
3Churchill JN, Ruppe RL, Smaldone A. Use of continuous insulin infusion pumps in young children with type 1 diabetes: a systematic review〔J〕. J Pediatr Health Care,2009;23(3):173-9.
4Moghissi ES. Insulin strategies for managing inpatient and outpatient hyperglycemia and diabetes〔J〕. M Sinai J Med,2008;75(6):558-66.
5Walter U, Santamaria P. CD8+T cells in autoimmunity〔J〕. Curr Opin Immunol,2005;17(6):624-31.
6Hanninen A, Jalkanen S, Salmi M,etal. Macrophages, T cell receptor usage, and endothelial cell activation in the pancreas at the onset of insulin-dependent diabetes mellitus〔J〕.J Clin Invest,1992;90(5):1901-10.
7Zang X, Allison JP. To be or not to be B7〔J〕.J Clin Invest,2006;116(10):2590-3.
8Ludvigsson J. Therapy with GAD in diabetes〔J〕. Diabet Metab Res Rev,2009;25(4):307-15.
9Bagley J, Paez-Cortez J, Tian C,etal. Gene therapy in type 1 diabetes〔J〕. Crit Rev Immunol,2008;28(4):301-24.
10Mallone R, van Endert P. T cells in the pathogenesis of type 1 diabetes〔J〕. Curr Diab Rep,2008;8(2):101-6.
11James EA, Kwok WW. CD8+suppressor-mediated regulation of human CD4+T cell responses to glutamic acid decarboxylase 65〔J〕. Eur J Immunol,2007;37(1):78-86.
12Walker MG. Z39Ig is co-expressed with activated macrophage genes〔J〕.Biochim Biophys Acta,2002;12;1574(3):387-90.
13Lee MY, Kim WJ, Kang YJ,etal. Z39Ig is expressed on macrophages and may mediate inflammatory reactions in arthritis and atherosclerosis〔J〕.J Leukoc Biol,2006;80(4):922-8.
14Vogt L, Schmitz N, Kurrer MO,etal. VSIG4, a B7 family-related protein, is a negative regulator of T cell activation〔J〕.J Clin Investi,2006;116(10):2817-26.
