Orexin受体拮抗剂:治疗失眠的新途径
2014-09-12韩璐薇王志强周长林
韩璐薇,张 仓,王志强,周长林
(1.中国药科大学生命科学与技术学院,江苏 南京 210009;2.南京圣和药业有限公司,江苏 南京 210038)
Orexin受体拮抗剂:治疗失眠的新途径
韩璐薇1,2,张 仓2,王志强2,周长林1*
(1.中国药科大学生命科学与技术学院,江苏 南京 210009;2.南京圣和药业有限公司,江苏 南京 210038)
Orexin受体有2种亚型,即orexin-1受体和oerxin-2受体,为下丘脑外侧神经元中的2个G蛋白偶联受体,其内源性配体分别为orexin-A和-B。研究发现,动物或人的orexin神经元损伤后会引起嗜睡症,且orexin受体在调节睡眠-觉醒周期方面发挥重要作用。因此,开发orexin受体拮抗剂,成为改善睡眠和治疗失眠的一条新途径。简介orexin及其受体,综述orexin信号通路对睡眠-觉醒的调控作用与机制以及orexin受体拮抗剂的研究与开发。
orexin受体拮抗剂;失眠;orexin信号通路;睡眠-觉醒周期
20世纪末,Sakurai研究小组在寻找体内新的信号分子时发现了orexin神经肽(简称orexin)及其受体,最初他们认为这类肽可以促进摄食,故将其中高度同源的2种肽分别命名为orexin-A和orexin-B,orexin源于希腊语“食欲”的orexis(Sakurai等,Cell,1998年)。鉴于orexin由下丘脑产生,与肠促胰岛素家族肽有一定的相似性,故de Lecea研究小组又将这2种肽命名为下丘泌素-1和下丘泌素-2(deLecea等,Proc Natl Acad Sci USA,1998年)。在过去的十几年中,人们发现,虽然orexin增加食欲的作用甚微,却可调控睡眠-觉醒周期。有研究表明orexin神经元受损是引起嗜睡症的主要原因[1],这一结论引起了广大医药研究者的浓厚兴趣,从而开创了以orexin受体为靶标开发失眠治疗药物的新途径。
1 Orexin及其受体
Orexin-A 和-B 均由orexin前体裂解产生(Sakurai等,Cell,1998年),其中,orexin-A 是由33个氨基酸组成的多肽,含有2个链内二硫键,而orexin-B是由28个氨基酸组成的线性肽或具有两个α螺旋的肽链(Lee等,Eur J Biochem,1999年)。Orexin存在于大多数脊椎动物体内,且在人和鼠之间高度保守(Sakurai等,Cell,1998年);其产生于下丘脑背外侧核和穹隆周区核团的一簇神经元,贮存在囊泡中,大多由神经元突触释放(España等,Neuroscience,2001年)。Orexin神经元在人脑中共有50000~80000个[2],在许多脑区有着广泛的投射(Peyron等,J Neurosci,1998年),主要为一些调节觉醒和活动的核心脑区,包括含去甲肾上腺素能神经元的蓝斑核(LC)、含组胺能神经元的结节乳头核(TMN)、含5-羟色胺能神经元的中缝核(RN)和含多巴胺能神经元的腹侧被盖区(VTA),其在基底前脑和大脑皮层中可支配胆碱能和非胆碱能神经元。通过这些投射,orexin系统能有效协调包括觉醒相关的神经系统通路的激活。
Orexin受体属于G蛋白偶联受体,目前发现其有2种亚型:orexin-1受体(orexin-1 receptor,OX1R)和orexin-2受体(orexin-2 receptor,OX2R),两者均具有一个7次跨膜的结构域,与其他神经肽受体有着一定的相似性,且在哺乳动物中高度保守,在人和大鼠中其氨基酸序列相似度可达94%。orexin作为内源性配体,可选择性地与这2种受体结合(Sakurai等,Cell,1998年)。
使用放射性标记配体进行的受体竞争性结合试验显示,orexin-A抑制orexin-B与OX1R和OX2R结合的IC50分别为20和38 nmol·L-1,而orexin-B抑制orexin-A与OX1R和OX2R结合的IC50分别为420和36 nmol·L-1。且orexin-A和-B激活CHO细胞上表达的OX1R而促进钙内流的EC50分别为30和2500 nmol·L-1。提示,虽然OX1R与OX2R的氨基酸序列相似度为94%,但OX1R对orexin-A的亲和力明显高于对orexin-B,而OX2R对orexin-A和-B的选择性较弱,与二者都具有高亲和力(Sakurai等,Cell,1998年)。尽管OX1R和OX2R与其他的神经肽受体在结构上有一定的相似度,但它们与神经肽Y、分泌素或其他相似的肽都无明显的亲和力(Holmqvist等,Neurosci Lett,2001年)。由于orexin及其受体主要分布在大脑,少量分布在其他组织和器官(Sakurai等,Cell,1998年),尤其oreixn受体在脑外的表达很少,故orexin拮抗剂不会产生明显的外周作用。
2 Orexin信号通路对觉醒-睡眠的调控作用与机制
谷氨酸、甘氨酸、GABA、5-羟色胺(5-HT)、多巴胺(DA)、去甲肾上腺素(NE)、组胺(HA)、乙酰胆碱(ACh)、腺苷、神经肽、细胞因子和前列腺素(PG)等神经递质和神经调质组成一个控制睡眠-觉醒的复杂网络[3]。啮齿类动物脑内注射orexin-A和-B后,可通过直接引起LC、TMN、RN、基底前脑和皮层的神经元兴奋,显著增加动物的觉醒时间(Eriksson等,J Neurosci,2001年)。在生理条件下,orexin神经元在觉醒时处于激活状态,而在快速眼球运动(REM)和非REM睡眠时响应降低直至沉默[4]。因此,大鼠神经元细胞外orexin-A水平在活动期和觉醒期较高,在睡眠期则大约降至其峰值的1/2(Yoshida等,Eur J Neurosci,2001年)。在松鼠猴中也观察到类似现象,在白天结束时其脑内出现高水平的orexin-A,而其在夜晚若继续保持清醒状态,脑内orexin-A水平也会一直保持在高水平[5]。因此,orexin在活动期内可促进啮齿类动物和灵长类动物的觉醒。
Orexin对人和鼠的正常觉醒的调控也起重要作用。嗜睡症患者存在慢性且严重的嗜睡现象,其除了脑脊液的orexin-A水平明显减少外,产生orexin的神经元约有90%受损[6]。敲除orexin基因的小鼠也存在严重的嗜睡现象,并在活动期不能保持长时间的清醒;更重要的是,这些小鼠有着接近正常小鼠的总觉醒次数,但其清醒时间明显较短,且能很快从觉醒转换到睡眠状态[7]。Orexin信号通路被阻断的大鼠和犬也会在觉醒期出现短时间睡眠的现象[8]。这说明orexin对维持正常且稳定的觉醒非常重要。
OX1R和OX2R在调节睡眠-觉醒中所发挥的作用也越来越引人关注。OX1R基因缺失的小鼠并无明显的睡眠-觉醒异常,但OX2R被阻断,会导致小鼠出现无猝倒的中度嗜睡[9],而若同时缺少这2种受体,小鼠会出现与orexin基因敲除后相似的症状,产生严重的嗜睡,甚至个别会出现猝倒现象[10]。提示,阻断OX2R的药物可起一定的改善睡眠作用,同时阻断OX1R和OX2R的药物则会对失眠产生更好的疗效。
通常,OX1R与Gq蛋白偶联,OX2R则与Gq或Gi/ Go蛋白偶联,参与信号转导,其偶联机制与细胞类型有关(Randeva等,J Clin Endocrinol Metab,2001年)。Orexin的急性作用主要是通过离子通道产生效应,如一些orexin神经元可通过抑制钾离子通道而产生作用[3];而且,orexin也可通过激活电压门控性钙离子通道和瞬时受体电位通道或诱导胞内钙库释放,快速且稳定地增加胞内钙离子浓度[11],最终促进钠/钙交换,导致靶神经元兴奋[12]。除了这些突触后作用外,orexin还可作用于神经末梢的突触前受体,诱导γ-氨基丁酸(GABA)或谷氨酸的释放,产生更加复杂的下游信号(Liu等,J Neurosci,2002年)。此外,orexin信号通路可持久地提高神经元兴奋性,如在中脑腹侧被盖区,orexin能致使细胞膜上N-甲基-D-天冬氨酸(NMDA)受体数量增加,使神经元对谷氨酸产生更多的兴奋应答[13]。通过这些机制,orexin产生促进觉醒的作用。
产生orexin的神经元同时也可产生谷氨酸、强啡肽和其他源于强啡肽前体的神经肽[6]。如orexin可引起TMN神经元兴奋,并与强啡肽共同作用,可降低抑制性突触后电位,对增强TMN神经元的兴奋性产生协同作用[14]。且实验研究发现,与orexin神经元缺失小鼠相比,仅缺乏orexin的小鼠并不会出现明显的肥胖和REM 睡眠调节异常[15]。可见,orexin受体拮抗剂只阻断orexin的作用,并不影响orexin神经元协同释放的其他神经递质的正常神经学作用。
3 Orexin受体拮抗剂的研究与开发
自从发现orexin与维持觉醒有关后,orexin受体拮抗剂作为一种潜在的原发性失眠治疗药物受到医药界广泛关注,药物开发商相继研发出一系列小分子orexin受体拮抗剂,如OX1R/OX2R双重拮抗剂almerexant和suvorexant可明显延长啮齿类动物和犬的睡眠时间,临床研究也表明其可有效改善人类的睡眠。虽然目前尚无orexin受体拮抗剂获准上市,但爱可泰隆(Actelion)、葛兰素史克(GlaxoSmithKline,GSK)和默克(Merck)等制药公司已报道了若干新研发的orexin受体拮抗剂用于治疗失眠的临床前和临床研究数据。
3.1 SB-649868
GSK公司早期研发了一系列杂环脲类orexin受体拮抗剂,如OX1R拮抗剂SB-334867以及人OX1R(hOX1R)选择性拮抗剂SB-408124、SB-410220和SB-674042(Rodgers等,Eur J Neurosci,2001年),这些OX1R选择性拮抗剂对肥胖、药物成瘾、恐慌症等具有潜在治疗作用[16]。近期的动物实验研究表明,具独特活性的OX1R拮抗剂或可用于治疗临床上以强烈情绪唤醒为特征的焦虑症[17]。GSK公司科研人员通过对以上化合物的优化,研制出OX1R/ OX2R双重拮抗剂SB-649868(1),发现其可改善大鼠和狨猴的REM和非REM睡眠[18]。

临床研究显示,SB-649868用于健康受试者,可发挥催眠作用,但不诱导非REM睡眠发生明显改变,因此显著优于苯二氮类药物;且其通过拮抗OX1R/OX2R而诱导的睡眠具有自发睡眠的特征[19]。因噪声干扰而出现失眠的健康志愿者在服用本品10和30mg后,可剂量依赖性地增加睡眠时间,次日晨也无后遗效应;且本品可致使失眠患者持续性睡眠和入睡后觉醒(WASO)转换的潜伏期缩短,总睡眠时间增加[18]。由于未公开的临床前毒性数据,本品在2007年年底被搁置,目前停滞在临床Ⅱ期试验阶段。
3.2 Almorexant
2007年,爱可泰隆公司公布了Almorexant(ACT-078573, 2)作为有效的OX1R/OX2R双重拮抗剂的详细研究资料,其可竞争性拮抗OX1R和非竞争性拮抗OX2R[20],对hOX1R和hOX2R的IC50分别为13和8nmol·L-1,它对其他潜在的90个受体或酶均无亲和力[21]。该化合物与鼠和人的血浆蛋白结合率约为99%,大鼠和犬的口服生物利用度分别为8% ~34%和18% ~49%,可透过血脑屏障,尤其犬的经口给药吸收较好(Tmax为0.5~2h),代谢半衰期为8~9h;大鼠在活动期接受灌胃给予本品,可剂量依赖性地增加REM和非REM睡眠,且连续5个晚间接受本品治疗后,药效并无下降;本品所致大鼠非REM睡眠时间的增加值虽小于吡唑坦,但其致REM睡眠时间的增加值却大于吡唑坦,而且吡唑坦连续给药后,会产生耐药性;此外,在睡眠期给予本品,对睡眠无影响,表明本品在动物的orexin水平较高和觉醒时给药才有效[22]。

爱可泰隆公司公布的本品Ⅰ期临床数据显示,健康的年轻志愿者接受本品1000mg治疗后,耐受性良好,且未出现严重的毒副反应;本品口服吸收迅速(Tmax为1.0~2.3h),呈现双相消除动力学,半衰期分别为6.1和19.0h;本品200~1000mg剂量组受试者进入非REM睡眠的潜伏期显著缩短,睡眠时间和睡意均有增加[23]。在原发性失眠患者中进行的Ⅱ期临床研究显示,本品能显著改善受试者的睡眠效率,缩短其持续性睡眠与WASO转换的潜伏期,并呈剂量依赖性,与安慰剂组相比,受试者在睡眠前服用本品400mg后,当晚的睡眠效率明显提高(+14%),持续性睡眠与WASO转换的潜伏期明显缩短(-18 vs -54min);本品可致受试者的REM睡眠时间增加,进入REM睡眠的潜伏期缩短,尤其是主观睡眠质量明显改善;在有效剂量范围内,本品受试者未出现苯二氮类药物使用者常见的次日后遗效应,耐受性良好,且无猝倒、入睡幻觉和睡眠瘫痪等不良反应,这表明急性且短期地阻断orexin受体,并不会引起嗜睡症样症状[20]。2008年,GSK与爱可泰隆公司开始本品的Ⅲ期临床研究,但在2011年1月,由于发现本品可产生与orexin系统功能无关的副作用,随即中止了该项研究[24]。
3.3 Suvorexant
默克公司以几个不同母环结构为基础开发了一系列orexin受体拮抗剂,其中脯氨酸双酰胺系列的DORA-1和具有N,N-二取代-1,4-二氮杂环庚烷骨架的DORA-5都为有效的OX1R/OX2R双重拮抗剂[25],可减少orexin诱导的大鼠活动,且剂量依赖性地增加其睡眠[26-27]。随后,通过对DORA系列化合物的构效关系分析以及结构优化,合成了化合物suvorexant(MK-4305,3)。
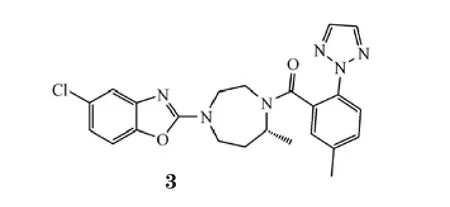
Suvorexant作为一个有效的二氮杂环庚烷系列的选择性OX1R/OX2R双重拮抗剂,在细胞水平上表现出对orexin受体的纳摩尔级拮抗作用,对OX1R和OX2R的IC50分别为50和56nmol·L-1,且相较于对其他170个受体和酶的选择性均超过6000倍。本品具有较好的口服生物利用度(大鼠:19%,犬:56%),并能透过血脑屏障[28]。在啮齿动物实验中,10、30、100mg·kg-1的本品可剂量依赖性地致使受试动物非REM睡眠(Ⅰ、Ⅱ相)和REM睡眠时间分别成比例增加10% ~25%和27% ~48%,入睡的潜伏期缩短24% ~41%,同时本品受试动物觉醒期的自发活动较未给药对照组动物减少29% ~79%[29]。
2012年6月,默克公司公布的在原发性失眠患者中进行的两项关键性Ⅲ期临床实验结果显示,与安慰剂组相比,本品(30或40mg,qd)受试者服药后第1夜的睡眠时间明显增加,且连续用药3个月后,其入睡时间明显缩短;两项实验中本品受试者的持续睡眠潜伏期分别显著缩短10.3和21.7min,WASO潜伏期分别显著缩短38.4和42min;本品受试者既未出现严重的与用药相关的不良反应,也未观察到猝倒等嗜睡症样症状,无明显的次日后遗效应,且未见停药后出现反跳性失眠[30]。2012年11月8日,美国FDA已受理本品的新药申请(NDA),有望于2014年一季度获准上市。此外,默克公司还开发了另一具不同母环结构的OX1R/OX2R 双重拮抗剂——MK-6096(4),其Ⅱ期临床研究已完成[31]。

3.4 其他
由R&D Systems公司旗下子公司Tocris研发的选择性OX2R拮抗剂TCS-OX2-29(5)对hOX2R的IC50为40 nmol·L-1,相较于对hOX1R的选择性达250倍。且体内实验显示,该化合物(40 nmol)经侧脑室给药后,可致受试大鼠的总睡眠和REM睡眠时间分别增加7.0%和6.8%[32]。美国强生公司开发的选择性OX2R拮抗剂JNJ-10397049(6)以3 mg·kg-1剂量给药后,可明显缩短受试大鼠持续睡眠的潜伏期,并增加其REM 睡眠和非REM睡眠时间,且致总睡眠时间较未给药组大鼠增加42%[33]。

4 结语
可调节睡眠-觉醒的orexin系统的发现开启了抗失眠药物研发新领域之门,orexin受体拮抗剂的开发为原发性失眠患者提供了新的治疗选择。Orexin受体拮抗剂具有独特的选择性作用机制,大大降低了苯二氮类抗失眠药物所引起失衡等副作用,因此该类药物的开发尤其对老年失眠患者无疑是一个福音。可以期待,随着人们对orexin受体及其信号通路研究的不断深入,将会有更多安全有效的orexin受体拮抗剂类抗失眠药物被开发出来,造福于更多失眠患者。
[1]唐吉友.Orexin与发作性睡病的研究进展[J].国际神经病学神经外科学杂志, 2008, 35(6):500-503.
[2]Fronczek R, Lammers G J, Balesar R, et al. The number of hypothalamic hypocretin(orexin)neurons is not affected in Prader-Willi syndrome[J]. J Clin Endocrinol Metab, 2005, 90(9):5466-5470.
[3]Hoang Q V, Bajic D, Yanagisawa M, et al.Effects of orexin(hypocretin) on GIRK channels [J]. J Neurophysiol, 2003, 90(2):693-702.
[4]Lee M G, Hassani O K, Jones B E. Discharge of identified orexin/ hypocretin neurons across the sleep-waking cycle [J]. J Neurosci, 2005, 25(28):6716-6720.
[5]Zeitzer J M, Buckmaster C L, Parker K J, et al. Circadian and homeostatic regulation of hypocretin in a primate model: implications for theconsolidation of wakefulness [J]. J Neurosci, 2003, 23(8):3555-3360.
[6]Crocker A, España R A, Papadopoulou M, et al. Concomitant loss of dynorphin, NARP, and orexin in narcolepsy [J]. Neurology, 2005, 65(8):1184-1188.
[7]Diniz Behn C G, Klerman E B, Mochizuki T, et al. Abnormal sleep/wake dynamics in orexin knockout mice [J]. Sleep, 2010, 33(3):297-306.
[8]Beuckmann C T, Sinton C M, Williams S C, et al. Expression of a polyglutamine-ataxin-3 transgene in orexin neurons induces narcolepsycataplexy in the rat [J]. J Neurosci, 2004, 24(18):4469-4477.
[9]Willie J T, Chemelli R M, Sinton C M, et al. Distinct narcolepsy syndromes in orexin receptor-2 and orexin null mice: molecular genetic dissection of non-REM and REM sleep regulatory processes [J]. Neuron, 2003, 38(5):715-7130.
[10]Hondo M, Nagai K, Ohno K, et al. Histamine-1 receptor is not required as a downstream effector of orexin-2 receptor in maintenance of basal sleep/wake states [J]. Acta Physiol, 2010, 198(3):287-294.
[11]Peltonen H M, Magga J M, Bart G, et al. Involvement of TRPC3 channels in calcium oscillations mediated by OX1 orexin receptors [J]. Biochem Biophys Res Commun, 2009, 385(3):408-412.
[12]Acuna-Goycolea C, van den Pol A N. Neuroendocrine proopiomelanocortin neurons are excited by hypocretin/orexin [J]. J Neurosci, 2009, 29(5):1503-1513.
[13]Borgland S L, Storm E, Bonci A. Orexin B/hypocret in 2 increases glutamatergic transmission to ventral tegmental area neurons [J]. Eur J Neurosci, 2008, 28(8):1545-1556.
[14]Eriksson K S, Sergeeva O A, Selbach O, et al. Orexin (hypocretin)/dynorphin neurons control GABAergic inputs to tuberomammillary neurons [J]. Eur J Neurosci, 2004, 19(5):1278-1284.
[15]Kantor S, Mochizuki T, Janisiewicz A M, et al. Orexin neurons are necessary for the circadian control of REM sleep[J].Sleep, 2009, 32(9):1127-1134.
[16]Sakurai T, Mieda M.Connectomics of orexin-producing neurons:interface of systems of emotion, energy homeostasis and arousal [J]. Trends Pharmacol Sci, 2011, 32(8):451-462.
[17]Rodgers R J, Wright F L, Snow N F, et al. Orexin-1 receptor antagonism fails to reduce anxiety-like behaviour in either plus-mazenaÏve or plus-maze-experienced mice [J]. Behav Brain Res, 2013, 243(2):213-219.
[18]Mitra K, Peterson L. Abstracts, American Chemical Society Division of Chemical Toxicology, 238th National Meeting and Exposition, Washington, DC, August 16-20, 2009 [J]. Chem Res Toxicol, 2010, 23(1):264-290.
[19]Bettica P, Squassante L, Groeger J A, et al. Differential effects of a dual orexin receptor antagonist(SB-649868)and zolpidem on sleep initiation and consolidation, SWS, REM sleep, and EEG power spectra in a model of situational insomnia [J]. Neuropsychopharmacology, 2012, 37(5):1224-1233.
[20]Hoever P, Dorffner G, Benes H, et al. Orexin receptor antagonism, a new sleep-enabling paradigm:a proof-of-concept clinical trial [J]. Clin Pharmacol Ther, 2012, 91(6):975-985.
[21]Boss C, Brisbare-Roch C, Jenck F. Biomedical application of orexin/ hypocretin receptor ligands in neuroscience [J]. J Med Chem, 2009, 52(4):891-903
[22]Malherbe P, Borroni E, Pinard E, et al. Biochemical and electrophysiological characterization of almorexant, a dual orexin 1 receptor(OX1)/orexin 2 receptor(OX2) antagonist:comparison with selective OX1 and OX2 antagonists [J]. Mol Pharmacol, 2009, 76(3):618-631.
[23]Brisbare-Roch C, Dingemanse J, Koberstein R, et al. Promotion of sleep by targeting the orexin system in rats, dogs and humans[J]. Nat Med, 2007, 13(2):150-155.
[24]Actelion.Actelion and GSK discontinue clinical development of almorexant[EB/OL].(2011-01-28)[2013-01-30].http:// www1.actelion.com/en/our-company/news-and-events/index. page?newsId=1483135.
[25]Bergman J M, Roecker A J, Mercer S P, et al. Proline bisamides as potent dual orexin receptor antagonists [J]. Bioorg Med Chem Lett, 2008, 18(4):1425-1430.
[26]Winrow C J, Tanis K Q, Reiss D R, et al. Orexin receptor antagonism prevents transcriptional and behavioral plasticity resulting from stimulant exposure [J]. Neuropharmacology, 2010, 58(1):185-194.
[27]Whitman D B, Cox C D, Breslin M J, et al. Discovery of a potent, CNS-penetrant orexin receptor antagonist based on an N, N-disubstituted-1, 4-diazepane scaffold that promotes sleep in rats [J]. Chem Med Chem, 2009, 4(7):1069-1074.
[28]Cox C D, Breslin M J, Whitman D B, et al. Discovery of the dual orexin receptor antagonist[(7R)-4-(5-chloro-1, 3-benzoxazol-2-yl)-7-methyl-1, 4-diazepan-1-yl][5-methyl-2-(2H-1, 2, 3-triazol-2-yl)phenyl]methanone(MK-4305)for the treatment of insomnia [J]. J Med Chem, 2010, 53(14):5320-5332.
[29]Winrow C J, Gotter A L, Cox C D, et al. Promotion of sleep by suvorexant-a novel dual orexin receptor antagonist [J]. J Neurogenetics, 2011, 25(1/2):52-61.
[30]Merck.Merck making news[EB/OL].(2012-06-13)[2013-01-30]. http://www.mercknewsroom.com/press-release/researchdevelopment-news/new-phase-iii-data-showed-mercksinvestigational-insomnia-me.
[31]Merck.Polysomnography study of MK6096 in patients with primary insomnia(6096-011)[EB/OL].(2012-03-25)[2013-1-30]. http://www.clinicaltrials.gov.
[32]Kummangal B A, Kumar D, Mallick H N. Intracerebroven-tricular injection of orexin-2 receptor antagonist promotes REM sleep [J]. Behav Brain Res, 2013, 237(1):59-62.
[33]Dugovic C, Shelton J E, Aluisio L E, et al. Blockade of orexin-1 receptors attenuates orexin-2 receptor antagonism-induced sleep promotion in the rat [J]. J Pharmacol Exp Ther, 2009, 330(1):142-151.
Orexin Receptor Antagonists: a Promising Approach to the Treatment of Insomnia
HAN Luwei1,2, ZHANG Cang2, WANG Zhiqiang2, ZHOU Changlin1
(1. School of Life Science and Technology, China Pharmaceutical University, Nanjing 21009, China; 2. Nanjing Sanhome Pharmaceutical Co. , Ltd. , Nanjing 210038, China)
Orexin receptors are classified into two subtypes, orexin-1 receptor(OX1R) and orexin-1 receptor(OX2R), which are G-protein coupled receptors found in the lateral hypothalamic neurons. Their endogenous ligands are orexin-A and -B. In some studies it has been suggested that the damage of the orexin neurons can cause narcolepsy in humans and rodents, and orexin receptors many play an important role in the regulation of sleep-wake cycle. Therefore, the development of orexin receptor antagonists has become a promising approach for encouraging better sleep and treating insomnia. Orexin and its receptors were briefly introduced. The regulation function and mechanism of orexin signaling pathway on sleep-wake and the research and development of orexin receptor antagonists were reviewed.
orexin receptor antagonist; insomnia; orexin signaling pathway; sleep-wake cycle
R971.3
A
1001-5094(2014)02-0120-05
接受日期:2013-09-17
*通讯作者:周长林,教授;
研究方向:微生物代谢调控和生物活性物质、抗感染药物药效学及机制;
Tel:025-83271323;E-mail:cl_zhou@cpu.edu.cn
