黄荆子乙酸乙酯提取物体内抗炎作用及机制
2014-09-12宁映霞陈砚芬贺韩臻郑喆文
白 军,宁映霞,陈砚芬,贺韩臻,郑喆文
(1.深圳市龙岗区妇幼保健院妇产科,广东深圳518172;2.广州医科大学附属第一医院妇产科,广东广州510120;3.武汉市妇女儿童医疗保健中心妇产科,湖北武汉430000)
黄荆(VitexnegundoL)为被子植物马鞭草科的牡荆属植物,分布于我国20余省,以秦巴山区资源最为丰富,黄荆果实(子)、叶、枝及根均可入药,其味苦,性温,具有清热解表,得湿解毒、止咳平喘作用,主治咳嗽、哮喘、风湿、肿痛等[1]。黄荆子为黄荆的果实,目前,对黄荆的研究主要集中在黄荆子的化学提取物上,如黄酮类、二萜类等化合物。黄荆子乙酸乙酯提取物(the extract from semenviticis negundo with acetoactate,EVn-50)是从黄荆子中提取的黄酮类化合物,有研究报道EVn-50在体外抗肿瘤的效用[2],但是其传统的抗炎作用尚未见报道,故本研究建立常见的几种急性炎症模型,分别施以不同浓度的EVn-50,探讨其体内抗炎效果及其可能的分子生物学机制。
1 材料与方法
1.1 材料与试剂
EVn-50购自北京中医药大学,地塞米松(恒瑞医药),二甲苯、0.7%醋酸、去甲斑蝥素(北京第三制药厂),兔抗p38MAPK(Beyotime公司),GAPDH(Abzoom公司),ELISA酶联免疫吸附试剂盒(Beyotime公司);健康成年雄性SD大鼠50只,体重225-250 g,由北京维通利华实验动物技术公司提供(合格证:0093102,许可证:SCXK(京)2012-0011);ICR小鼠50只,体重18-24 g(由北京维通利华实验动物技术公司提供(合格证:0093109,许可证:SCXK(京)2012-0001),于无菌屏蔽环境(百级无菌室)中饲养。
1.2 试验方法
1.2.1 二甲苯致小鼠耳廓肿胀模型实验 ICR小鼠随机分成5组,每组5只,即5、10、20 mg/kg EVn-50组、1 mg/kg地塞米松(DEX)组和生理盐水(NS)组。灌胃给药1 h后,给小鼠右侧耳缘注射30 μg二甲苯,2.5 h后处死小鼠,用直径为9 mm的打孔机以肿胀中心为圆心切取肿胀耳缘,然后称取肿胀组织重量,并记录肿胀程度,计算并比较不同受试药物对肿胀的抑制率[3]。
1.2.2 鸡蛋清致大鼠足跖肿胀模型实验 SD大鼠随机分成5组,每组5只,即12.5、25、50 mg/kg EVn-50组、2.5 mg/kg DEX组和NS组。灌胃给药1 h后,给SD大鼠右侧足跖注射10%新鲜鸡蛋清悬液0.05 mL,足跖体积分别在0、0.5、1、2、3、4和6 h被检测。并记录肿胀程度,计算并比较不同受试药物对肿胀的抑制率[4]。
1.2.3 腹腔注射0.7%醋酸小鼠腹腔毛细血管通透性增高模型实验 ICR小鼠随机分成5组,每组5只,即5、10、20 mg/kg EVn-50组、1 mg/kg DEX组和NS组。灌胃给药1 h后,经小鼠尾部静脉注射10 ml/kg生理盐水稀释的依文思蓝溶液。然后每只小鼠腹腔注射0.7%的醋酸溶液0.2 mL,30 min后,处死小鼠,打开腹腔,收集腹腔溶液,并用10 mL的生理盐水冲洗腹腔,离心腹腔收集液,去除污染物,溶液采用比色法用分光光度计在590mm波长进行检测,血管通透效应用吸光度(A)来表达,它代表依文思蓝染液总的腹腔渗出量。计算并比较不同受试药物对腹腔毛细血管通透性的抑制率[5]。
1.2.4 腹腔注射去甲斑蝥素对大鼠全身性炎症模型实验 SD大鼠随机分成5组,每组5只,即50、100、200 mg/kg EVn-50组、5 mg/kg DEX组和NS组。灌胃给药1 h后,每只大鼠腹腔注射15 mg/kg的去甲斑蝥素溶液0.2 mL,24 h后,心脏穿刺缺血并处死大鼠,检测血液白细胞数值和C反应蛋白[6]。
1.2.5 Westernblot印迹检测全身性炎症大鼠模型血白细胞p38MAPK蛋白表达情况 处死腹腔注射去甲斑蝥素诱导的大鼠全身性炎症模型大鼠,收集血液,离心提取炎性大鼠白细胞,加入细胞裂解液,提取白细胞蛋白,取30 μg定量蛋白SDS-PAGE电泳分离并转移至PVDF膜上,再用5%脱脂牛奶-TBST室温摇床封闭2 h,于37℃下孵育一抗和二抗,ECL发光剂激发荧光,压片显影定影[7]。结果用灰度扫描仪处理分析,以上实验重复3次。
1.2.6 ELISA方法检测全身性炎症大鼠模型血清中TNF-α、IL-1、IL-6、COX-2的水平 处死腹腔注射去甲斑蝥素诱导的大鼠全身性炎症模型大鼠,收集血液。用纯化的抗体包被微孔板,制成固相载体,在微孔板中依次加入标本或标准品生物素化的抗TNF-α、IL-1、IL-6、COX-2抗体,HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的TNF-α、IL-1、IL-6、COX-2的浓度呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),计算抗炎因子浓度,测定血清中TNF-α、IL-1、IL-6、COX-2的含量[8]。
1.3 统计学处理
2 结果
2.1 EVn-50对二甲苯致小鼠耳廓肿胀的抑制作用
口服EVn-50可以显著抑制二甲苯致小鼠耳廓肿胀,5、10、20 mg/kg的EVn-50对二甲苯致小鼠耳廓肿胀抑制率分别为20.6%、26.3%和32.5%,与NS对照组比较,组间差异有统计学意义(P<0.05),而DEX组对二甲苯致小鼠耳廓肿胀抑制率为28.2%,与10 mg/kg组的EVn-50相当,两组间比较差异无统计学意义(P>0.05),见图1。

图1 EVn-50对二甲苯致小鼠耳廓肿胀的抑制效果
2.2 EVn-50对鸡蛋清致大鼠足跖肿胀抑制作用
口服EVn-50可以显著抑制鸡蛋清致大鼠足跖肿胀,50 mg/kg的EVn-50对鸡蛋清致大鼠足跖肿胀抑制作用发生在3、4、6 h,与NS对照组比较差异有统计学意义(P<0.05);25 mg/kg的EVn-50对鸡蛋清致大鼠足跖肿胀抑制作用发生在4、6 h,与NS组比较差异有统计学意义(P<0.05);在0.5、1和2 h内,与NS组比较,25 mg/kg和50 mg/kg的EVn-50对鸡蛋清致大鼠足跖肿胀抑制率均无统计学意义(P>0.05);与NS组比较,12.5 mg/kg的EVn-50对鸡蛋清致大鼠足跖肿胀抑制作用率无统计学意义(P>0.05);而2.5 mg/kg DEX组对鸡蛋清致大鼠足跖肿胀抑制作用从0.5h开始就很明显,与NS组比较,各时间段均有统计学意义(P<0.05),见图2。

图2 EVn-50对鸡蛋清致大鼠足跖肿胀抑制效果
2.3 EVn-50对腹腔注射07%醋酸小鼠腹腔毛细血管通透性抑制作用
口服EVn-50可以显著抑制腹腔注射0.7%醋酸引起的小鼠腹腔毛细血管通透性,5、10、20 mg/kg的EVn-50对腹腔注射0.7%醋酸后,小鼠腹腔依文思蓝染液渗出抑制率分别为24.0%、35.8%和45.5%,与NS对照组比较,组间差异有统计学意义(P<0.05),而DEX组对腹腔注射0.7%醋酸小鼠腹腔毛细血管通透性抑制率为43.8%,与10 mg/kg组的EVn-50相当,两组间比较差异无统计学意义(P>0.05),见图3。

图3 EVn-50对腹腔注射07%醋酸小鼠腹腔毛细血管通透性抑制效果
2.4 EVn-50对腹腔注射去甲斑蝥素诱导的全身性炎症大鼠模型的作用
口服EVn-50可以显著下调腹腔注射去甲斑蝥素诱导全身炎性大鼠血液炎性细胞的表达。50、100、200 mg/kg的EVn-50对大鼠血液白细胞总数(WBC)、中性粒细胞比率(NEUTP)、淋巴细胞比率(LYMPHP)和CRP的下调率与NS对照组比较,组间差异有统计学意义(P<0.05),而DEX组对腹腔注射去甲斑蝥素诱导全身炎性大鼠血液WBC、NEUTP和CRP表达下调率与100 mg/kg组的EVn-50相当,两组间比较差异无统计学意义(P>0.05),见表1。
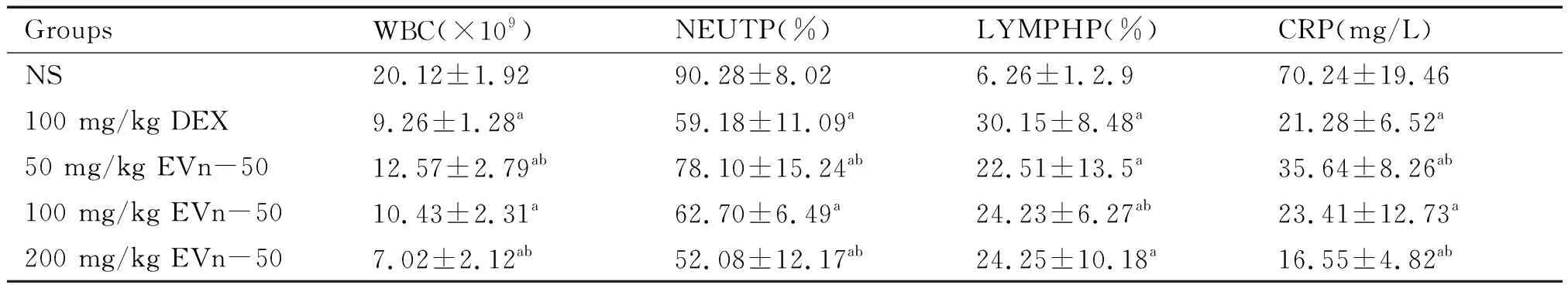
表1 EVn-50对腹腔注射去甲斑蝥素诱导的全身炎性大鼠模型血液白细胞及CRP的影响
注:与NS组比较,aP<0.05;与DEX组比较,bP<0.05
2.5 EVn-50对腹腔注射去甲斑蝥素诱导的全身性炎症大鼠模型血液白细胞p38MAPK蛋白表达的影响
口服EVn-50可以显著下调腹腔注射去甲斑蝥素诱导全身性炎性大鼠血液白细胞p38MAPK蛋白表达,50、100、200 mg/kg的EVn-50对大鼠白细胞p38MAPK的下调率分别为21.0%、36.8%和48.6%,与NS对照组比较,组间差异有统计学意义(P<0.05),而DEX组对腹腔注射去甲斑蝥素诱导的全身性炎大鼠血液白细胞p38MAPK蛋白表达下调率为44.8%,与100 mg/kg组的EVn-50相当,两组间比较差异无统计学意义(P>0.05),见图4。
2.6 EVn-50对腹腔注射去甲斑蝥素诱导的全身性炎症大鼠模型血液细胞因子表达的影响
口服EVn-50可以显著下调腹腔注射去甲斑蝥素诱导全身炎性大鼠血液胞TNF-α、IL-1、IL-6、COX-2细胞因子的表达。50、100、200 mg/kg的EVn-50对大鼠血液TNF-α、IL-1、IL-6、COX-2的下调率与NS对照组比较,组间差异有统计学意义(P<0.05),而地塞米松组对腹腔注射去甲斑蝥素诱导全身炎性大鼠血液TNF-α、IL-1、IL-6、COX-2表达下调率与100 mg/kg组的EVn-50相当,两组间比较差异无统计学意义(P>0.05),见表2。
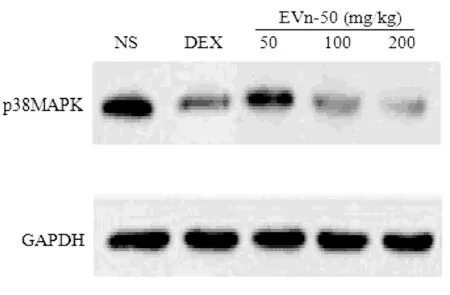

图4 EVn-50对腹腔注射07%醋酸小鼠腹腔

GroupsTNF-αIL-1IL-6COX-2NS136.28±19.211150.02±20.24104.28±21.93210.23±39.48100mg/kg DEX59.24±12.82a490.18±109.07a68.54±12.42a40.23±11.56a50 mg/kg EVn-5080.56±27.93ab890.16±152.24ab97.59±33.58ab156.45±28.67ab100 mg/kg EVn-5063.46±23.12a520.23±64.86a73.36±33.27a83.45±12.73a200 mg/kg EVn-5050.26±21.05ab340.86±25.45ab62.54±30.41ab28.56±4.68ab
注:与NS组比较,aP<0.05;与DEX组比较,bP<0.05
3 讨论
黄荆子为马鞭草科牡荆属植物黄荆(VitexnegundoL)的干燥成熟果实,其性温,味辛、苦;归肺、胃、肝经;具有祛风解表,止咳平喘,理气消食止痛的功效,主治伤风感冒,咳嗽,哮喘,胃痛吞酸,消化不良,食积泻痢,胆囊炎,胆结石,疝气[1];在民间,黄荆子能够以多种形式包括单方、复方,内服煎汤或入丸、散,治疗一些炎症相关的疾病,疗效显著,如哮喘、慢性气管炎、胃溃疡和慢性胃炎、肠炎;在临床上,黄荆子焙干研末,炼蜜为丸,可治疗慢性气管炎[2]。现代药理学研究表明,黄荆子具有多种药理作用,如镇咳平喘、抗炎镇痛、抗氧化、抗微生物、保肝以及免疫增强作用等,EVn-50是从黄荆果实中提取的黄酮类化合物,有研究报道EVn-50在体外有抗氧化、抗肿瘤的效用[2],但是传统的抗炎作用及其可能的机制尚未见报道,故本研究建立急性炎症模型,分别施以不同浓度的EVn-50,探讨其体内抗炎的效果及其可能的分子生物学机制。
MAPK(Mitogen-activated protein kinase)信号转导通路是真核细胞转导信号到细胞内重要信号转导通路之一,参与细胞的生长、分化以及细胞间相互作用[9]。当细胞受到刺激后,通过某些环节使MAPK激酶激酶(MAPKKK)活化,活化的MAPKKK激活MAPK激酶(MAPKK),后者通过双位点磷酸化激活p38MAPK。MKK3和MKK6是p38MAPK主要的上游激酶[9]。p38MAPK被磷酸化激活后,移位入核,作用于活化转录因子ATF2、CHOP10等,进而活化选择素和整合素来招募和活化白细胞,使白细胞粘附于血管壁,进入到周围组织,调节TNF-α、IL-1、IL-6、COX-2等炎性细胞因子的表达[10],而炎性细胞因子则参与体内具体的炎症反应的发生发展。p38MAPK特异性抑制剂SB203580可通过抑制p38MAPK酶活性,减少或阻断多种炎性介质的产生,从而减轻炎症反应。MAPK信号转导通路在炎症的发生发展中具有积极的意义,有望成为炎症治疗的的一个新的靶点[11]。
本研究提示,EVn-50可以显著改善二甲苯致ICR小鼠耳廓急性炎性肿胀症状,鸡蛋清致SD大鼠足跖急性炎性肿胀症状,降低腹腔注射0.7%醋酸致ICR小鼠腹腔毛细血管的通透性,减少去甲斑蝥素诱导的SD大鼠全身性炎症血液白细胞总数中中性粒细胞比率和CRP,同时去甲斑蝥素诱导的SD大鼠全身性炎症血液白细胞p38MAPK蛋白表达降低,去甲斑蝥素诱导的SD大鼠全身性炎症血液中TNF-α、IL-1、IL-6、COX-2等细胞因子数量减少。这提示EVn-50可能通过抑制p38MAPK细胞信号转导通路来抑制急性炎症反应。黄荆子作为祖国传统中药,长期应用于抗炎、平喘等治疗实践中,具有安全、可靠、无毒副作用的长期临床验证,因此EVn-50有望成为一种新的理想的抗炎药物,具有广阔的开发前景,但目前EVn-50的抗炎研究还处在实验阶段,相关的机制需进一步探明。
参考文献:
[1]Chattopadhyay P,Hazarika S,Dhiman S,et al.Vitex negundo inhibits cyclooxygenase-2 inflammatory cytokine-mediated inflammation on carrageenan-induced rat hind paw edema [J]. Pharmacognosy Res,2012,4(3):134-137.
[2]Zhou Y,Liu YE,Cao J,et al.Vitexins,nature-derived lignan compounds,induce apoptosis and suppress tumor growth [J]. Clin Cancer Res,2009,15(16):5161-5169.
[3]Ma Y,Li Y,Li X,et al.Anti-inflammatory effects of 4-methylcyclopentade- canone on edema models in mice[J].Int J Mol Sci,2013,14(12):23980-23992.
[4]Okoye FB,Osadebe PO.A new anti-inflammatory flavonol glycoside from Alchornea floribunda leaves[J].Nat Prod Res,2010,24(3):266- 273.
[5]Koppula S,Kim WJ,Jiang J,et al. Carpesium macrocephalum attenuates lipopolysaccharide-induced inflammation in macrophages by regulating the NF-κB/IκB-α,Akt,and STAT signaling pathways[J].Am J Chin Med,2013,41 (4):927-943.
[6]Massicot F,Dutertre-Catella H,Pham-Huy C,et al.In vitro assessment of renal toxicity and inflammatory events of two protein phosphatase inhibitors cantharidin and nor-cantharidin[J]. Basic Clin Pharmacol Toxicol,2005,96(1):26-32.
[7]Cho MK.Decreased Expression of Type 5 17β-Hydroxysteroid Dehydrogenase (AKR1C3) Protein Identified in Human Diabetic Skin Tissue[J].Ann Dermatol,2013,25(4):423-427.
[8]Abd-Allah SH,Pasha HF,Hagrass HA,et al.Vitamin D status and vitamin D receptor gene polymorphisms and susceptibility to type 1 diabetes in Egyptian children[J]. Gene,2013,(13):1693-1694.
[9]Lombaert IM,Abrams SR,Li L,et al.Combined KIT and FGFR2b Signaling Regulates Epithelial Progenitor Expansion during Organogenesis[J].Stem Cell Reports,2013,1(6):604-619.
[10]Roy R,Parashar V,Chauhan LK,et al.Mechanism of uptake of ZnO nanoparticles and inflammatory responses in macrophages require PI3K mediated MAPKs signaling[J].Toxicol In Vitro,2013,(13):321-324.
[11]Palmieri D,Capponi S,Geroldi A,et al.TNFα induces the expression of genes associated with endothelial dysfunction through p38MAPK-mediated down- regulation of miR-149 [J].Biochem Biophys Res Commun,2014,443(1):246-251.
