瑞舒伐他汀联合氯沙坦对氧化修饰低密度脂蛋白诱导的人单核-巨噬细胞组织因子表达的影响及机制
2014-09-12宋海彬申晓彧
赵 丰 宋海彬 张 羽 申晓彧
(山西医科大学第二临床医院心血管内科,山西 太原 030001)
冠状动脉粥样硬化斑块由稳定转为不稳定、破裂进而形成血栓,是急性冠脉综合征最主要的发病机制〔1〕。冠状动脉损伤后启动凝血瀑布反应形成血栓,组织因子(TF)参与了此重要过程。有实验证实〔2〕,氧化修饰低密度脂蛋白(ox-LDL)作用于巨噬细胞,大多数的巨噬细胞发生凋亡并表达TF。瑞舒伐他汀作为新一代HMG-CoA还原酶抑制剂,可明显下调低密度脂蛋白、甘油三酯及升高高密度脂蛋白, 氯沙坦是广泛用于临床的长效血管紧张素Ⅱ受体拮抗剂(ARB),临床上两药常联合使用应用于冠心病的二级预防。两药联合能否进一步降低TF mRNA和蛋白的表达,国内外文献未见报道。本实验旨在研究瑞舒伐他汀联合氯沙坦对ox-LDL诱导的单核-巨噬细胞TF mRNA和蛋白表达的影响并探讨其可能机制。
1 材料与方法
1.1材料 健康成人静脉血来自山西医科大学第二临床医院体检中心;人淋巴细胞分离液(Lymphocytes Separation Medium1077)为上海华精生物高科技有限公司产品;RPMI-1640培养液;胎牛血清为杭州四季青公司产品;ox-LDL为北京协生生物科技有限公司产品;佛波酯为美国SIGMA公司产品;FITC-CD14抗体购自日本Beckman Coulter公司;超纯RNA提取试剂盒、HiFi-MMLV cDNA第一链合成试剂盒、UltraSYBR Mixture(with Rox)、Dnase1 均购自北京康为世纪生物科技有限公司;TRIzol购自天根生化科技有限公司;引物序列由上海生工生物有限公司合成;瑞舒伐他汀为阿斯利康公司馈赠;氯沙坦为默沙东公司馈赠。
1.2人单核细胞的分离 取新鲜的健康人静脉血30 ml,普通肝素抗凝后分到10个试管中。用RPMI-1640液稀释1倍后,充分吹打混匀,分别缓慢加入有等比例淋巴细胞分离液的离心管中,离心2 000 r/min,20 min后,吸取中间环状云雾状淋巴细胞层,再用PBS缓冲液3 ml充分混匀,1 500 r/min离心洗涤2次。取含10%胎牛血清RPMI-1640各5 ml,将试管中的细胞吹开混匀,然后将细胞悬液分别加入培养瓶中。于37℃、5%的CO2培养箱中静置孵育,培养至4代后,取指数生长期细胞用于诱导转化实验。
1.3人单核细胞来源的巨噬细胞的诱导转化、培养与鉴定 向单核细胞培养基中加入160 nmol/ml的佛波脂无胎牛血清的RPMI-1640培养液培养24 h,待细胞转化为巨噬细胞后用RPMI-1640培养基洗涤3次。将细胞置于含10%胎牛血清的RPMI-1640培养液中继续培养48 h,细胞由悬浮生长变为贴壁生长,且伸出伪足。台盼蓝染色测定细胞存活率>95%。采用特异荧光素标记的CD14细胞表面抗体行流式细胞仪鉴定巨噬细胞。
1.4试验分组 试验共分4个组。ox-LDL对照组,单核-巨噬细胞培养基中加入ox-LDL 50 μg/ml孵育48 h;瑞舒伐他汀组,ox-LDL 50 μg/ml孵育2 h后,加入瑞舒伐他汀0.1 μmol/L培养48 h;氯沙坦组,ox-LDL50 μg/ml孵育2 h后,加入氯沙坦0.001 mmol/L培养48 h;ox-LDL 50 μg/ml孵育2 h后,加入瑞舒伐他汀0.1 μmol/L联合氯沙坦0.001 mmol/L培养48 h。
1.5各组TF mRNA表达水平检测 弃培养板中的培养液,每孔加入1.0 ml Trizol,依次加入氯仿、异丙醇沉淀,75%乙醇洗涤后略晾干,溶于30 μl RNase-free 水中。取5 μl RNA用1%琼脂糖凝胶进行电泳鉴定RNA;反转录反应 用HiFi-MMLV cDNA第一链合成试剂盒进行反转录,反转录反应在20 μl体系中进行:含Primer mix 2 μl、RNA Template 2 μl、RT Mix,5×4 μl,HiFi-MMLV Enzyme Mix 1 μl、RNase-Free 水11 μl。于PCR仪上42℃反应1 h,70℃灭活10 min。得到的cDNA可在-20℃保存;TF上游引物序列:5′-CCGACGAGATTGTGAAGGATGTG-3′,下游序列:5′-TTGTT- GGCTGTCCGAGGTTTGT-3′。PCR反应条件:95℃预变性10 min,95℃变性15 s,60℃退火60 s,72℃延伸60 s,循环40次。β-actin上游引物序列:5′-CCTGAGGCACTCTTCCAG-3′,下游引物序列:5′-TCACACTTCATGATGGA-3′,产物大小100 bp;结果分析:反应完成后即得Ct值。mRNA表达相对量用2-ΔΔCt表示,其中ΔΔCt=(Ct靶基因-Ct内参)处理组-(Ct靶基因-Ct内参)未处理组,以ox-LDL组为未处理组。
1.6TF蛋白含量测定 取六孔培养板的上清液进行ELISA测定,实验操作严格按照试剂盒说明书进行,每组重复4次。
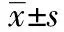
2 结 果
2.1PCR产物的确定分析 TF基因RT-PCR产物的融解曲线峰值为82.5℃。融解曲线无切迹,锋线锐利,证实其RT-PCR产物特异性强,无异常扩增。
2.2对ox-LDL诱导人单核-巨噬细胞TF mRNA表达影响 瑞舒伐他汀组、氯沙坦组与ox-LDL组比较,TF mRNA表达减少,差异具有统计学意义(P<0.05)。瑞舒伐他汀联合氯沙坦组与瑞舒伐他汀组、氯沙坦组比较,TF mRNA表达减少,差异具有统计学意义(P<0.05),且二者具有协同作用。见表1。
2.3对ox-LDL诱导人单核-巨噬细胞TF蛋白表达的影响 瑞舒伐他汀组或氯沙坦组与ox-LDL组比较,TF蛋白表达减少,差异具有统计学意义(P<0.05)。瑞舒伐他汀联合氯沙坦组与瑞舒伐他汀组、氯沙坦组比较,TF蛋白表达减少,差异具有统计学意义(P<0.05),且二者具有协同作用。见表1。
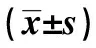
表1 各组TF mRNA、TF蛋白表达水平
3 讨 论
ox-LDL引起的内皮损伤或激活单核细胞和内皮细胞释放炎症介质参与了动脉粥样硬化(AS)形成。ox-LDL是一种强烈的细胞活化剂,可强有力的促进单核细胞的增殖,同时可刺激单核细胞表达TF和增强促凝活性。有研究报道,ox-LDL通过增加TF mRNA及蛋白表达水平,导致凝血和纤溶的动态失衡,使凝血活性增高,纤溶活性下降〔3〕。
TF是重要的凝血和纤溶调节因子,两者表达异常时,正常的凝血和(或)纤溶平衡破坏,易导致血栓形成。Taubman等〔4〕认为病变区TF和纤溶酶原激活物抑制物主要由巨噬细胞合成,随着病变的进展,TF的量逐渐增加。本研究前期试验表明,ox-LDL可诱导单核-巨噬细胞表达组织因子和增强促凝活性,而且证明这种促凝活性是由TF启动的。培养液中加入瑞舒伐他汀可抑制由ox-LDL诱导的单核-巨噬细胞TF抗原的表达和促凝活性。
研究发现,他汀类药物不仅是有效的降血脂药,同时还具有不依赖降脂作用的抗血栓和改善血管内皮功能的作用〔5〕。体内研究证实〔6,7〕,他汀类可抑制细胞内TF表达及活性,对凝血和纤溶功能紊乱具有良好的调节作用。Markle等〔8〕研究普伐他汀对人血管细胞凝血和纤溶功能的影响,发现普伐他汀明显减少ox-LDL诱导的TF表达及蛋白产生,从而调节凝血和纤溶的动态平衡,减少不稳定斑块处血栓形成。本研究前期实验表明ox-LDL可能使单核-巨噬细胞LOX-1受体蛋白、TF蛋白的表达和分泌增加。而加入瑞舒伐他汀后LOX-1 mRNA和蛋白、TF mRNA和蛋白的表达明显下降,表明瑞舒伐他汀可能通过LOX-1途径降低TF mRNA。
Nagata等〔9〕研究证明外源性AngⅡ增加体外培养的人单核细胞的TF mRNA和蛋白表达。卡托普利和坎地沙坦阻断单核细胞内源性的肾素血管紧张素系统,可减少单核胞TF mRNA和蛋白的表达,同时减少TNF-α mRNA和蛋白的表达,说明肾素血管紧张素统与TF的合成有直接联系,或者通过TNF-α来调节TF的表达〔10,11〕。Napoleona等〔12〕的研究证明卡托普利、福辛普利、伊普利和洛沙坦减少内毒素刺激的单核细胞的TF活性。他们同时对作用机制进行了探讨,证明卡托利在转录水平抑制TF的表达。本实验发现瑞舒伐他汀联合氯沙坦TF mRNA表达下调更为明显,其机制可能,瑞舒伐他汀联合氯沙坦可能分别通过阻断LOX-1表达和阻断AT1受体使TF的表达减少,两者联合加强了这一作用,ELISA的结果又从蛋白水平证实了上述关于TF表达情况的推论。
综上,ox-LDL可使人单核-巨噬细胞TF的表达增多,降低动脉粥样硬化斑块中继发性血栓形成,减少急性冠脉综合征的发生,两者联合可通过协同作用使上述效应进一步放大。
4 参考文献
1Libby P,Theroux P.Pathophysiology of coronary artery disease〔J〕.Circulation,2005;111:3487-8.
2Doshi SN,Marmur JD.Evolving role of tissue factor and its pathway inhibitor〔J〕.Crit Care Med,Med,2002;30(5 Supp l):S241-50.
3Cui MZ,Penn SM,Chisolm GM.Native and oxidized low density lipoprotein induction of tissue factor gene expression in smooth muscle cells is mediated by both Egr-1 and Spl〔J〕.J Biol Chem,1999;274:32795-802.
4Taubman MB,Fallon JT,Schecter AD,etal.Tissue factor in the pathogenesis of atherosclerosis〔J〕.Thromb Haemost,1997;78(1):200-4.
5Nissen SE.High-dose statins in acute coronary syndromes not just lipid levels〔J〕.AMA,2004;1292:1365-7.
6Bea F,Blessing E,Shelley MI,etal.Simvastatin inhibits expression of tissue factor inadvanced atherosclerotic lesions of apolipoprotein E defifient of lipid lowering:potential role of simvastatin-mediated inhibition of Egr-1 expression and activation〔J〕.Atherosclerosis,2003;167:187-94.
7Dangas G,Smith DA,Unger AH,etal.Pravastatin:an antitrombotic effect independent of the cholesterol-lowering effect〔J〕.Thromb Haemost,2000;83:688-92.
8Markle RA,Han J,Summers BD,etal.Pitavastatin alters the expression of thrombotic and fibrinolytic proteins in human vascular cells〔J〕.J Cell Biochem,2003;90:23-32.
9Nagata K,Ishibashi T,Sakamoto T,etal.Effects of blockade of the rennin-angiotensin system on tissue factor and plasminogen activator inhibitor-1 synthesis in human cultured monocytes〔J〕.J Hypertens,2001;19:775-83.
10Del Prete G,De Carli M,Lammel RM,etal.Th1 and Th2 T-helper cells exert opposite regulator effects on procoagulant activity and tissue factor production by human monocyte〔J〕.Blood,1995;86:250-7.
11Mulder AB,Hegge-Paping KS,Magielse CP,etal.Tumor necrosis factor alpha-induced endothelial tissue factor is located on the cell surface rather than in the subendothelial matrix〔J〕.Blood,1994;84:1559-66.
12Napoleona E,Di Santo A,Camera M,etal.Angiotensin-converting enzyme inhibitors down regulate tissue faetor synhesis in monocytes〔J〕. Circ Res,2000;86:139-43.
