内皮型一氧化氮合酶基因转染脂肪基质干细胞治疗蛛网膜下腔出血后脑血管痉挛大鼠的作用
2014-09-12高子云胡尚伟沈晓黎祝新根
吴 雷 郭 华 高子云 胡尚伟 沈晓黎 郭 化 祝新根
(南昌大学第二附属医院,江西 南昌 330006)
内皮型一氧化氮合成酶(eNOS)作为调整脑血管稳定的一种重要酶,其脑保护作用已引起了广泛的关注,本课题组前期的工作已经证实蛛网膜下腔出血 (SAH)后7 d时血管痉挛最为严重,eNOS的表达趋势与脑血管痉挛严重度呈负相关〔1,2〕,细胞间黏附分子-1(ICAM-1)、肌糖蛋白 C(TN-C)、前列腺素 F2α(PGF2α)等炎性因子参与了血管痉挛的发生。本实验通过复制大鼠蛛网膜下腔出血模型,再将转染eNOS的脂肪基质干细胞(ADSCs)注入大鼠脑室中,观察其对痉挛血管的作用,并探讨其机制。
1 材料与方法
1.1材料 Trizol-A(Invitrogen公司),cDNA 合成试剂盒、逆转录聚合酶链反应试剂盒、引物、DEPC (上海生工生物公司),ELISA试剂盒(大连宝生物公司),DMEM高糖培养基(Gibco公司),新生牛及胎牛血清(PAA公司,奥地利),青霉素、链霉素(山西振东泰盛制药有限公司),二氧化碳培养箱(Heraeu公司,德国),倒置显微镜(OLYMPUS,日本),电泳仪(BIO-RAD PowerPac2000)。
1.2方法
1.2.1ADSCs细胞培养 无菌条件下切取大鼠腹股沟处脂肪,剔除软组织和小血管,PBS缓冲液冲洗3 次,剪成小块,37℃下7.5 g/L Ⅰ型胶原酶消化30 min,含15 g /LFBS的DMEM等体积中和,1 000r/min离心10 min后弃去上清及脂肪组织,160 mmol/L 红细胞裂解液,裂解红细胞10 min,离心弃去上清,含15 g/L FBS的DMEM重悬细胞及沉淀的组织块,接种至含血清培养基的培养瓶,每72小时换液1次。
1.2.2eNOS基因转染ADSCs 培养2~4代ADSCs,当细胞生长至70%~80%融合时进行转染,加入含有重组载体adeno-eNOS质粒,腺病毒的量以200 pfu/细胞计算,转染方法按照脂质体2000试剂说明书进行,在37℃、5% CO2培养箱恒温孵育4 h后,去除转染混合物,换用25 ml培养瓶加入无血清培养液DMEM约7 ml,继续置5% CO 、37℃培养箱培养3 d。
1.2.3RT-PCR检测重组腺病毒转染ADSCs后eNOS mRNA的表达鉴定 取病毒转染后6 d收集转染组细胞,按Trizol法抽提总RNA,取4 μg RNA反转录cDNA,反应结束后取2 μl反应物进行PCR反应。以eNOS引物进行PCR反应,eNOS上游引物:5′-CCGGCTGCCACCTGATCCTA-3′,下游引物:5′-AACATGTGTCCTTGCTCGAGG CA-3′,片段大小是650 bp,β-actin上游引物:5′-TACAACCTCCTTGCAGCTCC-3′,下游引物:5′-GGATC TTCATGAGGTAGTCATTC-3′,片段大小是340 bp。以β-actin为体系内控制。PCR产物在1.5%琼脂糖凝胶上进行电泳鉴定,鉴定eNOS的表达。
1.3分组 雄性SD大鼠60只,体重290~350 g,由南昌大学动物实验中心提供,自由进食,昼夜节律喂养。随机分为3组,SAH组20只:造模后不予任何处理;ENOS(-)组20只:SAH造模后24 h通过立体定向仪向脑室内注入ADSCs细胞悬液10 μl,悬液密度为5×106个;AdeNOS组20只:SAH造模前通过向脑室内注入eNOS转染(+)ADSCs细胞悬液10 μl,悬液密度为5×106个。
1.4SAH模型制作 取SD大鼠麻醉后,后颈部及右侧股动脉区备皮、消毒后;大鼠仰卧位,钝性分离右侧股动脉抽取股动脉血0.3 ml留以备用,改俯卧位后钝性分离枕部肌肉暴露枕骨,用1 ml针管穿刺入枕大池,在2 min内将0.3 ml动脉血注入枕大池,缝合伤口。48 h后同法取左侧股动脉血0.3 ml注入枕大池,制成大鼠SAH动物模型。
1.5标本采集及测定 首先取血液标本放入含100 g/L依地酸二钠60 μl试管中混匀,采用ELISA测定血清eNOS、ICAM-1、TN-C和PGF2α,严格按试剂盒说明书操作。分别于建模后第7天处死大鼠,剥离其脑组织对颞叶皮质切片进行染色,按试剂盒操作,观察颞叶皮质切片中神经元染色阳性细胞。剥离其基底动脉组织部分行石蜡包埋后行HE染色检查,光镜下观察并测量基底动脉血管内径,横截面积,血管舒张度(D/T值:动脉血管内径与管壁厚度比值)。另一部分冻存于-80℃冰箱中,统一行eNOS、ICAM-1、TN-C和PGF2α检测,将eNOS、ICAM-1、TN-C、PGF2α和β-actin进行实时荧光定量 PCR。反应条件:95℃变性2 min,40个循环94℃变性20 s,58℃(eNOS)、61℃(ICAM-1)、56℃(TN-C)、55℃(PGF2α)退火20 s,72℃延伸30 s,74℃读板。扩增产物经脂糖凝胶电泳后,用内参照β-actin光密度值标化eNOS、ICAM-1、TN-C和PGF2α mRNA的吸光度值,得到eNOS、ICAM-1、TN-C和PGF2αmRNA表达的相对含量。
1.6神经元凋亡指数 所有受试动物进行神经元凋亡指数评分,颞叶皮质神经元凋亡指数为颞叶皮质切片1 000个神经元中的TUNEL染色阳性细胞。
1.7统计学方法 采用SPSS13.0统计软件包进行统计学分析,采用t检验、χ2检验。
2 结 果
2.1重组腺病毒Ade-NOS鉴定结果 对重组腺病毒Ade-NOS进行PCR鉴定,经酶切鉴定、电泳证明,构建出的载体完全正确,认为已将eNOS基因成功克隆到ADSCs细胞内。见图1。
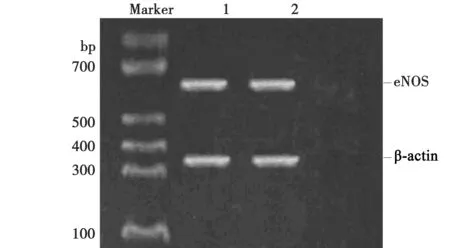
图1 ADSCs细胞eNOS表达鉴定
2.2基底动脉标本观察 SAH组、ENOS(-)组可见血液主要聚积于蛛网膜下腔,可见明显的凝血块,基底动脉管壁增厚,各组均可见内膜出现皱褶,结构排列紊乱,向血管内腔突起,平滑肌细胞排列紊乱,厚薄不均,炎性细胞浸润。ENOS(+)组与SAH 、ENOS(-)组相比可见内膜结构稍完整,坏死、脱落细胞少,无皱褶,平滑肌细胞排列尚整齐,仍呈扁平状。
2.3各组基底动脉横截面积及管壁比较 基底动脉行 HE 染色后,SAH组基底动脉横截面积为(59 862±2 432) μm2,血管内径(118.8±7.4) μ,D/T值(8.0±2.6),ENOS(-)组基底动脉横截面积为(59 674±2 389) μm2,血管内径(117.9±7.1) μ,D/T值(7.8±2.5),ENOS(+)组基底动脉横截面积为(78 792±2 768) μm2,血管内径(169.4±9.0) μ,D/T值(14.5±2.6),SAH组、ENOS(-)组基底动脉横截面积、血管内径和D/T值均明显低于正常组和ENOS(+)组(P<0.05)。SAH组和ENOS(-)组基底动脉横截面积、血管内径和D/T值差异不明显(P>0.05)。
2.4各组大鼠神颞叶皮质神经元凋亡指数比较 SAH组、ENOS(-)较ENOS(+)组颞叶皮质神经元结构松散,数目减少,排列紊乱; SAH组、ENOS(-)组颞叶神经元凋亡指数(32.0%±4.4%、32.7%±4.0%)明显高于ENOS(+)组(22.6%±3.1%,P<0.05)。见表1。
2.5血清eNOS、ICAM-1、TN-C和PGF2α浓度 SAH组、ENOS(-)组eNOS表达水平明显低于ENOS(+)组,差异有显著性(P<0.05)。SAH组、ENOS(-)组PGF2α、TN-C表达水平明显高于AdeNOS组,差异有显著性(P<0.05)。见表1。

表1 各组大鼠血清eNOS、ICAM-1、TN-C和PGF2α表达水平
2.6各组大鼠基底动脉eNOS、ICAM-1、TN-C和PGF2α mRNA表达情况 SAH组、ENOS(-)组大鼠基底动脉eNOS表达明显低于ENOS(+)组,ENOS(+)组TN-C、PGF2α表达明显低于SAH组、ENOS(-)组(P<0.05)。见表2、图2。

M:Marker,1~3;SAH组、eNOS-C组、eNOS(+)组
表2 各组大鼠基底动脉eNOS、ICAM-1、TN-C和PGF2α表达水平
3 讨 论
脑血管痉挛是SAH后最为常见的并发症,所导致的脑组织缺血缺氧可造成可逆性或永久性神经元损伤。SAH 后立即发生,持续数分钟或小时,为急性脑血管痉挛,发病短暂;而迟发性脑血管痉挛一般可在SAH后3 d以后出现,7~8 d达到高峰,持续2~3 w后开始逐渐缓解,是SAH后致残和死亡的主要原因〔1,2〕。NO是一种具有生物活性作用的小分子,是维持脑血管张力的重要因子之一,在调节心血管系统、神经系统和免疫功能方面发挥重要作用,能快速弥散进入平滑肌细胞,引起血管松弛。eNOS作为NOS的异构体,存在于内皮细胞和神经细胞,可持续低量地合成、释放NO,使血管处于舒张状态〔3,4〕,是预测SAH后脑血管痉挛的重要指标之一〔5〕。Anantha等〔6〕证实促红细胞生成素可通过增加磷酸化eNOS水平改善SAH后脑血管痉挛。可见,eNOS是治疗脑血管痉挛最有前景的靶点之一。胡萍等〔7〕实验结果显示,eNOS 基因体内转染损伤后血管可以抑制血管新生内膜增生,减少血管再狭窄的发生率。
本文结果表明eNOS不仅可缓解SAH后脑血管痉挛,抑制基底动脉管壁的增厚,保持内膜结构完整,还具有一定的神经元保护作用。
本文结果证明,本实验方法可以实现eNOS在SAH后脑血管及血表达上升,并引发TN-C和PGF2α的下调。TN-C是一种大分子量的细胞外基质的糖蛋白,在胚胎发育、炎性反应以及伤口愈合的过程中可一过性的表达,其特征与纤维连接蛋白和层黏连蛋白有许多相似之处〔8〕。PGF2α〔9,10〕是通过参与其他自体活性物质、神经递质和激素的调解而发挥作用的,在生理状态下,主要作用于血管和平滑肌,参与血小板凝集、炎症反应、神经冲动传导和细胞生长等。
综上所述,脑室内注释携带外源性eNOS基因的ADSCs,可对SAH后脑血管痉挛起到一定缓解作用,为SAH后脑血管痉挛的治疗提供了一种新的思路。
4 参考文献
1Pyne-Geithman GJ,Caudell DN,Cooper M,etal.Dopamine D2-receptor-mediated increase in vascular and endothelial NOS activity ameliorates cerebral vasospasm after subarachnoid hemorrhage in vitro〔J〕.Neurocrit Care,2009;10(2):225-31.
2Guresir E,Raabe A,Jaiimsin A,etal.Histological evidence of delayed ischemic brain tissue damage in the rat double-hemorrhage model〔J〕.J Neurol Sci,2010;293(1~2):18-22.
3Sabri M,Ai J,Knight B,etal.Uncoupling of endothelial nitric oxide synthase after experimental subarachnoid hemorrhage〔J〕.J Cereb Blood Flow Metab,2011;31(1):190-9.
4Osuka K,Watanabe Y,Usuda N,etal.Modification of endothelial nitric oxide synthase through AMPK after experimental subarachnoid hemorrhage〔J〕.J Neurotrauma,2009;26(7):1157-65.
5Pyne-Geithman GJ,Caudell DN,Prakash P,etal.Glutathione peroxidase and subarachnoid hemorrhage:implications for the role of oxidative stress in cerebral vasospasm〔J〕.Neurol Res,2009;31:195-9.
6Vijay A,Santhanam R,Leslie A,etal.Role of endothelial NO synthase phosphorylation in cerebrovascular protective effect of recombinant erythropoietin during subarachnoid hemorrhage-induced cerebral vasospasm〔J〕.Stroke,2005;36:2731-7.
7胡 萍,盛 净,蔡文玮,等.内皮型一氧化氮合酶基因转染对血管损伤后新生内膜增生的影响〔J〕.中国组织工程研究与临床康复,2011;15(2):298-301.
8张占虎,王勇军,于 彬,等.大鼠坐骨神经缺损后损伤近端神经TNC表达变化及功能分析〔J〕.交通医学,2012;26(5):401-3,406.
9张建斌,刘文超,何正瑞,等.蛛网膜下腔出血后脑血管痉挛平滑肌超微结构研究〔J〕.解剖学杂志,2000;33(3):263-4.
10孙 博,申爱荣.子宫内膜异位症并不孕患者血清、腹腔液中8-iso-PGF2A、 GSH-PX的表达〔J〕.中国妇幼保健,2010;25(27):3936-8.
