复方地黄方对帕金森病左旋多巴毒副反应大鼠淋巴细胞表面多巴胺转运体 mRNA表达的影响
2014-09-12罗瑞静何建成
罗瑞静 何建成
(上海中医药大学,上海 201203)
帕金森病(PD)是一种由内、外因素综合作用导致的神经系统变性疾病,迄今其发病机制尚未完全阐明〔1〕。已有研究认为其发生与免疫功能失调有关〔2〕,并证实PD患者淋巴细胞(PBL)表面多巴胺转运体(DAT) mRNA表达较正常人明显减少〔3〕,而其经典治疗药物左旋多巴长期应用亦可使DAT mRNA表达减少〔4〕。中药复方地黄方对LD治疗PD过程中的毒副反应有明显干预效果〔5,6〕,且可以通过增加中枢纹状体内DAT的数量来发挥干预作用〔7〕。本实验研究LD大鼠PBL表面DAT表达的动态变化情况。
1 材料与方法
1.1动物及实验条件 SD大鼠,雄性,6~8周龄,体重180~200 g,SPF级,110只,由上海中医药大学实验动物中心提供。许可证号:SYXK(沪)2004-2005。实验条件:动物饲养在上海中医药大学实验动物中心,恒温(23±2)℃,相对湿度60%~65%,自动光-暗控制(LD12:12,即07:00-19:00光照,19:00~07:00暗置),动物摄食饮水及活动自由。
1.2药物 戊巴比妥钠:上海中西药业股份有限公司产品(批号:WS20090920);左旋多巴干粉:美国Sigma公司产品(批号:192K1885);苄丝肼:美国Sigma公司产品(批号:BCBB8323);庆大霉素:上海第一制药厂产品,0.3 g/支(批号:H31021994);复方地黄方:熟地黄15 g,白芍30 g,珍珠母15 g,丹参20 g,全蝎2 g等(浓度为5.18 g/ml)。由上海雷允上药材有限公司代加工。
1.3主要试剂 6-羟基多巴胺(6-OHDA,批号:048K3728),美国Sigma公司,阿扑吗啡(APO,批号:057K1462),美国Sigma公司,抗坏血酸(批号:063K1082),美国Sigma公司,大鼠淋巴细胞分离液(批号:20100101);上海微科生化试剂有限公司,PCR引物,上海生物工程有限公司,Trizol Reagent,美国Invitrogen公司,Oligo(dT)15,美国Promega公司,M-MuLV Reverse Transcriptase,美国Promega公司,2×Taq PCR Master Mix,上海莱枫生物科技有限公司,dNTPs mix,上海生物工程有限公司,核糖核酸酶抑制剂(RNAsin),美国Promega公司,Spanish Agrose,上海华蓝化学科技有限公司,100 bp DNA ladder,美国Amresco公司,焦碳酸二乙酯(DEPC),美国Amresco公司。
1.4主要仪器 大鼠脑立体定位仪(TOW-3A型),广东汕头市教育医学仪器厂,微量进样器(5 μl),上海第三分析仪器厂,分析天平(910324),德国Sartorius公司,秒表(926266),上海秒表厂,电动高速匀浆机,美国IKA Works公司,Du7500紫外分光光度计,德国Beckman公司,Heraeus低温高速离心机,德国Heraeus公司,PCR仪(GeneAmp PCR System 9600),美国Perkinelmer公司,Syngene生物图像系统,美国Bio-Rad公司,核酸电泳槽,美国Bio-Rad公司。
1.5模型制备方法 在经典PD模型基础上,进一步腹腔注射LD,制备PD左旋多巴毒副反应大鼠(LD大鼠)模型〔8~11〕。术前确认无异常旋转行为后,用3%的戊巴比妥钠(50 mg/kg)腹腔注射麻醉。然后将大鼠固定于脑立体定位仪上,头部去毛,苯扎溴铵(商品名:新洁尔灭)常规消毒。无菌条件下,沿正中线切开大鼠颅顶皮肤,剥离骨膜,暴露前囟。以前囟为准,确定左侧黑质二坐标:①前囟后5.2 mm,正中线右侧1.0 mm,硬膜下9.0 mm。②前囟后5.2 mm,正中线右侧2.5 mm,硬膜下8.5 mm。用颅骨钻于手术要求部位小心钻开颅骨,用5 μl微量进样器将6-OHDA(即将6-OHDA溶于含0.02%抗坏血栓的生理盐水中,浓度为2 μg/μl)注入右侧黑质部(以1.0 mm/min速度缓慢进针),每孔3μL,注射速度为1 μl/min,注射完毕后留针5 min,然后以1.0 mm/min速度缓慢退针。手术完成后,用医用明胶海绵填塞颅骨孔,缝合切口皮肤,肌肉注射庆大霉素7 d,待动物清醒后放回饲养笼中饲养。正常对照组只固定大鼠,不进行任何处理,亦均为10 d。假手术组开颅后只注射含0.02%抗坏血栓的生理盐水(浓度为2 μg/μl)。10 d后,以腹腔注射APO 0.5 mg/kg诱发大鼠向一侧旋转,记录开始旋转至30 min内的旋转圈数,以旋转圈数平均>7次/min者为合格的PD模型。将成功的PD模型大鼠给予腹腔注射左旋多巴/苄丝肼(50 mg/kg LD和12.5 mg/kg苄丝肼即LD和苄丝肼溶于含0.05%的乙醇和0.1%的抗坏血酸的注射用水中,配成10 mg/ml),2次/d,连续2 w。正常对照组及假手术组给予腹腔注射等量的含0.05%的乙醇和0.1%的抗坏血酸的注射用水,2次/d。2 w后,再次以腹腔注射APO 0.5 mg/kg诱发大鼠向一侧旋转,记录开始旋转至30 min内的旋转圈数,旋转圈数较2 w前增加的为合格的LD模型大鼠〔11〕。
1.6分组及给药
1.6.1分组方法 采用区层随机法,将成功LD模型大鼠随机分为两组:LD模型组(左旋多巴)、复方地黄汤组(复方地黄汤+左旋多巴),每组12只。另取正常对照组和假手术组,每组12只。然后再将各组分为4、6 w两组,每组6只。
1.6.2给药 LD模型组大鼠在腹腔注射左旋多巴/苄丝肼(50 mg/kg左旋多巴和12.5 mg/ml苄丝肼)的基础上给予生理盐水灌胃;复方地黄汤组大鼠在腹腔注射左旋多巴/苄丝肼的基础上给予中药灌胃;正常对照组及假手术组给予腹腔注射等量的含0.05%的乙醇和0.1%的抗坏血酸的注射用水的基础上给予生理盐水灌胃。每次灌胃量为2 ml,1次/d。
1.7大鼠血PBL分离 所有动物在处死前均从腹腔注射麻醉剂(水合氯醛10%,0.4 ml/100 g),待动物麻醉后,腹主动脉取血5 ml,置于肝素抗凝管中,用密度梯度离心法分离淋巴细胞。取新鲜抗凝血5 ml,与生理盐水1∶1 混匀后,将其小心加于5 ml淋巴细胞分离液的液面上,以5 000 r/min离心(半径15 cm水平转子)15 min,此时离心管中由上至下细胞分四层:第一层为血浆或组织匀浆液层;第二层为环状乳白色淋巴细胞或单核细胞层;第三层为透明分离液层;第四层为红细胞层。用吸管收集第二层于另一试管中,加入0.01 mol/L PBS10 ml(pH7.4),3 000 r/min离心洗涤5 min×3次,弃去上清液,随后放入-80℃冰箱中保存备用。
1.8RNA的抽提及RT-PCR
1.8.1RNA的提取 实验所需物品的处理:所用玻璃器皿均经160~180℃高温干燥6 h以上,非耐高温器皿经0.1%DEPC浸泡后,经高压(20磅,15 min)处理灭活RNA,所用试剂均用DEPC水配制后高压处理。①细胞解冻后,加入PBS 5 ml离心,3 000 r/min,5 min,弃上清,②加Trizol 1 ml,上下颠倒数次,室温5 min,③加氯仿250 μl,用力振荡约30 s,室温静置10 min,④2 000 r/min×15 min,4℃,上清液移入新管(含RNA),⑤加500 μl异丙醇,上下颠倒数次,室温静置10 min,⑥12 000 r/min×10 min,4℃,弃上清,⑦加75%乙醇1 ml,振摇后离心,7 500 r/min×5 min,4℃,⑧加30 L DEPC水溶解,然后紫外分光光度计测定OD值,-70℃保存。
1.8.2反转录反应 DAT引物序列为:基因库查找号:S76145,上游: 5′- GCT CTA CTT CAG CCT ATG GA-3′,下游: 5′- GTG GTG ATG ATT GCG TCT-3′,产物为: 300 bp;β-actin引物序列为:上游:5′- AAG CAG GAG TAT GAC GAG TCC G -3′,下游:5′- GCC TTC ATA CAT CTC AAG TTG G -3′ 产物为:550 bp,在0.2 ml无RNA的PCR管中依次加入以下试剂:Total RNA(1 g/μl) 3 μl;Oligo dT(15) (0.5 g/μl) 1 μl;DEPC (RNase-free)调体积至12.5 μl;70℃变性5 min,冰浴5 min;5×RT buffer 4 μl;10 mmol/L 4dNTP mix 2 μl;RNA sin(40 U/μl)0.5 μl;M-MuLV反转录酶(200 U/μl)1 μl;42℃,60 min;72℃,10 min;之后迅速在冰上冷却5 min。
1.8.3PCR扩增反应 在0.2 ml PCR管中依次加入以下试剂:反转录产物2 μl;2×Taq PCR Master Mix 25 μl;Sense/antisense primer 1 μl(each);DEPC 21 μl;94℃ 1 min;30个循环,58℃ 1 min;72℃ 1 min;72℃ 10 min。
1.8.4DNA电泳鉴定及图像分析 PCR产物5 μl上样于2%琼脂糖凝胶,电压为100 V,进行电泳。应用凝胶图像分析系统(Image Master Software)进行条带光密度分析,经β-actin校正得到相对光密度值。
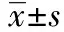
2 结 果
LD模型组、复方地黄方组在4、6 w时均明显低于正常对照组及假手术组(P<0.001);复方地黄方组分别在4、6 w时明显高于LD模型组(P<0.001)。复方地黄方组DAT mRNA表达较LD模型组明显增强,伴随给药时间延长,LD模型组表达有减少趋势,而复方地黄方组有增加趋势。正常对照组、假手术组及复方地黄方组不同时间点比较差异无统计学意义(P>0.05);LD模型组在6 w时明显低于4 w时(P<0.01)。见表1,图1。
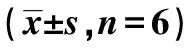
表1 各组大鼠PBL中 DAT mRNA表达的比较
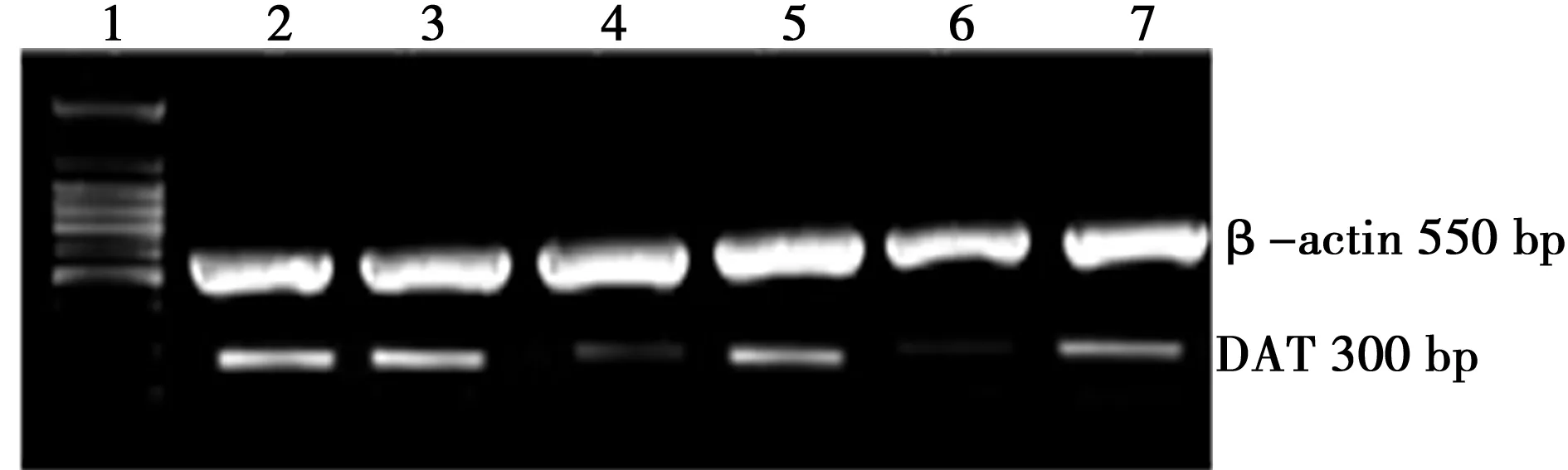
1.Marker;2.正常对照组;3.假手术组;4.LD模型组(4 w);5.复方地黄方组(4 w);6.LD模型组(6 w);7.复方地黄方组(6 w)
3 讨 论
已有研究表明,PD的发生是多因素综合作用结果〔1〕,其中与机体免疫功能异常有密切关系〔2〕。PD患者PBL表面DAT表达异常已为大量实验证实〔3,4,12,13〕,但其具体机制尚未阐明。而LD对PD外周血淋巴细胞膜表面DAT表达的影响尚无统一认识,基于复方地黄方良好的干预效果,本次实验以PBL表面DAT为观察对象来探讨其干预机制。
有研究表明〔3〕,PD患者外周血淋巴细胞DAT数量明显低于正常人,但LD对其影响情况,已有研究结果并不一致,张璟等〔12〕研究显示,LD治疗对PD患者外周血淋巴细胞DAT数量没有影响,而陈嬿等〔4〕研究显示LD治疗组较非LD治疗组低。本次实验研究结果与课题组前期对中枢纹状体内DAT研究结果基本一致〔7〕,提示DAT基因表达及数量异常与LD治疗PD时毒副反应发生存在一定关系,而复方地黄方则可以通过提高DAT表达增加其数量来发挥“减毒增效”作用。
复方地黄方中熟地黄补肾益精、固本培元,为君药;珍珠母平肝潜阳,白芍养血濡筋、缓急止颤,共为臣药;丹参养血活血化瘀,全蝎祛风通络、活血化痰,共为佐药。诸药合用,共奏滋肾补肝、平肝熄风、化痰祛瘀之功。前期研究〔7〕证实该方可以增加DA含量,DAT表达及数量上调是否与DA含量增加有关,还是复方地黄方直接促进了DAT表达及数量上调等具体作用机制尚需进一步研究。
4 参考文献
1关 婷,鲍远程,余元勋,等.帕金森病发病机制的研究〔J〕.现代中西医结合杂志,2009;18(34):4300-2.
2张艳玲,苏炳银.帕金森病发病免疫机制的研究进展〔J〕.实用老年医学,2009;23(2):150-2.
3潘天虹,刘昭平,张 珏,等.帕金森病患者的外周血淋巴细胞DAT功能检测〔J〕.中国神经免疫学和神经病学杂志,2002;9(4):214-6.
4陈 嬿,蒋雨平,杨莉芹.帕金森病外周血淋巴细胞多巴胺转运体表达的研究〔J〕.中国临床神经科学,2007;15(4):392-6.
5何建成,王振华,袁灿兴,等.复方地黄方对帕金森病大鼠神经行为学及氧化应激的影响〔J〕.中国康复医学杂志,2009;24(7):590-2.
6王振华,何建成,张春燕.复方地黄方对帕金森病大鼠细胞凋亡的影响〔J〕.新中医,2010;42(4):86-8.
7Luo RJ,He JC.Effects of compound rehmannia formula on dopamine transporter content in the corpus striatum of parkinson′s disease rats treated with levodopa〔J〕.Neural Regeneration Res,2011;6(12):898-902.
8Ungerstedt U.6-Hydroxy-dopamine induced degeneration of Central Monoamine neurons〔J〕.Eur J Pharmacol,1968;5(1):107-10.
9包新民,舒思云.大鼠脑立体定位图谱〔M〕.北京:人民卫生出版社,1991:53.
10Carman LS, Gage FH, Shults CW.Partial lesion of the substantianigra: relation between extent of lesion and rotational behavior〔J〕.Brain Res,1991;553(2):275-83.
11何建成,王文武,丁宏娟.50mg/ kg剂量左旋多巴对帕金森病大鼠神经行为学和超微结构的影响〔J〕.中国老年学杂志,2010;30(9):1209-12.
12张 璟,肖 勒,陈生弟,等.帕金森病患者血淋巴细胞多巴胺转运蛋白功能与密度的研究〔J〕.诊断学理论与实践,2004;3(2):79-82.
13Pellicanol C,Buttarelli FR,Circella A,etal.Dopamine transporter immunoreactivity in peripheral blood lymphocytes discriminates Parkinson’s disease from essential tremor〔J〕.J Neural Transm,2007;114(7): 935-8.
