化疗对老年胃癌患者免疫相关功能的影响
2014-09-12薛永飞任中海沈艳丽
薛永飞 任中海 沈艳丽
(南阳市中心医院肿瘤内科,河南 南阳 473000)
胃癌的发病机制目前尚不清楚,但认为与环境、遗传、环境污染以及饮食习惯等因素相关〔1,2〕。由于胃的血供较为丰富,可以在病程早期即发生血道转移,预后往往不佳〔3〕。如果能够在早期胃癌阶段获得诊断,通过以手术为主的综合治疗,尤其是术后的化疗可显著改善患者的预后〔4〕。但化疗在清除残余肿瘤细胞同时,还可影响患者自身的免疫功能〔5,6〕。本文探讨化疗对老年胃癌患者免疫功能的影响。
1 资料与方法
1.1研究对象 2010年1月至2012年1月我院术后化疗的老年胃癌患者30例为观察组;均经临床、病史及手术病理明确诊断为胃癌;均接受了手术治疗(胃癌根治术);无合并胃癌以外的其他恶性肿瘤;无严重肝肾功能障碍、自身免疫性疾病;术前未接受过化疗。另纳入30例老年健康体检者为对照组。两组性别、年龄差异无统计学意义(P>0.05)。
1.2治疗方法及标准 化疗方案:观察组均在胃癌根治术后1个月内开始接受化疗。化疗采用“奥沙利铂+卡培他滨”方案,第一日采用奥沙利铂130 mg/m2静脉注射,第1~2周口服卡培他滨1 000 mg·m-2·d-1,3 w一个疗程。
1.3观察指标 观察白细胞计数、自然杀伤细胞(NK)计数以及T淋巴细胞亚群变化。
1.4统计学方法 采用SPSS17.0统计软件进行t检验和χ2检验。
2 结 果
2.1两组免疫学指标的比较 两组化疗前白细胞计数差异无统计学意义(P=0.937);化疗后1 w,胃癌组白细胞显著下降,与对照组差异显著(P<0.001);化疗后2 w胃癌组白细胞计数较前1 w上升,与对照组相比差异无统计学意义(P=0.296)。见表1。

表1 两组血白细胞计数比较
2.2两组NK细胞比较 两组化疗前1 d NK细胞计数差异具有统计学意义(P<0.001);在化疗后1 w及2 w,胃癌组NK细胞均低于对照组(P<0.001);胃癌组化疗后1 w NK细胞较化疗前1 d显著下降(t=2.695,P=0.009);胃癌组化疗后2 w NK细胞计数上升,与化疗前1 d相比差异无统计学意义(t=0.925,P= 0.358)。见表2。
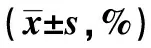
表2 两组NK细胞比较
2.3胃癌组患者T细胞亚群变化 胃癌组化疗后1 w CD3细胞较化疗前显著降低(t=4.356,P<0.001),而化疗后2 w CD3细胞上升,与化疗前差异无统计学意义(t=1.117,P=0.268);化疗后1 w CD4细胞降低,与化疗前差异具有统计学意义(t=2.548,P=0.013),而化疗后2 w CD4细胞上升,与化疗前相比较差异无统计学意义(t=0.175,P=0.862);CD8细胞在化疗后1 w,与化疗前1 d差异具有统计学意义(t=2.107,P=0.039),而化疗后2 w CD8细胞显著下降,与化疗前比较差异无统计学意义(t=1.574,P=0.121);CD4/CD8在化疗后1 w显著下降(t=2.150,P=0.036),而化疗后2 w上升,与化疗前相比较差异无统计学意义(t=0.604,P= 0.548)。见表3。
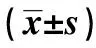
表3 胃癌组T细胞亚群变化
3 讨 论
化疗是肿瘤综合治疗中的一项重要治疗方法。但化疗多具有一定的毒副作用,化疗对患者免疫系统功能的影响就是其中一项。细胞免疫在机体抗肿瘤免疫体系中扮演着重要角色〔7〕。目前所认识到的NK细胞以及由T淋巴细胞所介导的细胞免疫均属于该范畴。而NK细胞则是一种不需要抗原激活即能发挥抗肿瘤作用的非特异性细胞免疫。可见机体抗肿瘤机制复杂而重要〔8,9〕。
白细胞是反映机体免疫平衡状况的基本指标,其数目上升提示机体免疫状况处于激活状态,而数目下降则提示免疫抑制。NK细胞是一种多功能的免疫细胞,具有广谱抗肿瘤的生物活性,被认为是人体抗肿瘤的第一道防线,除此之外,其还具有免疫调剂的作用〔10〕。本研究提示初接受化疗后患者具有一个免疫抑制和适应时期,而这种免疫抑制是可逆的。T淋巴细胞在抗肿瘤中承担着重要任务,其发挥抗肿瘤作用需要相应的肿瘤抗原刺激以及共刺激信号的协同作用。CD4/CD8是判断机体免疫状况的指标,其上升表示正向免疫调节占优势,而下降则意味着负向免疫调节占优势。同样反映了在化疗初期患者出现短暂的免疫抑制,随后则恢复正常。肿瘤科医生应当认识到化疗有可能带来的免疫抑制,并予以相应的处理。对于化疗期间出现的免疫抑制可以予以免疫调节剂预防。综上,老年胃癌术后化疗的患者,在接受化疗后1 w内出现一定程度的免疫抑制,而这种以NK细胞、白细胞及CD4/CD8降低为特点的免疫抑制在化疗后2 w逐渐恢复正常。
4 参考文献
1Mittal A,Gupta SP,Jha DK,etal.Impact of various tumor markers in prognosis of gastric cancer.A hospital based study from tertiary care hospital of kathmandu valley〔J〕. Asian Pac J Cancer Prev,2013;14(3):1965-7.
2颜 伟.胃癌组织PTEN和LC3B的表达及意义〔J〕.中国老年学杂志,2012;32(19):4145-7.
3蒋浩海,徐立群,黄志军.119例胃癌术后预后的多因素分析〔J〕.实用临床医药杂志,2011;15(24):140-2.
4Tan VP,Wong BC.Gastric cancer chemoprevention:the current evidence〔J〕.Gastroenterol Clin North Am,2013;42(2):299-316.
5Ito S,Nakamura Y,Noumi T,etal.Acute aortic thrombosis during cisplatin based chemotherapy for gastric cancer〔J〕.Intern Med,2013;52(9):973-5.
6邱小文,刘 慧.高效免疫蛋粉i26对胃癌患者术后化疗免疫及营养支持效果的护理观察〔J〕.实用医学杂志,2012;28(11):1911-3.
7Kurt E,Cubukcu E,Karabulut B,etal.A multi-institutional evaluation of carboplatin plus docetaxel regimen in elderly patients with advanced gastric cancer〔J〕.J BUON,2013;18(1):147-53.
8Yang CA,Scheibenbogen C,Bauer S,etal.A frequent Toll-like receptor 1 gene polymorphism affects NK-and T-cell IFN-gamma production and is associated with Helicobacter pylori-induced gastric disease〔J〕. Helicobacter,2013;18(1):13-21.
9朱芳来,凌安生.Ⅳ期胃癌腹腔内化疗联合胃镜下局部治疗疗效观察〔J〕.实用临床医药杂志,2011;15(3):96-8.
10Liu H,Ling W,Shen ZY,etal.Clinical application of immune-enhanced enteral nutrition in patients with advanced gastric cancer after total gastrectomy〔J〕.J Dig Dis,2012;13(8):401-6.
