高尔基体应激与抗氧化系统在缺血脑损伤中的作用
2014-09-12周文胜洪秀琴
王 佳 周文胜 洪秀琴
(湖南省老年医院 湖南省老年医学研究所神经疾病研究室,湖南 长沙 410016)
高尔基体(GA)应激是GA对氧化应激所做出的应答,而氧化应激是导致缺血性脑损伤的主要机制之一,GA常常涉及到氧化应激所介导的神经疾病的发病机制之中,抗氧化系统对缺血性脑损伤具有神经保护作用。本文就GA应激与过氧化物歧化酶、谷氧还蛋白系统和硫氧还蛋白系统等主要抗氧化系统在缺血性脑损伤的作用作一综述。
1 GA在细胞活动中起重要作用
GA作为一个细胞器,因其在生物合成、脂类及蛋白质的分类和转运上起了十分重要的作用,引起了许多科学家的关注。值得关注的是,GA是神经鞘脂类生物合成的主要场所〔1〕,也作为蛋白和脂类翻译后修饰的“工厂”(多数情况是经过糖基化修饰)。许多因素包括在病理条件下,在药物制剂的影响下,以及一些高尔基相关蛋白的过表达,都可以导致GA的形态发生改变,从而影响GA的功能。因此,一旦神经元的GA功能受损,会导致蛋白结构异常,蛋白及脂质转运异常,神经元生理功能紊乱而引起疾病的发生。
2 氧化应激是导致缺血性脑损伤的主要机制之一
研究发现脑缺血再灌注后,各种损伤机制可引起包括线粒体和GA等多个亚细胞器超微结构的形态及功能发生变化,并且出现一系列的亚细胞应激反应〔2〕,这可作为判断神经细胞受损与否以及损伤程度的重要标志。许多研究表明,氧化应激是导致缺血性脑损伤的主要机制之一。活性氧(ROS)在一些神经系统疾病〔如脑缺血、脑卒中和阿尔茨海默病(AD)〕的病理生理过程中起了十分重要的作用〔3~5〕。由缺血导致神经元损伤的一个主要机制是细胞内不断增加的ROS介导DNA、蛋白质和其他大分子的氧化损伤,从而导致神经元的凋亡,最终诱发神经退行性疾病〔6〕。就组织病理变化而言,可表现为 DNA 分子中单股或双股的核苷酸链断裂、DNA蛋白质交联、碱基结构改变等,从而导致基因变异或突变;对脂质中主要分布于细胞膜结构的多不饱和脂肪酸的损伤则可生成过多的过氧化脂质及降解产物,从而导致动脉粥样硬化的逐步形成和心脑血管疾病的发生;对蛋白质中的一些重要氨基酸中的肽键和二硫键的损伤则为肽键的断裂或二硫键结构改变而致蛋白酶及抗氧化物酶活力减弱甚至丧失其功能等。
3 缺血性脑损伤与GA应激
当氧化应激发生时,细胞积极抵抗氧化损伤和恢复氧化还原平衡。所有的器官都在对氧化应激做出适应性的应答,例如激活核内编码防御酶、转录因子以及结构蛋白相关的基因〔7〕。可想而知,在氧化应激的情况下,本来结构稳定且有着正常生理功能的GA也会由此受到影响〔8〕。GA的这些改变可能触发和传递下游应激信号导致细胞的适应,或者,如果氧化应激太严重,GA碎裂甚至出现细胞凋亡。越来越多的证据也表明,GA涉及氧化应激所介导的神经疾病的发病机理之中,如在肌萎缩侧索硬化(ALS)、帕金森病(PD)、脑缺血和AD等疾病中就发现了GA碎裂的现象,并且可随时间延长而加重〔9~12〕。在新生的缺血再灌注动物模型中〔13〕,GA在缺血再灌注的早期就发现在纹状体神经元发生碎裂的现象。在全脑缺血再灌注大鼠中〔14〕,GA碎裂成池状小泡和不规则的膜螺纹。GA的碎裂可能对其分泌活性产生不利影响,并且由此改变神经元的活性。GA碎裂其中的一个关键机制是与氧化应激密切相关。氧化应激主要是通过以下三个途径介导GA的碎裂〔15〕:①氧化应激导致GA微管蛋白的损伤;②氧化应激激活清除GA结构蛋白的凋亡蛋白酶;③氧化应激诱导Ca2+的异常从而导致内质网的应激,内质网应激导致GA的碎裂。
Jiang等〔15〕把GA对氧化应激所做出的应答称之为GA应激。GA应激代表了GA容易对细胞内的生理失衡产生相应应答的能力,如GA出现形态的改变或最终的碎裂。高尔基的Ca2+/Mn2+ATP酶和其他定位在高尔基中的活性蛋白可能积极参与GA应激过程,最终出现GA的碎裂与神经细胞的凋亡。
4 GA应激与抗氧化系统在缺血性脑损伤中的研究进展
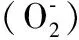
4.1GA与线粒体 即往研究发现,线粒体的功能紊乱在一些神经系统疾病的发病机理中起了十分关键作用。事实上,在一些凋亡过程中,研究人员发现线粒体也承受着碎裂的情况〔20〕。线粒体蛋白Mfn1是维护线粒体融合所必需的蛋白,在氧化应激下过表达Mfn1能有效地阻止线粒体的碎裂和神经细胞的死亡〔21〕。Nakagomi等〔22〕在经氧化应激处理的皮质神经元中过表达Mfn1,发现不仅能明显抑制线粒的碎裂,而且能一定程度减少GA碎裂的情况。说明线粒体处于GA碎裂信号通路的上游,也对GA的碎裂起到了重要的作用。
4.2GA与SODs SODs是细胞内抗氧化所必需的一种酶,许多研究表明SODs在脑缺血后有明显的神经保护作用〔23,24〕。Fujimura等〔23〕报道称,小鼠在脑缺血后,SOD1可以避免DNA损伤修复酶过早的减少。另外,Kim等〔24〕也称在由血栓造成的SOD1转基因小鼠缺血后,表达增加的SOD1能减少DNA的氧化损伤和细胞死亡中DNA的碎裂。同样,在正常的生理情况下,SOD2缺陷型的突变小鼠会出现过氧化物离子显著的增加,而这种情况一般只在野生型小鼠脑缺血时才会发生〔25〕。进一步研究发现,机体通过对SOD2活性的调节产生神经保护作用,以减少脑缺血所带来的损伤〔26~28〕。
另有研究表明,SOD1的突变形式在神经系统疾病如肌萎缩侧索硬化症(fALS)和类似fALS的运动神经元病的发病机制中起了重要的作用〔29,30〕。在fALS中,氧化应激在突变的SOD1的毒性方面起了十分重要的作用。fALS的一个主要是特征是在其早期会出现GA碎裂的现象〔31,32〕。除了其超氧化物歧化活性,SOD1也有自由基生成活性,产生的自由基主要是通过利用H2O2和其他小分子阴离子作为底物。研究表明〔33,34〕,在SOD1G93A 突变的fALS转基因小鼠中自由基生成活性相比野生型的要高出许多。因此,在fALS中,有可能突变的SOD1蛋白,以及随后发生的较低的ROS清除率和较高的ROS生成率都会导致GA的碎裂,然而,这些结果与fALS中超氧物介导的氧化损伤的病理机制不一致。
4.3GA与谷氧还蛋白系统(GRX) 谷氧还蛋白(Grx)是细胞内一种重要的巯基-二硫键氧化还原酶,具有多种生物学功能,在细胞内氧化还原平衡状态的调控及抵抗氧化应激损伤过程中发挥重要作用。正常生理情况下,Grx可与胞质内谷胱甘肽(GSH)、谷胱甘肽还原酶(GR)、NADPH共同构成一个氧化还原调节系统,还原体内被氧化了的蛋白质,且对蛋白谷胱甘肽混合型二硫化物的还原具有高选择性。Grx利用谷胱甘肽的两个或一个半胱氨酸残基既可以催化蛋白质之间形成的二硫键还原,也可以催化蛋白质巯基与小分子巯基化合物之间形成的混合二硫键的还原,最常见的就是蛋白质与GSH 之间形成的混合二硫键(Pr-S-S-G)。Fernandes等〔35〕研究发现,在各种氧化应激损伤过程中,谷胱甘肽化蛋白质(Pr-S-S-G)结构最先形成,而Grx的作用主要是对巯基-蛋白质(SH-protein)早期氧化损伤形成的Pr-S-S-G进行修复。因此,在体内的抗氧化防御体系中,Grx发挥着关键作用。Takagi等〔36〕研究发现,当鼠脑中动脉缺血4 h后,脑组织中Grx mRNA 和蛋白的表达均下降,而这种下降和神经元损伤呈平行关系。因此,脑组织中Grx含量的维持,对于神经元抵御氧化应激或GA应激作用非常重要。如果在脑缺血再灌注损伤后的脑组织中迅速给予Grx,可能减弱GA应激或减轻脑组织的损伤。
到目前为止,在哺乳类动物中已经发现4个Grx亚类〔37〕。定位于细胞质的Grx1;主要定位于线粒体的Grx2(Grx2a,睾丸细胞与一些癌细胞表达该蛋白两个额外的细胞质/细胞核亚型,Grx2b和Grx2c来源于可供选择的转录起始和剪切);定位于细胞质的多区域单硫基Grx3;以及线粒体单硫基。
而据Mesecke等〔38〕报道,Grx家族(Grxs)逐渐扩大,新的Grxs成员不断被发现,诸如:Grx6、Grx7和Grx8。Grx6和Grx7能阻止底物蛋白特定硫基的氧化,并且在细胞抵抗氧化应激方面起着关键性的作用。Grx6和Grx7都定位于顺面GA,并且是目前发现的第一个位于分泌途径中内质网下游的氧化还原组分。Grx6和Grx7定位于GA,可以认为它们的合成及其转运通过了GA,并且这对说它们的分泌是必需的。Grx6和Grx7作为抗氧化蛋白,可能对氧化应激下的高尔基体产生保护作用,但这种保护作用是直接对GA的功能产生影响,还是能减少损伤高尔基膜的一些毒性细胞分子,从而达到尽可能维持高尔基膜的完整性,具体机制是值得深入研究的。
4.4GA与硫氧还蛋白系统(TRX) 硫氧还蛋白(Trx)是一类分布广泛的小分子多功能蛋白,它们在进化上相当保守,一般都具有一个相同的有氧化还原活性的Cys-Gly-Pro-Cys的氨基酸序列。Trx与硫氧还蛋白还原酶(TrxR)、还原型烟酰腺嘌呤二核苷磷酸( NADPH )三者共同组成硫氧还蛋白系统。其主要作用是通过二硫键-巯基的交换反应维持细胞内外氧化还原平衡及在氧化应激反应中抗氧化和清除自由基。目前在硫氧还蛋白家族(Trxs)中,主要有Trx1和Trx2两型,Trx1位于细胞质和细胞核中,而Trx2 仅位于线粒体中,被认为是Trx家族中的一种线粒体特异性蛋白。Trx1和Trx2都不依赖经典的ER-Golgi途径就能分泌到细胞外发挥功能。但Jimenez等〔39〕人报道了一个新的Trx蛋白Trx3,该蛋白只在精子细胞中表达,并且是迄今发现的第一个特定的定位于GA的硫氧还蛋白。Trx3为生殖细胞的分化提供了合适的氧化还原环境,并且在高尔基中它的功能可能与精子细胞特定功能蛋白的翻译后修饰有关。
Trx有强烈的清除体内过氧化物的功能,能保护细胞免受诸如肿瘤坏死因子(TNF)以及H2O2等的损伤。在缺血再灌注转基因大鼠中,通过AKT信号的介导,Trx的过表达可阻止神经细胞的凋亡〔40〕。在体内局部的脑缺血再灌注可诱导Trx短暂的表达〔41〕。这些研究结果均表明:Trx能生理性地保护细胞抵御氧化应激及其相关的外界环境改变〔42〕。神经退行性病变患者脑中Trx 水平普遍下降,特别是在杏仁核和海马区域,同时发现了高尔基体碎裂的现象〔43〕。范义等〔44〕通过应用Trx对脑组织缺血再灌注损伤治疗,结果显示:Trx能减小脑缺血再灌注后脑梗死面积,降低脑组织匀浆中MDA含量及提高SOD活性。但是,Trx发挥其神经保护作用是否通过了GA,或者对GA产生了怎样的作用,这些都是值得研究和探讨的。
5 小 结
综上所述,在缺血性脑损伤中,抗氧化系统可能可以通过减弱氧化应激来推迟或减少GA碎裂的情况,最终达到推迟和延长神经细胞死亡的机制。因此,通过改变抗氧化系统相关蛋白表达水平,降低氧化敏感性,维持GA正常生理功能,可以为由氧化应激损伤导致的各种神经系统疾病的治疗提供一种新策略。
6 参考文献
1Holthuis JC,Pomorski T,Raggers RJ,etal.The organizing potential of sphingolipids in intracellular membrane transport〔J〕.Physiol Rev,2001;81(4):1689-723.
2Truettner JS,Hu K,Liu CL,etal.Subcellular stress response and induction of molecular chaperones and folding proteins after transient global ischemia in rats〔J〕.Brain Res,2009;(11):1249:9-18.
3Floyd RA.Antioxidants,oxidative stress,and degenerative neurological disorders〔J〕.Proc Soc Exp Biol Med,1999;222(3):236-45.
4Ren J,Fan C,Chen N,etal.Resveratrol pretreatment attenuates cerebral ischemic injury by upregulating expression of transcription factor Nrf2 and HO-1 in rats〔J〕.Neurochem Res,2011;36(12):2352-62.
5Sugawara T,Chan PH.Reactive oxygen radicals and pathogenesis of neuronal death after cerebral ischemia〔J〕.Antioxid Redox Signal,2003;5(5):597-607.
6Numagami Y,Sato S,Ohnishi ST.Attenuation of rat ischemic brain damage by aged garlic extracts:a possible protecting mechanism as antioxidants〔J〕.Neurochem Int,1996;29(2):135-43.
7Mahon KP,Potocky TB,Blair D,etal.Deconvolution of the cellular oxidative stress response with organelle-specific Peptide conjugates〔J〕.Chem Biol,2007;14(8):923-30.
8Hicks SW,Machamer CE.Golgi structure in stress sensing and apoptosis〔J〕.Biochim Biophys Acta,2005;1744(3):406-14.
9Stieber A,Chen Y,Wei S,etal.The fragmented neuronal Golgi apparatus in amyotrophic lateral sclerosis includes the trans-Golgi-network:functional implications〔J〕.Acta Neuropathol,1998;95(3):245-53.
10Fujita Y,Ohama E,Takatama M,etal.Fragmentation of Golgi apparatus of nigral neurons with alpha-synuclein-positive inclusions in patients with Parkinson′s disease〔J〕.Acta Neuropathol,2006;112(3):261-5.
11Baloyannis SJ,Costa V,Michmizos D.Mitochondrial alterations in Alzheimer′s disease〔J〕.Am J Alzheimers Dis Other Demen,2004;19(2):89-93.
12Hu Z,Zeng L,Xie L,etal.Morphological alteration of Golgi apparatus and subcellular compartmentalization of TGF-beta1 in Golgi apparatus in gerbils following transient forebrain ischemia〔J〕.Neurochem Res,2007;32(11):1927-31.
13Martin LJ,Brambrink AM,Price AC,etal.Neuronal death in newborn striatum after hypoxia-ischemia is necrosis and evolves with oxidative stress〔J〕.Neurobiol Dis,2000;7(3):169-91.
14Rafols JA,Daya AM,O′Neil BJ,etal.Global brain ischemia and reperfusion:Golgi apparatus ultrastructure in neurons selectively vulnerable to death〔J〕.Acta Neuropathol,1995;90(1):17-30.
15Jiang Z,Hu Z,Zeng L,etal.The role of the Golgi apparatus in oxidative stress:is this organelle less significant than mitochondria〔J〕?Free Radic Biol Med,2011;50(8):907-17.
16Ahn JH,Choi JH,Song JM,etal.Increase in Trx2/Prx3 redox system immunoreactivity in the spinal cord and hippocampus of aged dogs〔J〕.Exp Gerontol,2011;46(11):946-52.
17Drechsel DA,Patel M.Respiration-dependent H2O2removal in brain mitochondria via the thioredoxin/peroxiredoxin system〔J〕.J Biol Chem,2010;285(36):27850-8.
18Zhang H,Go YM,Jones DP.Mitochondrial thioredoxin-2/peroxiredoxin-3 system functions in parallel with mitochondrial GSH system in protection against oxidative stress〔J〕.Arch Biochem Biophys,2007;465(1):119-26.
19Delanty N,Dichter MA.Antioxidant therapy in neurologic disease〔J〕.Arch Neurol,2000;57(9):1265-70.
20Youle RJ,Karbowski M.Mitochondrial fission in apoptosis〔J〕.Nat Rev Mol Cell Biol,2005;6(8):657-63.
21Bossy-Wetzel E,Barsoum MJ,Godzik A,etal.Mitochondrial fission in apoptosis,neurodegeneration and aging〔J〕.Curr Opin Cell Biol,2003;15(6):706-16.
22Nakagomi S,Barsoum MJ,Bossy-Wetzel E,etal.A Golgi fragmentation pathway in neurodegeneration〔J〕.Neurobiol Dis,2008;29(2):221-31.
23Fujimura M,Morita-Fujimura Y,Kawase M,etal.Manganese superoxide dismutase mediates the early release of mitochondrial cytochrome C and subsequent DNA fragmentation after permanent focal cerebral ischemia in mice〔J〕.J Neurosci,1999;19(9):3414-22.
24Kim GW,Lewen A,Copin J,etal.The cytosolic antioxidant,copper/zinc superoxide dismutase,attenuates blood-brain barrier disruption and oxidative cellular injury after photothrombotic cortical ischemia in mice〔J〕.Neuroscience,2001;105(4):1007-18.
25Murakami K,Kondo T,Kawase M,etal.Mitochondrial susceptibility to oxidative stress exacerbates cerebral infarction that follows permanent focal cerebral ischemia in mutant mice with manganese superoxide dismutase deficiency〔J〕.J Neurosci,1998;18(1):205-13.
26Nemethova M,Danielisova V,Gottlieb M,etal.Post-conditioning exacerbates the MnSOD immune-reactivity after experimental cerebral global ischemia and reperfusion in the rat brain hippocampus〔J〕.Cell Biol Int,2008;32(1):128-35.
27Jung JE,Kim GS,Narasimhan P,etal.Regulation of Mn-superoxide dismutase activity and neuroprotection by STAT3 in mice after cerebral ischemia〔J〕.J Neurosci,2009;29(21):7003-14.
28Yan BC,Choi JH,Yoo KY,etal.Leptin′s neuroprotective action in experimental transient ischemic damage of the gerbil hippocampus is linked to altered leptin receptor immunoreactivity〔J〕.J Neurol Sci,2011;303(1-2):100-8.
29Rosen DR.Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis〔J〕.Nature,1993;364(6435):362.
30Gurney ME,Pu H,Chiu AY,etal.Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation〔J〕.Science,1994;264(5166):1772-5.
31Tu PH,Gurney ME,Julien JP,etal.Oxidative stress,mutant SOD1,and neurofilament pathology in transgenic mouse models of human motor neuron disease〔J〕.Lab Invest,1997;76(4):441-56.
32Beal MF,Ferrante RJ,Browne SE,etal.Increased 3-nitrotyrosine in both sporadic and familial amyotrophic lateral sclerosis〔J〕.Ann Neurol,1997;42(4):644-54.
33Yim MB,Kang JH,Yim HS,etal.A gain-of-function of an amyotrophic lateral sclerosis-associated Cu,Zn-superoxide dismutase mutant:An enhancement of free radical formation due to a decrease in Km for hydrogen peroxide〔J〕.Proc Natl Acad Sci U S A,1996;93(12):5709-14.
34Yim HS,Kang JH,Chock PB,etal.A familial amyotrophic lateral sclerosis-associated A4V Cu,Zn-superoxide dismutase mutant has a lower Km for hydrogen peroxide.Correlation between clinical severity and the Km value〔J〕.J Biol Chem,1997;272(14):8861-3.
35Fernandes AP,Fladvad M,Berndt C,etal.A novel monothiol glutaredoxin (Grx4) from Escherichia coli can serve as a substrate for thioredoxin reductase〔J〕.J Biol Chem,2005;280(26):24544-52.
36Takagi Y,Nakamura T,Nishiyama A,etal.Localization of glutaredoxin (thioltransferase) in the rat brain and possible functional implications during focal ischemia〔J〕.Biochem Biophys Res Commun,1999;258(2):390-4.
37Lillig CH,Berndt C,Holmgren A.Glutaredoxin systems〔J〕.Biochim Biophys Acta,2008;1780(11):1304-17.
38Mesecke N,Spang A,Deponte M,etal.A novel group of glutaredoxins in the cis-Golgi critical for oxidative stress resistance〔J〕.Mol Biol Cell,2008;19(6):2673-80.
39Jimenez A,Zu W,Rawe VY,etal.Spermatocyte/spermatid-specific thioredoxin-3,a novel Golgi apparatus-associated thioredoxin,is a specific marker of aberrant spermatogenesis〔J〕.J Biol Chem,2004;279(33):34971-82.
40Zhou F,Gomi M,Fujimoto M,etal.Attenuation of neuronal degeneration in thioredoxin-1 overexpressing mice after mild focal ischemia〔J〕.Brain Res,2009;1272:62-70.
41Yan BC,Park JH,Ahn JH,etal.Comparison of the immunoreactivity of Trx2/Prx3 redox system in the hippocampal CA1 region between the young and adult gerbil induced by transient cerebral ischemia〔J〕.Neurochem Res,2012;37(5):1019-30.
42Kim YC,Masutani H,Yamaguchi Y,etal.Hemin-induced activation of the thioredoxin gene by Nrf2.A differential regulation of the antioxidant responsive element by a switch of its binding factors〔J〕.J Biol Chem,2001;276(21):18399-406.
43Lovell MA,Xie C,Gabbita SP,etal.Decreased thioredoxin and increased thioredoxin reductase levels in Alzheimer′s disease brain〔J〕.Free Radic Biol Med,2000;28(3):418-27.
44范 义,滕 妍,张启周,等.人硫氧还蛋白对脑缺血作用的CT灌注与S0D相关性的实验研究〔J〕.北华大学学报(自然科学版),2005;5(4):306-10.
