阿魏酸钠对脂多糖引起的大鼠海马损伤的保护作用的信号传导机制
2014-09-12闫恩志隋海娟刘婉珠
闫恩志 范 莹 隋海娟 刘婉珠 刘 卓
(辽宁医学院药理学教研室, 辽宁 锦州 121001)
阿尔茨海默症(AD)具有多重的神经病理学特征,如老年斑、神经纤维缠结和明显的胶质化〔1〕,其发病机制复杂,作用单一靶点的药物很难达到治疗效果。c-Jun氨基末端激酶(JNK)是哺乳动物细胞重要的应激信号传导通路,AD患者脑内JNK信号传导通路的激活已被学者广泛证实〔2〕,近年来体内、体外的研究中发现JNK信号传导通路的激活参与着淀粉样蛋白沉积〔3〕、tau蛋白磷酸化〔4〕和神经细胞凋亡〔5〕,JNK信号传导通路在AD中具有多重靶点的调节作用,因此寻找作用于JNK信号传导通路的特效药物有望在AD治疗中取得突破性进展。阿魏酸钠(SF)具有抗氧化、抗自由基及抗炎等药理作用,研究发现SF能减轻脂多糖诱导的大鼠海马CA1区锥体神经元损伤,改善大鼠的学习记忆障碍,本研究旨在探讨SF是否通过JNK信号传导通路抑制大鼠海马CA1区炎症反应。
1 材料与方法
1.1动物药品和试剂 SD大鼠,雄性,体重220~280 g,动物合格证号:SCXK(辽)2003-0007,由辽宁医学院动物实验中心提供。SF(苏州畅通有限公司,纯度大于99 %);LPS购于北京邦定泰克生物技术公司(纯度95%);磷酸化丝裂原激活的蛋白激酶的激酶4(MKK4;Thr261,#9151),磷酸化JNK1 (Thr183/Tyr185,#9251),磷酸化c-Jun (Ser63,#9261),caspase-3(#9662)均为兔抗人多克隆抗体,购于Cell Signaling公司;OX-42为鼠抗人多克隆抗体、FITC标记的山羊抗兔抗体和Cy3标记的山羊抗鼠抗体均购于Santa Cruz生物技术公司;碱性磷酸酶标记的山羊抗兔抗体、β-actin和NBT/BCIP显色液购于碧云天试剂公司。
1.2动物分组及模型建立 SD大鼠随机分为四组,即对照组,LPS模型组,100,200 mg/kg SF组。对照组和模型组分别ig生理盐水1.0 ml,SF组ig不同剂量SF1.0 ml。连续灌胃3 w后,各组大鼠用10%水合氯醛300 mg/kg腹腔麻醉,将大鼠头固定在立体定位仪上,大鼠麻醉固定在立体定位仪上,无菌条件下将5 μl LPS 1.0 mmol/L恒速注射到左侧脑室内,正常对照组注射等量的生理盐水。
1.3Western 蛋白印迹检测磷酸化的MKK4、磷酸化JNK1、磷酸化c-Jun和caspase-3蛋白表达水平 大鼠麻醉,快速取海马CA1区,按前述方法进行磷酸化蛋白测定〔6〕,简言之,SDS-PAGE电泳后转膜,加入一抗4℃过夜,二抗孵育2 h(所有抗体均1∶500稀释),避光显色,利用凝胶自动分析成像软件Chem Image 5500对蛋白带进行灰度值分析。
1.4激光共聚焦显微镜观察磷酸化JNK1在小胶质细胞表达部位 制备鼠脑石蜡切片,按前述方法进行p-JNK和OX-42荧光免疫组织化学双染〔6〕,水溶性封片剂封片,共聚焦显微镜下观察,其中绿色荧光的分布和强度反映JNK的定位和表达强度,红色荧光则反映代表小胶质细胞的小胶质细胞特异表达补体C3受体单克隆抗体(OX-42)的表达情况。
1.5统计学处理 采用SPSS11.5软件包进行ANOVA和LSD′s post hoc test检验。
2 结 果
2.1SF对LPS引起的大鼠海马CA1区磷酸化MKK4表达水平的影响 侧脑室注射LPS后,大鼠海马CA1区磷酸化MKK4蛋白表达水平较生理盐水对照组明显增加。 SF(100,200 mg/kg)可明显对抗LPS引起的磷酸化MKK4蛋白表达水平增加(表1)。
2.2阿魏酸钠对LPS引起的大鼠海马CA1区磷酸化JNK1表达水平的影响 侧脑室注射LPS 1 w后,大鼠海马CA1区磷酸化JNK1蛋白表达水平较生理盐水对照组明显增加。SF(100,200 mg/kg)可明显对抗LPS引起的磷酸化JNK1蛋白表达水平增加(图1和表1)。激光共聚焦显微镜进行观察,磷酸化的JNK表达与表示小胶质细胞的OX-42基本重叠(黄色),说明磷酸化的JNK主要在小胶质细胞内表达(图2,表1)。
2.3阿魏酸钠对LPS引起的大鼠海马CA1区磷酸化c-Jun表达水平的影响 侧脑室注射LPS 1 w后,大鼠海马CA1区磷酸化c-Jun蛋白表达水平较生理盐水对照组明显增加。 SF(100,200 mg/kg)可明显对抗LPS引起的磷酸化c-Jun蛋白表达水平增加(P<0.05)(图3和表1)。
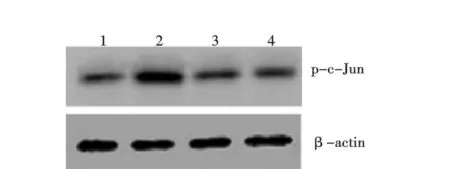
2.4阿魏酸钠对LPS引起的大鼠海马CA1区caspase-3蛋白表达水平的影响 侧脑室注射LPS 1 w后,大鼠海马CA1区caspase-3蛋白表达水平较生理盐水对照组明显增加,SF(100,200 mg/kg)可明显对抗LPS引起的caspase-3蛋白表达水平增加(图4和表1)。
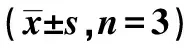
表1 SF对LPS引起的大鼠海马CA1区p-MKK4、p-JNK1、p-c-Jun和caspase-3蛋白表达灰度值分析结果

1.对照组;2.模型组;3.SF 100 mg/kg组;4.SF 200 mg/kg组
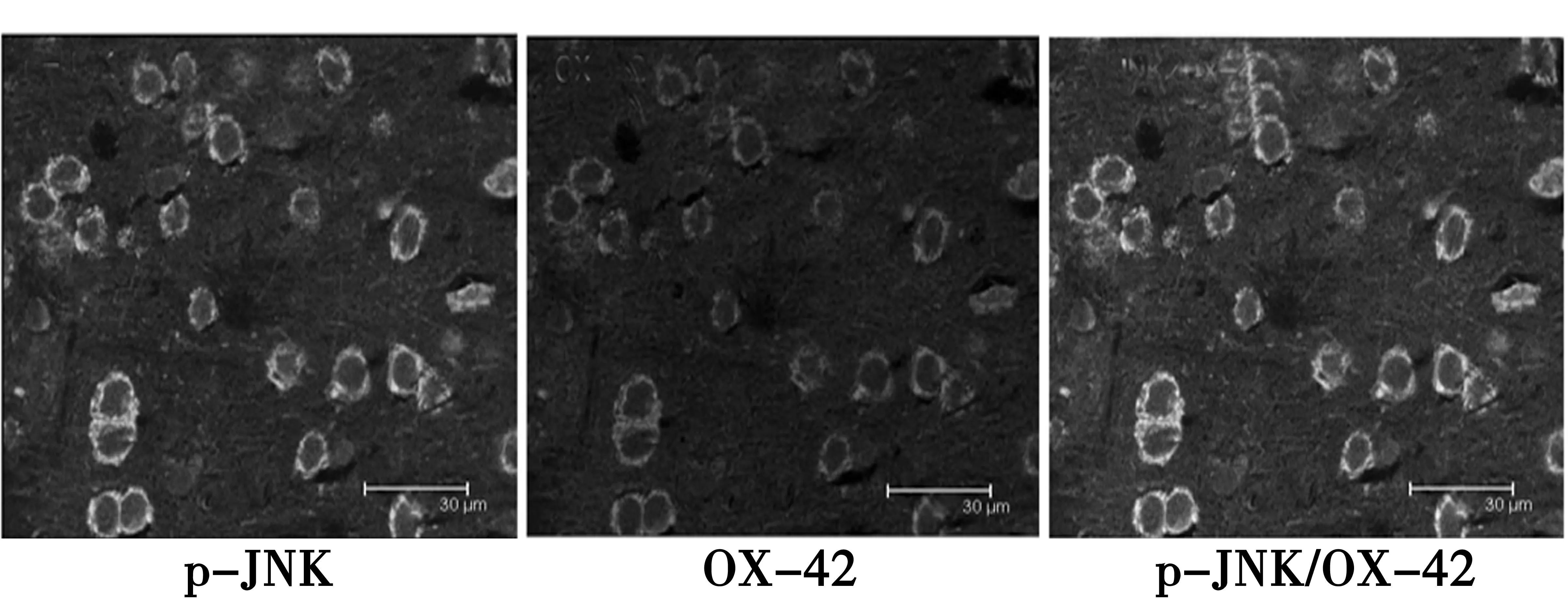
图2 激光共聚焦显微镜定位大鼠海马CA1区磷酸化JNK和OX-42在小胶质细胞表达
1.对照组;2.模型组;3.SF 100 mg/kg组;4.SF 200 mg/kg组
1.对照组;2.模型组;3.SF 100 mg/kg组;4.SF 200 mg/kg组
3 讨 论
本研究发现脑室注射LPS后大鼠海马CA1区磷酸化JNK,c-Jun表达增加,同时JNK通路上游磷酸化MKK4表达也明显增加,激光共聚焦显示JNK的表达部位主要是在小胶质细胞,说明JNK通路在小胶质细胞活化介导的神经细胞凋亡中可能起着主要作用。MKK4在上游激酶作用下激活,活化的MKK4进一步磷酸化JNK分子的丝氨酸残基位点,活化JNK〔7〕。JNK是位于胞质分子量为54KU的丝氨酸/苏氨酸蛋白激酶,它的双磷酸化功能区Thr-Pro-Tyr与c-Jun N端的活化区结合并使其第63、73位丝氨酸残基磷酸化从而使其活化并转移到细胞核,引起级联反应,导致其一些底物相应激活〔8,9〕。JNK激活后可通过两种途径发挥作用,一是上调促凋亡相关蛋白的表达:JNK通过磷酸化c-Jun,活化的c-Jun可以聚合成类二聚体或与c-Fos 聚合成异二聚体,形成活化蛋白-1(AP-1)复合物,使c-Jun转录活性增强〔10〕,促进肿瘤坏死因子(TNF)α、白细胞介素(IL)-1β、iNOS、COX-2等炎症因子表达〔11,12〕。另一方面是参与线粒体介导的细胞凋亡通路,通过改变线粒体通透性转换孔的通透性释放细胞色素C,进而活化促凋亡因子Apaf-1,促发caspase-9,caspase-3级联反应,Caspase-3 是caspase家族的重要成员之一,是凋亡执行的最终效应因子,活化的caspase-3可以裂解很多靶蛋白,使细胞内一些重要的生理过程发生障碍、细胞器的一些结构成分崩解。本研究也发现LPS在上调JNK通路的同时也促进了磷酸化的caspase-3蛋白表达,而SF不仅能明显抑制LPS引起的磷酸化MKK4,JNK,c-Jun表达增加,也能明显抑制caspase-3蛋白表达增加,提示SF可能通过抑制JNK信号传导通路起到抗细胞凋亡的作用。
JNK信号传导通路除了参与AD脑内的炎症病变,还参与老年斑及神经纤维缠结的形成〔13〕,有研究显示神经纤维缠结的形成过程与AD患者的痴呆严重程度相关,我们的实验仅证明了SF通过抑制JNK信号传导通路抗细胞凋亡的作用,SF是否还存在其他抗AD作用机制还需进一步研究。
4 参考文献
1Silverman W,Wisniewski HM,Bobinski M,etal.Frequency of stages of Alzheimer-related lesions in different age categories〔J〕.Neurobiol Aging,1997;18(4):377-9.
2Savage MJ,Lin YG,Ciallella JR,etal.Activation of c-Jun N-terminal kinase and p38 in an Alzheimer′s disease model is associated with amyloid deposition〔J〕.Neurosci,2002;22(9):3376-85.
3Dhanasekaran DN,Reddy EP.JNK signaling in apoptosis〔J〕.Oncogene,2008;27(48):6245-51.
4Reynolds CH,Utton MA,Gibb GM,etal.Stress-activated protein kinase/c-jun N-terminal kinase phosphorylates tau protein〔J〕.J Neurochem,1997;68(4):1736-44.
5Colombo A,Bastone A,Ploia C,etal.JNK regulates APP cleavage and degradation in a model of Alzheimer′s disease〔J〕.Neurobiol Dis,2009;33(3):518-25.
6闫恩志,范 莹,金 英.吡格列酮对淀粉样 蛋白片段1-42引起的大鼠海马c-Jun氨基端激酶信号传导通路改变的作用〔J〕.中国药理学与毒理学杂志,2010;24(6):174-9.
7Ho DT,Bardwell AJ,Grewal S,etal.Interacting JNK-docking sites in MKK7 promote binding and activation of JNK mitogen-activated protein kinases〔J〕.J Biol Chem,2006;281(19):13169-79.
8Dérijard B,HibI M,Wu IH,etal.JNK1:a protein kinase stimulated by UV light and Ha-Ras that binds and phosphorylates the c-Jun activation domain〔J〕.Cell,1994;76(6):1025-37.
9Baltriukiene D,Kalvelyte A,Bukelskiene V.Induction of apoptosis and activation of JNK and p38 MAPK pathways in deoxynivalenol-treated cell lines〔J〕.Altern Lab Anim,2007;35(1):53-9.
10Halazonetis TD,Georgopoulos K,Greenberg ME,etal.c-Jun dimerizes with itself and with c-Fos,forming complexes of different DNA binding affinities〔J〕.Cell,1998;55(5):917-24.
11Pan XD,Chen XC,Zhu YG,etal.Tripchlorolide protects neuronal cells from microglia-mediated beta-amyloid neurotoxicity through inhibiting NF-kappaB and JNK signaling〔J〕.Glia,2009;57(11):1227-38.
12Bodles AM,Barger SW.Secreted beta-amyloid precursor protein activates microglia via JNK and p38-MAPK〔J〕.Neurobiol Aging,2005;26(1):9-16.
13Steven P,Braithwaite SP,Ralf S,etal.Inhibition of c-Jun kinase provides neuroprotection in a model of Alzheimer′s disease〔J〕.Neurobiol Dis,2010;39:311-7.
