卵巢癌中E-Cadherin异常甲基化与激素受体蛋白表达的相关性
2014-09-12游颜杰黄继红陈炯玉洪超群
吴 晓 游颜杰 黄继红 陈炯玉 洪超群 陈 蕾
(汕头大学医学院附属肿瘤医院病理科,广东 汕头 515041)
卵巢癌5年生存率为30%~50%〔1〕。上皮细胞钙黏蛋白(E-cadherin)表达下调或缺失可使细胞呈现恶性形态并具备侵袭性生长特性。研究证实启动子甲基化是导致E-cadherin表达失活的重要方式之一〔2~4〕。本实验通过甲基化特异性PCR与免疫组化方法检测了E-cadherin在卵巢癌中的基因甲基化状态与蛋白表达水平,并结合临床病理因素分析二者相关性,同时观察去甲基化药物处理细胞对E-cadherin表达及肿瘤恶性生物学行为的影响。
1 材料与方法
1.1材料 收集汕头大学医学院附属肿瘤医院在2004~2010年收治的卵巢癌患者手术标本50例。FIGO分期包括Ⅰ期9例,Ⅱ期3例,Ⅲ期32例,Ⅳ期6例;按肿瘤病理组织学分型,包括浆液性腺癌35例、黏液性腺癌9例、子宫内膜样腺癌6例;按Silverberg分级,包括G1期10例,G2期22例,G3期18例。患者年龄22~71(平均年龄51.12)岁。另外收集正常卵巢组织10例(年龄≤40岁,因其他疾病而切除卵巢者)。人卵巢癌细胞株SKOV3及ES2由第四军医大学白求恩军医学院冉永刚硕士惠赠。
1.2试剂 5-杂氮-2′-脱氧胞苷(5-aza-2′-deoxycytidine,5-Aza-dC)与四甲基偶氮唑盐(Methyl thiazolyl tetrazolium,MTT)购自美国Sigma公司;GTpureTM石蜡组织DNA提取试剂盒购自上海基因科技有限公司,DNA提取试剂盒购自北京天根公司,EpiTect Kit与Hot Star Taq热启动酶购自德国Qiagen公司;DMEM培养基和胎牛血清(FBS)均购自美国Gibco公司;Trizol试剂与逆转录试剂盒购自美国Invitrogen公司;鼠抗人E-cadherin单克隆抗体、雌激素受体(ER)抗体、孕激素受体(PR)抗体,Ki-67抗体、二步法免疫组化检测试剂与HRP标记鼠抗人IgG购自北京中杉金桥公司;Matrigel购自美国BD Biosciences公司;Transwell培养小室购自美国Millipore公司。
1.3细胞培养与药物处理 SKOV3与ES2细胞用含10% FBS的DMEM培养基,置于37℃、5% CO2条件下常规培养。去甲基化药物处理后用含20 μmol/L 5-Aza-dC培养基培养细胞,72 h后进行后续检测。
1.3卵巢癌组织与细胞中E-cadherin的表达检测
1.3.1免疫组织化学染色 组织标本均经4%中性甲醛缓冲固定液,石蜡包埋,4 μm厚切片,0.01 mol/L柠檬酸盐缓冲液抗原热修复,EnVision二步法染色,常规DAB显色,苏木素对比染色,透明封片, PBS代替一抗作为空白对照。其中,E-cadherin鼠抗人单克隆抗体工作浓度为1∶250,ER为1∶100,PR为1∶100,Ki-67为1∶200。E-cadherin以细胞膜表达明显的黄色或棕黄色颗粒为阳性细胞信号,≥75%即正常表达,<75%为表达下调〔4〕。ER和PR以细胞核出现明显的黄色或棕黄色阳性颗粒为阳性细胞信号,即阳性。Ki-67以细胞核出现明显的黄色或棕黄色阳性颗粒为阳性细胞信号,以百分比标示取中位数,大于中位数的为阳性表达。
1.3.2RT-PCR检测E-cadherin基因mRNA表达水平 以Trizol试剂与逆转录试剂盒提取总RNA并合成cDNA,操作均按试剂说明书进行。PCR扩增引物序列如下:E-cadherin基因上游引物:5′-TTAAGGGGTCTGTCATGGAAGGT-3′,下游引物:5′-GTGTAAGCGATGGCGGCATTGTA-3′,扩增产物长度109 bp;内参照β-actin基因上游引物:5′-GAACCCCAAGGCCAACCGCGAGA-3′,下游引物:5′-TGACCCCGTCACCGGAGTCCATC-3′,产物长度149 bp。反应条件:95℃预变性5 min;94℃变性60 s,55℃退火30 s,72℃延伸60 s,共30个循环;最后72℃延伸10 min。取适量产物经2%琼脂糖凝胶电泳分离,成像系统进行拍照分析。分别以β-actin与正常卵巢组织为内参照与正常对照。
1.3.3Western印迹法检测E-cadherin基因蛋白表达水平 取50 μg细胞总蛋白进行SDS-PAGE后电转移至PVDF膜上,置于含有5% BSA的TBST中4℃封闭过夜;加入1∶500稀释的E-cadherin抗体于37℃作用1 h;充分洗涤后加入1∶1 000稀释的HRP标记羊抗鼠IgG,37℃作用30 min,以ECL Kit进行化学发光反应,胶片随后进行显影、定影。分别以β-actin与正常组织为内参照与正常对照。
1.4甲基化特异性PCR(MS-PCR)分析E-cadherin启动子甲基化状态 石蜡组织标本与细胞基因组DNA提取分别使用GTpureTM石蜡组织DNA提取试剂盒和天根基因组DNA提取试剂盒,以EpiTect Kit进行上述样本亚硫酸氢盐修饰与纯化,各项操作按说明书进行。PCR反应引物序列如下:E-cadherin基因甲基化(M)上游引物:5′-TAATTTTAGGTTAGAGGGTTATCGC-3′,下游引物:5′-CTCACAAATACTTTACAATTCCGAC-3′,扩增产物长度213 bp;非甲基化(U)上游引物:5′-ATTTTAGGTTAGAGGGTTATTGTGT-3′,下游引物:5′-CAAACTCACAAATACTTTACAATTCCA-3′,产物长度215 bp。反应条件:95℃预变性5 min;94℃变性60 s,55℃退火30 s,72℃延伸60 s,35个循环。甲基化状态判定标准如下,仅非甲基化引物扩增出相应片段为甲基化阴性;仅有甲基化引物扩增出相应片段即为完全甲基化,甲基化引物与非甲基化引物均扩增出相应片段为不完全甲基化,完全甲基化和不完全甲基化均计为甲基化检测阳性。
1.5MTT比色法检测5-Aza-dC处理对卵巢癌细胞增殖能力的影响 5×103/孔细胞接种于96孔板中,每组设4个复孔,常规培养24 h后更换含有20 μmol/L 5-Aza-dC的培养液培养72 h后,加入20 μl MTT(5 mg/ml)继续培养4 h;弃去培养液加入150 μl DMSO,缓慢振荡10 min,测定各孔490 nm吸光度值。实验重复3次取平均值。
1.6侵袭实验检测5-Aza-dC处理对卵巢癌细胞侵袭能力的影响 SKOV3细胞经20 μmol/L 5-Aza-dC作用72 h后,2×105加入于预先铺有Matrigel的Transwell上室,放入含10% FBS的DMEM培养基的24孔板内常规培养24 h后,取出上室以甲醇固定后结晶紫染色,擦掉位于上室面未穿过膜的细胞后封片,计数5个200倍视野的迁移细胞数,实验重复3次取平均值。
1.7统计学方法 率比较采用χ2检验,两组间比较采用t检验,小样本资料选用Fisher精确检验法,指标间的相关性采用Spearman等级相关分析法。
2 结 果
2.1卵巢癌组织中E-cadherin基因启动子甲基化状态 E-cadherin甲基化在卵巢癌中检测阳性率为64.0%(32/50)(图1)。10例正常对照卵巢组织中未检测到出现E-cadherin甲基化。结合临床病例资料分析,E-cadherin甲基化与各项临床病理指标及ER、PR与Ki67表达水平均无显著相关(P>0.05)。见表1。
2.2卵巢癌组织中E-cadherin蛋白表达水平 卵巢癌组织中E-cadherin表达于癌细胞胞膜,其表达下调率为60.0%(30/50)(图2)。在Ⅲ~Ⅳ期的晚期病例标本中的E-cadherin表达率低于Ⅰ~Ⅱ期的早期病例标本(P<0.05);按不同病理类型分析,E-cadherin表达在浆液性腺癌组中显著低于非浆液性腺癌组(黏液性腺癌组和子宫内膜样腺癌组)(P<0.01)。50例卵巢癌标本中,E-cadherin表达同ER、Ki-67阳性表达呈负相关(rs=-0.327,P<0.05;rs=-0.298,P<0.005),但与PR表达无相关性(P>0.05)。见表1。
2.3卵巢癌中E-cadherin甲基化与蛋白表达的相关性 32例E-cadherin甲基化阳性的卵巢癌样本中27例(84.4%)E-cadherin表达下调,而在甲基化检测阴性的18例中E-cadherin表达下调者仅为6例(33.3%)(P<0.01)(表1)。采用Spearman等级相关分析表明,E-cadherin基因启动子甲基化水平与其蛋白表达呈显著负相关(rs=-0.408,P=0.004)。

表1 E-cadherin甲基化及E-cadherin表达与临床病理特征的关系〔n(%)〕

图1 卵巢癌组织中E-cadherin启动子甲基化状态(n=10)
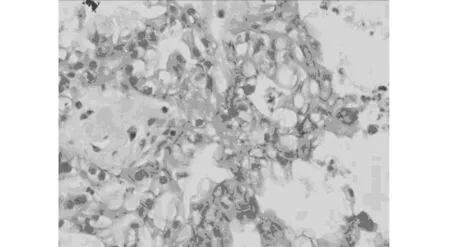
图2 免疫组织化学检测卵巢癌组织中E-cadherin蛋白表达(Envision法,×400)
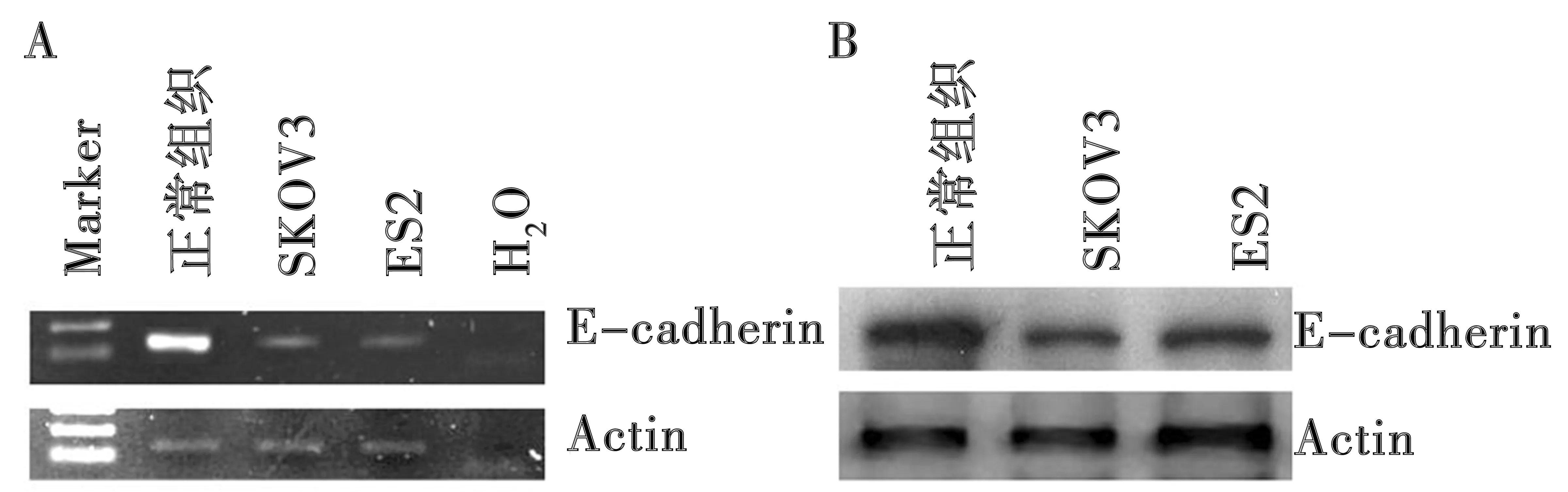
A:RT-PCR;B:Western印迹

图4 卵巢癌细胞中E-cadherin启动子甲基化状态

A:RT-PCR;B:Western印迹
2.4去甲基化试剂处理对卵巢癌细胞E-cadherin表达水平的影响 RT-PCR及Western印迹法结果显示,SKOV3与ES2细胞中E-cadherin的表达水平同正常卵巢组织相比均出现明显降低(图3)。MS-PCR表明E-cadherin基因启动子区域在两种细胞中均处于不完全甲基化状态。经20 μmol/L 5-Aza-dC作用72 h后,SKOV3细胞中E-cadherin基因在mRNA及蛋白水平的表达均出现显著上调。
2.5去甲基化药物处理对卵巢癌细胞增殖能力的影响 MTT检测结果表明,经20 μmol/L 5-Aza-dC作用后,SKOV3细胞(0.281±0.034)与ES2细胞(0.254±0.037)的增殖能力显著降低,与未处理组相比分别降低28.0%(0.390±0.041)和32.3%(0.375±0.041,P<0.05)。
2.65-Aza-dC处理对卵巢癌细胞侵袭能力的影响 SKOV3与ES2细胞经5-Aza-dC药物处理后,通过滤膜迁移进至侵袭小室下腔的数量分别为(237.9±33.5)和(265.7±32.1),与未处理组相比分别减少38.2%(385.0±37.5)和27.4%(365.0±28.5,P<0.05)。
3 讨 论
E-cadherin参与机体内许多生物过程,包括调节钙介导的细胞黏附、细胞极性及形态的形成、细胞的聚集和迁移、细胞的识别和信号的传导机制等等。通过免疫组化检测发现,60.0%的卵巢癌中出现E-cadherin表达下调,与临床分期和病理分级显著相关,E-caderin表达下调参与卵巢肿瘤的发展过程。
E-cadherin启动子区域的高甲基化状态可以导致其基因转录失活与蛋白表达缺失,与多种肿瘤的增殖、侵袭与转移密切相关〔5〕。本研究对50例标本检测发现,E-cadherin基因启动子区域甲基化在卵巢癌中高频发生(64.0%),此结果与在其他恶性肿瘤中的相关研究报道基本一致〔2~4,6~9〕。
本研究结果还显示E-cadherin甲基化与其蛋白表达呈显著负相关,表明由启动子甲基化导致基因失活可能是卵巢癌中E-cadherin表达下调的主要机制之一。然而,在发生甲基化的肿瘤组织其蛋白表达仍可呈阳性。肿瘤组织中混杂有正常组织是其原因之一,基因异质性甲基化或一个等位基因发生甲基化也是一个重要的原因。而且在研究中也发现蛋白表达呈阳性而同时发生甲基化的组织,其甲基化均表现为不完全甲基化的情况。此外,目前认为DNA 甲基化主要在转录水平抑制基因的表达,有研究表明CpG岛甲基化的密度与转录的抑制程度有关,弱的启动子能被密度较低的甲基化完全抑制,而当启动子由增强子增强时,即可恢复转录功能〔10,11〕。部分肿瘤组织可能由于E-cadherin基因启动子甲基化程度不足以抑制转录,从而导致了发生甲基化的组织其蛋白表达仍可为阳性。
促使肿瘤形成的遗传因素包含两大类机制,一是通过DNA核苷酸序列改变而形成突变,即遗传学机制,另外就是表观遗传学机制,即DNA核苷酸序列不变,通过碱基修饰的改变导致基因表达水平的变化。上述两种机制相互交叉存在。不同于遗传学机制,表观遗传改变是可以逆转的。逆转抑癌基因的甲基化状态可用于肿瘤的治疗〔12〕。因此,本研究进一步应用去甲基化试剂处理卵巢癌细胞,观察逆转基因甲基化状态是否可以恢复E-cadherin表达,希望在细胞水平进一步证实启动子异常甲基化可以造成卵巢癌细胞E-cadherin表达沉默。结果发现,经甲基转移酶抑制剂5-Aza-dC处理两株卵巢癌细胞株能有效诱导E-cadherin基因的RNA转录和蛋白表达。本研究结果亦显示,5-Aza-dC处理同时减弱肿瘤细胞的增殖与侵袭能力,该作用可能是通过抑制基因启动子甲基化恢复E-cadherin正常表达等途径实现的。
本研究表明E-cadherin在卵巢癌中的表达减弱与基因启动子甲基化密切相关,应用去甲基化药物能够恢复E-cadherin的表达水平并抑制肿瘤细胞的恶性生物学特征,有助于从基因水平上了解卵巢癌的发展规律。
4 参考文献
1Ceccarelli F,Barberi S,Pontesilli A,etal.Ovarian carcinoma presenting with axillary lymph node metastasis:a case report〔J〕.Eur J Gynaecol Oncol,2011;32(2):237-9.
2Espada J,Peinado H,Lopez-Serra L,etal.Regulation of SNAIL1 and E-cadherin function by DNMT1 in a DNA methylation-independent context〔J〕.Nucleic Acids Res,2011;39(21):9194-205.
3Niemhom S,Kitazawa S,Kitazawa R,etal.Hypermethylation of epithelial-cadherin gene promoter is associated with Epstein-Barr virus in nasopharyngeal carcinoma〔J〕.Cancer Detect Prev,2008;32:127-34.
4Guo W,Dong Z,Guo Y,etal.Detection of promoter hypermethylation of the CpG island of E-cadherin in gastric cardiac adenocarcinoma〔J〕.Eur J Med Res,2009;14:453-8.
5Yi Kim D,Kyoon Joo J,Kyu Park Y,etal.E-cadherin expression in early gastric carcinoma and correlation with lymph node metastasis〔J〕.J Surg Oncol,2007;96(5):429-35.
6Tränkenschuh W,Puls F,Christgen M,etal.Frequent and distinct aberrations of DNA methylation patterns in fibrolamellar carcinoma of the liver〔J〕.PLoS One,2010;5(10):e13688.
7Yi TZ,Guo J,Zhou L,etal.Prognostic value of E-cadherin expression and CDH1 promoter methylation in patients with endometrial carcinoma〔J〕.Cancer Invest,2011;29(1):86-92.
8Bol GM,Suijkerbuijk KP,Bart J,etal.Methylation profiles of hereditary and sporadic ovarian cancer〔J〕.Histopathology,2010;57(3):363-70.
9Sun D,Zhang Z,Van do N,etal.Aberrant methylation of CDH13 gene in nasopharyngeal carcinoma could serve as a potential diagnostic biomarker〔J〕.Oral Oncol,2007;43(1):82-7.
10Tsai HC,Baylin SB.Cancer epigenetics:linking basic biology to clinical medicine〔J〕.Cell Res,2011;21(3):502-17.
11Rodríguez-Paredes M,Esteller M.Cancer epigenetics reaches mainstream oncology〔J〕.Nat Med,2011;17(3):330-9.
12Desmond JC,Raynaud S,Tung E,etal.Discovery of epigenetically silenced genes in acute myeloid leukemias〔J〕.Leukemia,2007;21:1026-34.
