MMP-2基因多态性与河南汉族群体慢性充血性心力衰竭的相关性
2014-09-12殷国田赵林静黄艳梅郭利伟张新宁李征辉
殷国田 赵林静 黄艳梅 郭利伟 张新宁 李征辉 李 娜
(新乡医学院基础医学院,河南 新乡 453003)
基质金属蛋白酶(MMPs)是锌依赖性蛋白酶家族,能降解细胞外基质蛋白,参与结缔组织破坏与重构。许多研究证实无论心力衰竭动物或人类,MMP基因表达和酶活性都是增高的,并且是心室重构和扩张的重要触发因素,而并非继发于心力衰竭〔1~3〕。MMP-2的表达及活性过度增强时,可能参与心脏组织及脉管系统的重构,从而引起心血管系统损害,最终导致心功能恶化乃至心衰〔4~6〕。本项目研究了MMP-2基因启动子区-1575G/A、-1059G/A、-790G/T 3个单核苷酸多态性(SNPs)位点,并探讨其与河南汉族群体慢性充血性心力衰竭(CHF)发病的相关性。
1 材料与方法
1.1研究对象 选择河南省新乡医学院第三附属医院心血管内科2010年12月至2011年12月收治的120例CHF患者作为病例组(心衰组)。其中男72例,女48例,年龄58~79〔平均(62.1±10.5)〕岁。与心衰组同期住院的非心衰心脏病患者,共收集136例,其中男78例,女58例,年龄46~78〔平均年龄(60.7±8.8)〕岁,亦排除血液疾病、恶性肿瘤、严重肝肾功能不全等疾病。所有入选对象均签署知情同意书。
1.2主要仪器与试剂 多功能电泳仪(Phannacia公司,瑞典)、凝胶成像分析系统(Bio-Rad公司,美国)、UV-1240核酸蛋白分光光度计(岛津公司,日本)、台式高速冷冻离心机(Eppendorf公司,德国)、PCR仪(Biometra公司,德国)Taq 酶 (上海生物工程有限公司)、MMP-2基因SNPs位点扩增引物 (Invitrogen生物公司上海英潍捷基贸易有限公司)、限制性内切酶Hha Ⅰ、BspH Ⅰ、Ade Ⅰ(西班牙MBI生物公司)。
1.3研究方法
1.3.1资料收集 所有入选对象均由经统一培训的住院医师、研究生填写自制统一格式的调查表,然后由2名监督员对每1份调查表进行检查、审核,有错误者补充漏项、纠正错误。
1.3.2生化指标测定 受试者经10 h过夜空腹,取凌晨6:00空腹静脉血8 ml,其中3 ml用于血脂等生化指标测定、5 ml用于外周血白细胞的DNA提取。血生化指标检测由新乡医学院第三附属医院检验科采用现行标准化方法完成并统一进行质量控制。
1.3.3基因组DNA的提取与定量 采用常规酚/氯仿法提取血样中的基因组DNA,采用UV-260紫外分光光度仪(日本岛津公司)计检测DNA的质与量,-20℃保存备用。
1.3.4SNPs目的片段扩增 PCR反应体系:总体积为25 μl,含10×缓冲液 2.5 μl、25 mmol/L Mg2+1.5 μl、2 mol/L dNTP 1 μl、10 mmol/L Primers 2 μl、Taq DNA 聚合酶1 U、基因组DNA(10~100 ng)3 μl、ddH2O 14.6 μl。 热循环参数94℃预变性2 min,94℃变性30 s,退火45 s(各SNPs引物序列及退火温度见表1),72℃延伸45 s,36个循环,最后72℃延伸10 min。

表1 MMP-2基因3个SNPs位点扩增引物序列、退火温度及限制性内切酶
1.3.5SNPs等位基因分型 对PCR产物进行酶切,采用限制性内切酶片段长度多态性(PCR-RFLP)方法鉴定SNPs的等位基因及基因型,各SNPs所用限制性内切酶见表1。酶切反应体系为:PCR产物5.0 μl,内切酶1 U,10×酶切缓冲液1.0 μl,纯水补足总体积至10 μl,37℃水浴10 h;酶切产物取3.0 μl上样,用6%非变性聚丙烯酰胺凝胶垂直电泳进行检测,恒压200 v,1 h,电泳同时加入100 bp DNA Marker以及PCR扩增产物(未酶切)做内参。
1.4统计学方法 将各组基因型及等位基因输入Excel表格,采用病例对照分析并运用SHEsis软件〔7〕进行病例与对照组间频数及频率分布比较、HarDY-Weinberg平衡检验、单体型推断、相对危险度(OR)及95%置信区间(CI)计算。
2 结 果
2.1一般特征 两组患者性别构成及年龄无显著差异(P>0.05)。与对照组相比,心衰组血尿酸(UA)水平明显升高,吸烟比例以及各项血脂水平都显著降低(P<0.05)。见表2。
2.2MMP-2基因上3个SNPs与CHF的相关性
2.2.1PCR-RFLP结果及基因型分析 MMP-2-1575G/A、-1059G/A、-790G/T 3个SNPs位点引入的酶切位点及内切酶见表3。根据电泳出现条带判定基因型。各位点等位基因电泳图谱如图1,实际操作中以带型集中区照相判读。
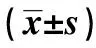
表2 两组一般情况比较
2.2.2两组各SNPs等位基因和基因型频率分布 MMP-2-1575G/A、-1059G/A、-790G/T 3个SNPs位点的等位基因及基因型频率在CHF和对照人群中均符合HarDY-Weinberg平衡(P>0.05)。MMP-2基因-1575G/A、-1059G/A、-790G/T 3个SNPs多态性与CHF的相关性如表4、表5所示。与对照组相比,CHF组MMP-2-1575G/A的A等位基因和GA基因型的频率显著降低(P<0.001),OR=0.08〔95%CI(0.019~0.039)〕<1。MMP-2-790G/T的T等位基因频率显著增加(P<0.001),OR=1.989〔95%CI(1.337~2.959)〕>1;TT基因型频率与对照组相比也显著增加(P<0.05)。MMP-2-1059G/A SNP位点等位基因与基因型频率在两组间差异没有统计学意义(P>0.05),OR=1.129〔95%CI(0.772~1.651)〕。

表3 MMP-2基因3个SNPs位点等位基因判断及内切酶
2.2.3MMP-2单体型分析 用SHEsis软件统计分析,推断出MMP-2基因-1575G/A、-1059G/A和-790G/T 3个SNPs位点在CHF组和对照组分别有7种、6种单体型,其中单体型GAG、GAT、GGG、和GGT在CHF组和对照组频率均(P>0.01)。进一步对4种频率>l%的单体型两组间进行比较,GGG和GGT单体型的频率在CHF组和对照组中存在显著差异(P<0.01),其中GGT单体型OR=1.802〔95%CI(1.265~2.569)〕>1。见表6。

M:DNA Marker;1、2、3、5、6、7、8、9、10:GG;4:GA M:DNA Marker;1、2、3、8:GA;4、5、6、7:GG;9:AA M:DNA Marker;1、2、4、5:GT;3、6:TT;7、8:GG
表4MMP-2基因3个SNPs位点在两组中等位基因和基因型频率分布〔n(%)〕

1)P<0.001;2)P<0.05;下表同
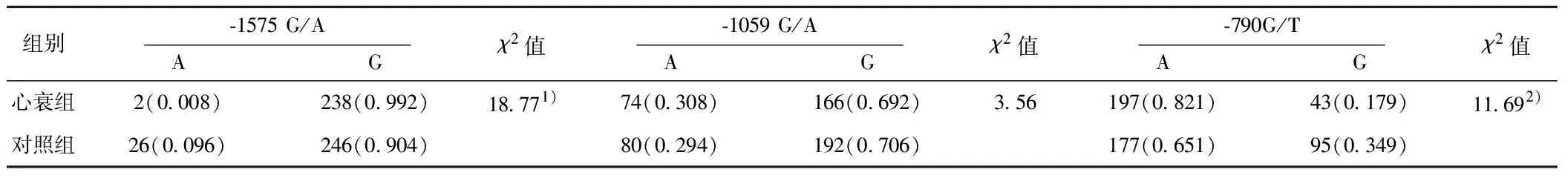
表5 MMP-2基因3个SNPs位点在两组中等位基因频率分布及OR值
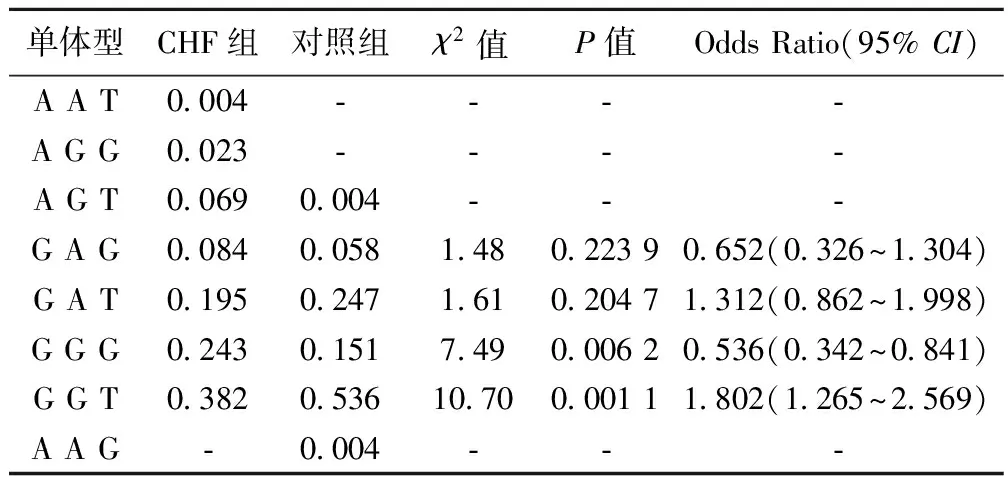
表6 MMP-2基因3个SNPs位点在两组中等位基因和基因型频率分布
3 讨 论
心力衰竭的病理生理机制主要与心肌重构和神经-内分泌系统的激活两大因素有关,细胞外基质(ECM)在心肌重构中的作用已得到公认。MMPs对降解ECM有重要作用,近年研究表明,MMPs的表达及活性增强参与许多心血管疾病的发展过程〔8〕。
MMP-2在内皮细胞、成纤维细胞、心肌细胞等大部分结缔组织细胞中都有基础表达,有研究发现MMP-2水平与心力衰竭过程中的左室扩张和功能不全有关。实验室研究也证实MMP-2活性升高与心肌缺血再灌注损伤中的心肌顿抑有关,并可以直接损伤心肌收缩力〔9〕。某些MMP-2亚型基因启动子区的多态性可以影响到转录因子与这一区域的结合,进而影响整个转录效率。已有研究证实MMP-2启动子区多态性位点与心力衰竭存在相关性〔2,9〕。本研究提示A等位基因可能降低个体CHF危险。基因功能研究提示MMP-2 -1575G/A位点处于雌激素受体结合位点的5′侧,-1575G表现出增强子的功能,而-1575A转录活性显著降低。因此,MMP-2- 1575G等位基因可以增加MMP-2的表达,进而产生破坏ECM、心肌顿抑和直接损害心肌肌原纤维的作用,1575A等位基因则降低MMP-2转录活性,减少表达,减轻了上述不良影响,因而降低了收缩性心力衰竭的易感性〔10〕。
在河南汉族群体中,两组比较,MMP-2启动子-790G/T 的T等位基因频率显著增加。本研究结果与Vasku等〔11〕研究发现,在CHF的患者中,MMP-2 -790T/G的T等位基因频率显著增加一致,说明MMP-2-790G/T 的T等位基因频率显著增加可能会增加个体CHF的患病风险。用SHEsis软件统计分析,推断出MMP-2基因-1575G/A、-1059G/A和-790G/T 3个SNPs位点的单体型GAG、GAT、GGG、和GGT在心衰组和对照组频率均>0.01,其中GGG和GGT单体型的频率在病例和对照组中存在显著差异(P<0.05), GGT单体型OR值>1,说明GGT单体型可能增加CHF的危险性。
本研究结果表明,在河南汉族人群中,MMP-2基因1575G/A 位点A等位基因可能会降低CHF的患病风险;MMP-2-790G/T 的T等位基因以及MMP-2基因启动子区-1575 G/A、-1059G/A、-790G/T位点所组成的GGT单体型都可能增加CHF的患病风险;而MMP-2基因-1059G/A多态性在河南汉族人群中可能与CHF的易感性无关。
4 参考文献
1华倚虹,宋 丽,吴娜琼,等.基质金属蛋白酶2基因多态性与缺血性收缩性心衰预后相关〔J〕.中国分子心脏病学杂志,2009;9(1):38-42.
2Back M,Ketelhuth DF,Agewall S.Matrix metalloproteinases in atherothrombosis〔J〕.Prog Cardiovasc Dis,2010;52(5):410-28.
3Li X,Wu JF.Recent developments in patient anti-cancer agents targeting the matrix metalloproteinases (MMPs)〔J〕.Recent Pat Anticancer Drug Discov,2010;5(2):109-41.
4Wang GY,Bergman MR,Nguyen AP,etal.Cardiac transgenic matrix metalloproteinase-2 expression directly induces impaired contractility〔J〕. Cardiovasc Res,2006;69(3):688-96.
5Alp E,Menevse S,Tulmac M,etal.The role of matrix metalloproteinase-2 promoter polymorphisms in coronary artery disease and myocardial infarction〔J〕.Genet Test Mol Biomarkers,2011;15(4):193-202.
6丁 巍.基质金属蛋白酶家族基因启动子多态性及其与疾病关系的研究进展〔J〕.医学综述,2011;17(22):3389-92.
7Shi YY,He L.SHEsis,a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci〔J〕.Cell Res,2005;15(2):97-8.
8Sakata Y,Yamamoto K,Mano T,etal.Activation of matrix metalloproteinases precedes left ventricular remodeling in hypertensive heart failure rats:its inhibition as a primary effect of angiotensin-converting enzyme inhibitor〔J〕.Circulation,2004;109(17):2143-9.
9Martinez A,Oh HR,Unsworth EJ,etal.Matrix metalloproteinase-2 cleavage of adrenomedullin produces a vasoconstrictor out of a vasodilator〔J〕.Biochem J,2004;383(Pt.3):413-8.
10Spanikova A,Ivanova M,Matejikova J,etal.Influence of ischemia/reperfusion and modulation of PI3K/Akt kinase pathway on matrix metalloproteinase-2 in rat hearts〔J〕.Gen Physiol Biophys,2010;29(1):31-40.
11Vasku A,Goldbergova M,Holla LI,etal.Two MMP-2 promoter polymorphisms (-790T/G and -735C/T) in chronic heart failure〔J〕.Clin Chem Lab Med,2003;41(10):1299-303.
