水分胁迫下外源NO对苜蓿幼苗生长的影响
2014-09-11蔡卓山师尚礼曹文侠
蔡卓山,师尚礼,曹文侠, 王 栋,杨 涛
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
干旱作为世界三大自然灾害之一,对植物生长发育有巨大的影响,给农业生产所造成的损失超过了其他自然逆境伤害之和[1]。我国干旱、半干旱和半湿润易干旱地区约占全国土地面积的45%,水资源在时间和空间上分布不均匀,而我国水资源相对匮乏使得这一现状更为严重,尤其对于北方农业生产,如何减少水分胁迫对农作物生长的影响成为首要问题。
苜蓿(Medicagosativa)被称为“牧草之王”,全世界种植面积已达3 330万hm2,是世界上栽培面积最广、最主要的豆科牧草之一。我国苜蓿种植遍及北方14个省区,栽培面积己达200万hm2,并正以每年10万hm2以上的速度扩展,对中国畜牧业发展起到了重要作用。许多因素制约着苜蓿产业的发展,其中,苜蓿品种的选择和布局是首要解决的问题之一,而提高苜蓿生态适应性的重要性显得尤为突出。尤其是对苜蓿品种抗旱性的研究,不仅能够为苜蓿抗旱品种选育提供一定的理论依据,而且为干旱、半干旱地区推广和扩大苜蓿种植面积奠定一定的理论基础。植物在水分胁迫下会在形态上表现出一系列的变化,以使个体能存活下去。水分胁迫下,植物形态指标的改变程度、植株生长状况和形态学特征可以作为评价不同牧草及不同品种植物抗旱能力的重要参数。形态学指标和标记在苜蓿抗旱育种中采用最多最早,至今仍占具一定地位,是长期育种过程宝贵经验的积累,具有简单、实用性强的特点。很多研究报道,植株的根、茎、叶的形态可作为估测品种抗旱能力的重要指标[2]。因此,通过研究苜蓿在水分胁迫下形态指标的改变程度、植株生长状况和形态学特征可以很好的比较不同苜蓿品种的抗旱能力。
一氧化氮(NO)是一种广泛存在于生物体内的活性分子,自发现NO可以作为植物抗病反应的信号分子后,NO植物学的研究引起了国际植物学界的密切关注。在植物体中,NO对种子的萌发、幼苗主根生长、侧根发育、气孔运动、光形态建成、呼吸作用、细胞凋亡、激素调控和各种胁迫响应等许多重要的生理过程具有调节作用[3-6]。研究表明,外源NO对植物地上部和根的伸长生长都有促进作用,而对地上部的促进作用更明显。有关外源NO对水分胁迫下苜蓿幼苗生长影响的研究较少。因此,以抗旱型苜蓿品种苜蓿王和水分敏感型品种德宝为供试材料,以PEG-6000为模拟水分胁迫的渗透调节剂,研究外源NO对水分胁迫下苜蓿幼苗生长的影响,以期为提高苜蓿在干旱、半干旱地区的种植和推广提供一定的理论依据。
1 材料和方法
1.1 试验材料
于2013年5~9月在甘肃农业大学草业学院实验室进行,供试苜蓿品种为苜蓿王(Medicagosativacv.Emperor)和德宝(Medicagosativacv.Derby),均为第3年种子,初始发芽率分别为90.11%和92.67%,亚硝基铁氰化钠( SNP,美国Sigama 公司)为NO供体,PEG(PEG-6000)为上海化学试剂公司生产。试验所用药品均为分析纯。
1.2 试验方法
挑选饱满均匀的苜蓿种子,用 0.1% HgCl2溶液消毒15 min,用蒸馏水冲洗数次,再用吸水纸吸干,置于垫有2层滤纸的培养皿中,在种子发芽箱中,光照强度70 μmol/(m2·s),温度25 ℃±1 ℃,相对湿度60%进行催芽。种子萌发后,移入灭菌的蛭石培养钵,每钵定植25株,转移至光照培养室。生长条件设为:光暗周期12 h/12 h,光通量密度400 μmol/(m2·s),昼夜温度25 ℃/18 ℃,相对湿度60%,每3 d浇灌1次1/2Hoagland营养液,出苗后15 d间苗,每钵留10株,生长30 d后进行干旱处理。按照Michel(1973)的方法,使用PEG-6000和1/2 Hoagland配制在25℃下水势分别为-0.6 MPa和-0.9 MPa的溶液,用来模拟中度和重度水分胁迫。
1.3 试验设计
试验设6个处理(3种水分胁迫强度×2种SNP浓度),其中,以0 MPa水势不添加SNP作为CK,3种水分胁迫强度为(用溶液水势代表PEG浓度):0 MPa,-0.6 MPa和-0.9 MPa;2种SNP浓度为:0 SNP和100 μmol/L SNP;试验处理编号分别为:CK、S、6P、6PS、9P和9PS,其中,S代表添加100 μmol/L的SNP,P代表添加相应浓度的PEG-6000, 6和9分别代表水势-0.6 MPa和-0.9 MPa。试验以SNP为NO供体,采用随机区组设计,每处理10钵,重复3次,为保证处理浓度稳定,每隔2 d更换1次处理液,选择室外温度25 ℃时间歇性通入空气,处理7 d后取样测定各项指标。
1.4 测定指标与方法
株高和含水量:每个处理选取长势一致的幼苗5株,用精度为0.1 mm的电子游标卡尺测定其绝对高度(cm);全株用蒸馏水冲洗后用干净的滤纸吸取表面附着的多余水分,用电子天平秤量鲜重Wf,将样品放入烘箱105 ℃烘6 h至恒重,测得植株干重Wd,并按公式计算含水量。
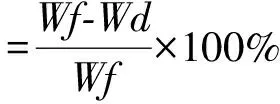
干重和根冠比:每个处理随机选取3钵,收集每钵植株的地上和地下部分,洗净后放入烘箱,95 ℃杀青10 min,65 ℃下烘干至恒重并称量记录,计算平均值,5次重复。
1.5 数据分析
用Excel 2010 软件处理数据和绘图,Spss18.0软件进行统计分析,方差齐性检验用Duncan新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 不同水分胁迫强度对苜蓿幼苗生长的影响
2.1.1 不同水分胁迫强度对苜蓿幼苗株高的影响 水分胁迫显著抑制苜蓿幼苗地上部分的生长(图1)。不同苜蓿品种在不同水分胁迫条件下地上部分生长的表现不同,抗旱性较强的苜蓿王在中度和重度水分胁迫下苜蓿幼苗的株高分别较CK降低了11.24%和17.61%,且差异显著(P<0.05),但6P和9P处理下无显著差异;德宝属于灌区丰产品种,其株高随着水分胁迫强度的增强而持续降低(P<0.05),在重度水分胁迫下苜蓿幼苗的株高较CK降低了28.13%。
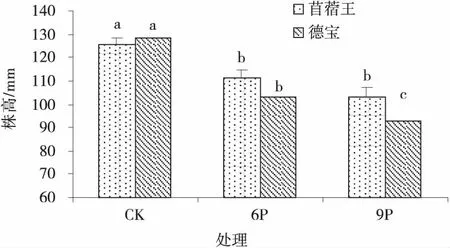
图1 不同水分胁迫下的苜蓿幼苗株高
2.1.2 不同水分胁迫强度对苜蓿幼苗干重的影响 苜蓿干物质的积累也能够作为抗旱评比的重要指标之一。随水分胁迫强度的增强,苜蓿幼苗干重变化存在品种差异(图2)。德宝苜蓿幼苗干重随着水分胁迫增强而显著降低(P<0.05),在6P和9P处理下苜蓿幼苗干重较CK分别降低了24.70%和26.91%,但这两个处理间无显著差异;在重度水分胁迫下苜蓿王幼苗干重较CK下降14.23%,且差异显著(P<0.05),而在中度水分胁迫下幼苗干重与CK无显著差异。

图2 不同水分胁迫下的苜蓿幼苗干重
2.1.3 不同水分胁迫强度对苜蓿幼苗根冠比的影响 植物的根冠比是衡量植物在某一特定环境下是否能正常生长的重要标志,也是显示植物抗旱能力强弱的重要指标之一,不同抗旱能力的苜蓿品种其根冠比在不同水分胁迫条件下表现不同。苜蓿王幼苗在水分胁迫强度增加时表现为先增高后降低(图3),且各处理间差异显著(P<0.05),在中度水分胁迫下其根冠比较CK增加了49.49%;德宝幼苗的根冠比随着水分胁迫强度的增加而降低, 在中度和重度水分胁迫下其根冠比较CK降低了19.64%和22.67%(P<0.05)。
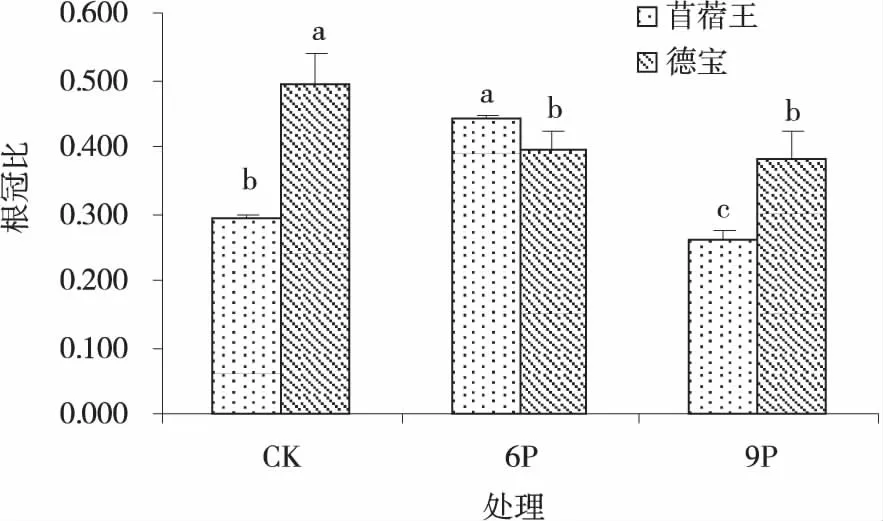
图3 不同水分胁迫下的苜蓿幼苗根茎比
2.1.4 不同水分胁迫强度对苜蓿幼苗含水量的影响 水分胁迫能够显著降低2个苜蓿品种幼苗的绝对含水量,但抗旱性强的苜蓿王其幼苗含水量的降低幅度要小于德宝(图4)。中度和重度水分胁迫下苜蓿王幼苗含水量较CK分别下降5.88%和6.14%(P<0.05),而德宝较CK下降了15.38%和13.88%。
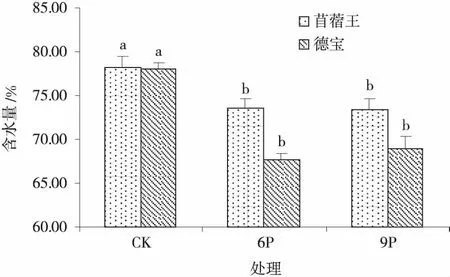
图4 不同水分胁迫下的苜蓿幼苗含水量
2.2 外源NO对水分胁迫下苜蓿幼苗生长的影响
2.2.1 外源NO对水分胁迫下苜蓿幼苗株高的影响 在中度水分胁迫下,外源NO能够缓解水分胁迫对2个苜蓿株高的抑制作用(图5),苜蓿王和德宝幼苗株高分别比各自的6P处理提高了8.11%和20.39%。
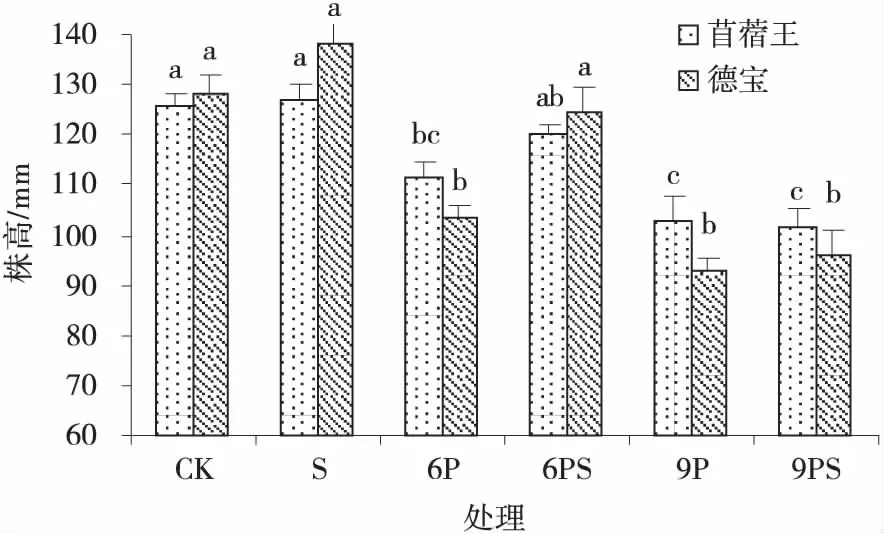
图5 外源NO在水分胁迫下的苜蓿幼苗株高
2.2.2 外源NO对水分胁迫下苜蓿幼苗干重的影响 水分胁迫条件下添加NO对不同苜蓿品种的幼苗干物质积累存在品种差异(图6)。经NO处理能够显著提高水分胁迫下德宝苜蓿幼苗的干重,在中度和重度水分胁迫下分别较6P和9P处理提高了48.53%和37.88%。而对水分胁迫下苜蓿王幼苗干重无显著影响(P>0.05)。
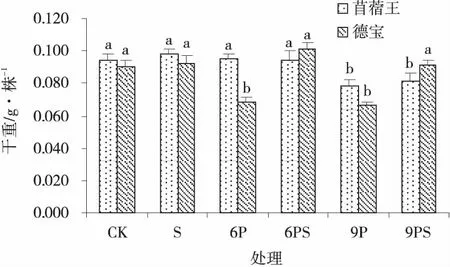
图6 外源NO在水分胁迫下的苜蓿幼苗干重
2.2.3 外源NO对水分胁迫下苜蓿幼苗根冠比的影响 水分胁迫下,添加NO对2个苜蓿品种幼苗的根冠比影响不同(图7)。正常水分条件和中度水分胁迫下,外源NO能显著提高德宝幼苗的根冠比,分别较CK和6P处理提高了19.48%和17.80%(P<0.05),而对重度水分胁迫处理下的苜蓿幼苗根冠比无显著提高。
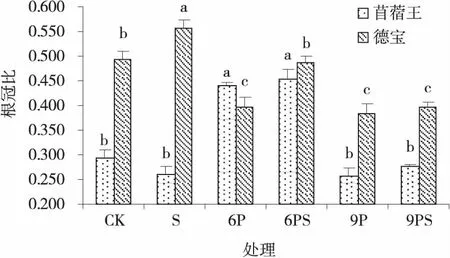
图7 外源NO在水分胁迫下的苜蓿幼苗根冠比
2.2.4 外源NO对水分胁迫下苜蓿幼苗含水量的影响 添加NO可显著提高中度和重度水分胁迫下德宝幼苗的含水量(P<0.05),分别较6P和9P处理提高了8.38%和10.64%,以及9PS处理德宝幼苗的含水量较高(图8)。
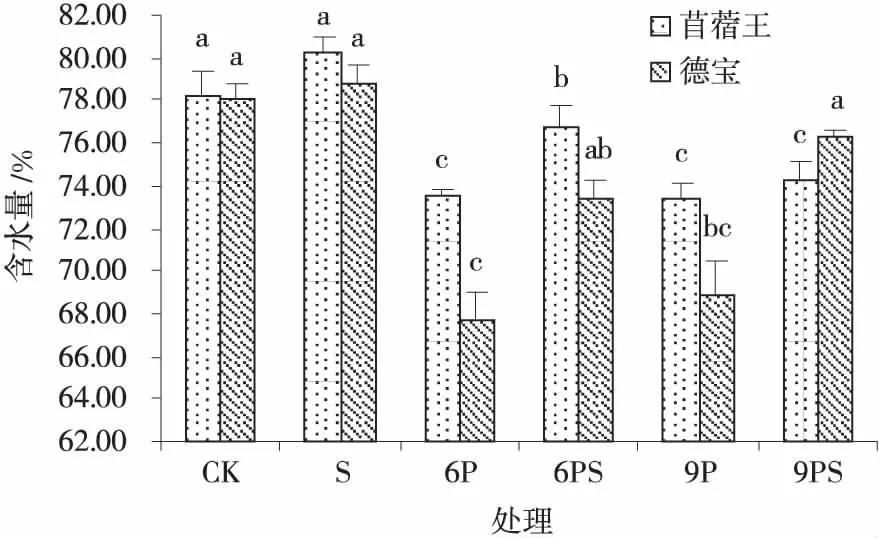
图8 外源NO在水分胁迫下的苜蓿幼苗含水量
2.2.5 外源NO对相同水势下苜蓿幼苗生长指标的促进效应 外源NO能够不同程度提高相同水势下2个苜蓿品种幼苗的生长指标,水分敏感型苜蓿德宝幼苗的各指标相对增加量普遍高于抗旱性较强的苜蓿王幼苗,且添加外源NO对中度水分胁迫下2个苜蓿品种幼苗生长指标的促进作用要高于重度水分胁迫下的苜蓿幼苗(表1)。
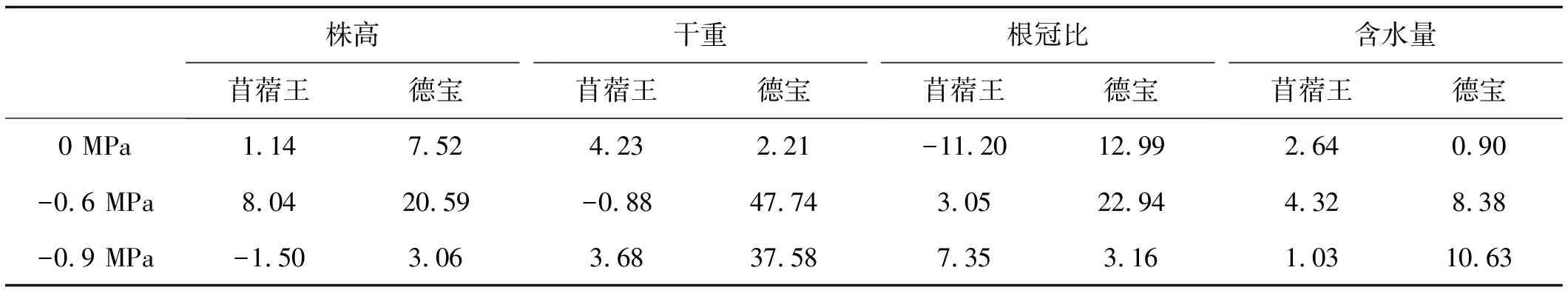
表1 外源NO对相同水势下苜蓿幼苗生长指标的促进作用
3 讨论
许多研究表明,干旱胁迫抑制植物株高,降低干物质的积累,改变干物质分配比例[7-10]。
干旱胁迫能够限制苜蓿地上部分的生长,不同抗旱性苜蓿品种表现不同。抗旱性较强的苜蓿幼苗株高随着水分胁迫强度增加而降低,但其下降的幅度较水分敏感型苜蓿低,这与Timothy J T等[11]所得出的结论相同。添加外源NO能够显著的提高中等水分胁迫下2个苜蓿品种幼苗的株高,说明NO是一种逆境信号,在干旱发生时才能够激活苜蓿幼苗体内的抗旱应答机制,以提高苜蓿对水分亏缺条件的适应。而当水分胁迫强度过高时,NO所激活的抗旱应答机制无法减少干旱对其造成的生长抑制作用,即外源NO对水分胁迫下苜蓿幼苗的缓解作用有限。
当水分成为植物生长的限制因子时,植物将更多的能量和营养输送至根部,促进主根的伸长生长、侧根数和根幅,以促进其吸收土壤深层水分,适应水分的亏缺[12]。结果表明,抗旱性强的苜蓿能更好的通过改变地上和地下生物量积累来降低水分胁迫对其造成的影响,干旱敏感型苜蓿由于碳向地下组织的分配收到限制,因此,其地上和地下部分的生长均受到抑制,这与LI C[13]在研究桉树苗水分利用效率得出的结论相同。在中度水分胁迫下,添加NO能够提高水分敏感型苜蓿将营养物质向根部分配的比重,促使幼苗主根伸长和侧根向周围空间扩展,以便更有效的汲取水分和养分,而对抗旱型苜蓿无显著影响;在重度水分胁迫下,添加外源NO对苜蓿幼苗根冠比无显著作用。
水分胁迫可显著降低苜蓿幼苗干物质的积累量,抗旱型苜蓿幼苗的干重只在胁迫下显著低于CK,这与在研究水分胁迫对油菜种子萌发影响时所得出的结论相同[14]。外源NO能够显著提高水分敏感型苜蓿在重度和中度水分胁迫下苜蓿幼苗干物质的积累量,而对抗旱性较强的苜蓿王幼苗的干重无影响,说明添加外源NO可作为提高非抗旱苜蓿品种在干旱和半干旱地区产量的一种有效手段。
抗旱性苜蓿幼苗的抗旱保护机制使其能够更好地从周围环境中汲取水分,在干旱胁迫下维持较高的含水量,保证植株的正常生理代谢[15]。水分胁迫下经NO处理的苜蓿幼苗具有较高的相对含水量,表明外源NO能够提高幼苗的持水能力,维持植株体内正常的水分运输,对提高苜蓿的抗旱性有显著作用。外源NO对不同抗旱苜蓿品种幼苗的含水量影响不同,NO能提高重度水分胁迫下的苜蓿王幼苗的相对含水量,但对于中度水分胁迫无影响,说明在中度水分胁迫下抗旱性强的苜蓿品种可依靠自身抗旱系统保证其体内较高的水分含量,外源NO能提高抗旱性较差的德宝幼苗相对含水量。
4 结论
水分胁迫能够显著降低苜蓿幼苗的株高、干重和含水量,表明苜蓿幼苗在水分胁迫下生长受到抑制,抗旱型不同的苜蓿品种表现不同,抗旱性强的苜蓿幼苗株高、干重和含水量的降低幅度较水分敏感型的要低,且能够通过增加地下部分生长来提高根系对土壤水分和养分的吸收,减少胁迫对其造成的影响。添加外源NO能够显著缓解中度水分胁迫强度对苜蓿幼苗生长的抑制作用,而对重度水分胁迫下苜蓿幼苗生长无显著影响,说明水分胁迫下外源NO对苜蓿幼苗生长的缓解作用是有限的,且添加NO对水分敏感型苜蓿的缓解作用好于抗旱型苜蓿。
参考文献:
[1] 汤章城.植物对水分胁迫的反应和适应性—Ⅱ植物对干旱的反应和适应性[J].植物生理学通讯,1983(4):1-7.
[2] 南丽丽,师尚礼,朱新强,等.4份苜蓿材料根系形态特征的初步分析[J].草原与草坪,2011,31(3):27-31.
[3] Corpas F J, Barroso J B, Carreras A,etal.Constitutive arginine dependent nitric oxide syntheses activity in different organs of peaseedlings during plant development[J].Planta, 2006,224(2):246-254.
[4] 蔡卓山,师尚礼,谢森林,等.外源NO对水分胁迫下苜蓿种子萌发的影响[J].核农学报,2013,27(11):1777-1782.
[5] Laxalt A M, Beligni M V, Lamattina L.Nitric oxide preserves the level of chlorophyll in potato leaves infected by phytophthora infestans[J].European Journal of Plant Pathology, 1997,103:643-651.
[6] 冯瑞章,魏琴.外源NO对NaCl胁迫下燕麦幼苗氧化损伤的缓解效应[J].草原与草坪,2012(6):7-10.
[7] Liu F, Stutzel H.Biomass partitioning, specific leaf area, and water use efficiency of vegetable amaranth (Amaranthusspp.) in response to drought stress[J].Scientia Horticulturae,2004,102:15-27.
[8] 徐炳成,山仑.苜蓿和沙打旺苗期需水及其根冠比[J].草地学报,2003,11(1):78-82.
[9] Liu H Sh.Deficiency of water can enhance root respiration rate of drought-sensitive but not drought-tolerant spring wheat[J].Agriculture Water Management,2004,64:41-48.
[10] Kage H, Kochler M.Root growth and dry matter partitioning of cauliflower under drought stress conditions:measurement and simulation[J].European Journal of Agronomy, 2004,20:379-394.
[11] Timothy J T,Tuskan G A,Gebre G M,etal. Drought resistance of two hybrid Populus clones grown in a large-scale plantation[J].Tree Physiology,1998(18):653-658.
[12] 陈积山,李锦华,常根柱,等.10个紫花苜蓿品种根系形态特征的研究[J].草原与草坪,2009(1):32-36.
[13] LI C.Population differences in water use efficiency of Eucalyptus microtheca seedlings under different watering regimes[J].Physiol Plant,2000,108:134-139.
[14] 李妍.干旱胁迫对油菜种子萌发的影响[J].现代农业科技,2007(9):106-107.
[15] 伏建增,杜汉强,牛一川,等.紫花苜蓿品种抗旱性研究分析[J].草原与草坪,2006(2):65-67.
