玉米专用菌肥研制及其部分替代化肥施用对玉米生长的影响
2014-09-11王国基张玉霞马文彬马文文
王国基,张玉霞,姚 拓,柴 强,马文彬,马文文
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.甘肃农业大学 农学院,甘肃 兰州 730070)
玉米(Zeamays)作为人类口粮、牲畜饲料和工业生产原料发挥着举足轻重的作用,种植面积仅次于小麦和水稻,全世界对玉米的需求量逐年呈现增长趋势。近年来,我国玉米生产发展势头良好,玉米增产对粮食产量增加的贡献率达49.4%[1],为满足其生存和高产所需的氮、磷等营养元素,施用工业化肥一直被认为是实现这一目的的主要途径。中国占世界10%的耕地却消费了世界1/3的化肥,单位面积施肥量是世界平均水平的3倍[2]。大量施用化肥带来的负面效应正在突显,如成本高、对非再生能源消耗大、污染空气、土壤及水质、威胁食品安全、破坏土壤结构及微生物区系及多样性等[3]。现代农业在追求粮食高产的同时工作重心已经向粮食安全问题转移,其中,寻求化肥替代品已成为一条解决途径。玉米要达到高产、稳产,除外界影响因素,内在因素也起着重要作用,如玉米干物质积累绝大部分来自叶片[4]。可以认为作物经济产量的高低是由生物产量即干物质积累量所决定,因此,掌握玉米的干物质积累对提高产量具有重要意义[5]。
近年来,国内外研究表明,植物根际存在着大量的有益菌,最早为人们所熟知的是固氮菌(Azotobacterspp.)[6]。其菌有从空气中直接固定氮气的能力,部分兼有解磷、分泌植物生长调节物质、促进植物生长等功能[7]。利用这类菌的优良特性研制生物菌肥,不仅可以发挥肥效作用,同时能活化土壤、改善土壤结构,还可以减少化肥购入成本以及对非再生资源的消耗。经国内外学者研究,从重要作物如水稻(Oryzasativa)、小麦(Triticumaestivum)、甘蔗(Saccharumofficinarum)和棉花(Anemonevitifolia)等作物根际筛选出大量优良促生菌株(PGPR),部分菌株已用于商业化菌肥生产,在农业生产中发挥着重要作用。荣良燕等[11]利用分离筛选出的优良PGPR 菌株制作成菌肥,测定菌肥替代20%~30%化肥施用对玉米生长的影响,结果表明,施用菌肥替代部分化肥对玉米的株高、地上植物量、穗长和经济产量均有提高,且化肥减量和促进增产的直接经济效益分别为620.1元/hm2,2 291.4元/hm2。段秀梅等[12]测定了两株解磷菌对玉米苗生长的影响,结果表明,混接解磷菌在玉米株高和干重方面较对照分别增加了35.5%和28.9%。张堃等[13]报道了在高寒地区利用联合固氮菌肥+半量氮肥处理与全量氮肥对比,试验表明青稞苗期的株高、地上生物量、主根长、根体积、粗蛋白等并无显著差异,说明菌肥配施半量氮肥表现出与全量化肥相似的促生效果,可以节省一半氮肥,降低化肥投入成本。但促生菌肥在田间的应用效果存在着很大差异,其主要原因是试验区气候特点、宿主植物、促生菌种类和土壤状况等综合因素导致菌肥在田间的效果。因此,如何能使菌肥的田间混接促生效果达到最佳,还需要进一步的深入研究。对前期从玉米根际分离的促生菌株进行筛选,获得优良菌株并研制玉米专用菌肥,测定其部分替代化肥对玉米叶面积与干物质积累的影响,在保证玉米不减产的条件下,减少化肥投入,寻求玉米专用菌肥与化肥之间的最佳配比,为循环农业中减少化肥施用提供理论依据和技术支撑。
1 材料和方法
培养基为LB[14];NFM[14];Pikovaskaia’s[14](PKO);CCM[14]。
1.1 供试菌株
分离自白银、定西及武威等玉米种植区玉米根际的38株菌株。
1.2 优良菌株特性测定
测定供试菌株培养特性、固氮酶活性、溶磷量及分泌植物生长素等指标,筛选优良菌株,为研制玉米专用菌肥提供菌种资源。
1.2.1 优良菌株固氮酶活性测定 利用NFM培养基将供试菌株分别接种于盛有5 mL 半固体NFM 培养基的血清瓶中( 每菌株6个重复),按文献[15]的方法,结合气相色谱仪,利用乙炔还原法确定菌株是否有固氮酶活性,并计算固氮酶活性。
式中:hx为样品峰面积(cm2);hs为标准C2H4峰面积(cm2);C为标准C2H4浓度(nmol/mL);V为培养容器体积(mL);t为样品培养时间(h) ;N为产生的C2H4浓度( nmol/mL·h) 。
1.2.2 优良菌株溶磷特性测定 利用PKO培养基,先将供试菌株点接种于盛有PKO 固体培养基上,每皿点接4 个重复,每菌株3 皿,28 ℃ 条件下培养10 d。观察接种菌株周围有无透明圈形成,以判断该菌株有无溶磷能力[16]。制备上述能够形成透明圈菌株的悬浮液(1×108个/mL)。取1 mL菌株悬浮液接种于50 mL液体培养基中(每一菌株6个重复),置于恒温摇床(28 ℃,160 r/min) 培养10 d 之后在4 ℃下离心(10000 r/min)15 min,取上清液用钼酸铵比色法测定有效磷(H2PO4-)含量[16]。以不接种菌株为对照。
1.2.3 优良菌株分泌IAA 性能测定 利用CCM液体培养基。将1 mL菌株悬浮液(1×108个/mL) 接种于盛有50 mL CCM 液体培养基的三角瓶中(每一菌株4个重复),置于恒温摇床(28 ℃,125 r/min)培养12 d。
比色液的组成及配方:0.5 mol/L FeC131 mL,浓H2SO430 mL ,蒸馏水50 mL。取上述在CCM液体培养基上生长12 d 的菌株悬浮液1 滴置于白瓷板上,加1滴比色液。对照只在比色液中加1 滴50 μg/mL的生长素(IAA),不加菌株悬浮液。将白瓷板置室温下15 min 后观察其颜色变化,颜色变粉红者为阳性,否则为阴性,以确定该菌株有无产生生长素的能力。菌株培养液经低温离心后,取其上清液置于冷冻干燥仪中浓缩,并用1 mol/L HCl 调pH至2.8。用乙酸乙酯提取IAA(菌株培养液∶乙酸乙酯= 1∶3),提取液在低温下蒸发至干燥,再用2 mL 100% 乙醇溶解后盛在Eppendorf 小试管中。同时配制50 μg/mL的IAA 标准液。利用高效液相色谱仪( HPLC) 按文献[16]的方法和步骤测定IAA含量。
1.3 玉米专用菌肥制作及其质量检测
1.3.1 玉米专用菌肥制作 将上述1.2所得7株优良促生菌株分别接种于LB 液体培养基中,于28 ℃,150 r/min培养48 h。待菌株充分生长后,利用分光光度计测定各菌株悬浮液D660nm值,用无菌水调其D660nm=0.5(即菌株悬浮液109cell/mL),并将调好的各菌株悬浮液按特定体积比(正在申报专利)混合后备用;称取已优化载体配方[17](泥炭∶木炭∶花土=2∶2∶1) 350 g,置于灭菌锅121 ℃,25 min连续灭菌2次。将灭菌后的载体置于无菌操作台上冷却后,倒入食品专用袋中;在无菌条件下,将无菌水与载体材料充分混匀,使得载体材料湿润、松散而不粘结,混合均匀后补加上述备用的混合菌液80~100 mL,继续混合搅拌均匀,用自动封口机封口。将制作好的菌肥置于28 ℃的培养箱培养7~10 d,备用。并定期对菌肥有效活菌数、是否污染和菌种特性变化等进行检测。
1.3.2 玉米专用菌肥质量检测 采用稀释平板法,将保存在室温的菌肥分别在30、60、90、120、150、180和210 d各测定1次活菌数;采用肉眼直接观察法和显微镜观察法,检查制作的菌肥保存一段时间后是否有霉变(如青霉、曲霉污染)、是否有异味产生、是否出现色变等。
1.4 玉米专用菌肥对叶面积及干物质积累的影响
2013年,以玉米作为研究对象,以试验区常规施肥量为基准,在此基础上以此次研究制作的菌肥替代15%,30%和100%化肥用量,测定其替代部分化肥对玉米生长和产量的影响。
1.4.1 试验区自然概况 试验地为甘肃省武威市凉州区黄羊镇农垦农场甘肃农业大学试验站,地理位置N 37°52′20″,E 102°50′50″。地处甘肃河西走廊东端,属典型内陆荒漠气候区, 海拔1 581 m;全年平均无霜期156 d,年降水量164.4 mm,蒸发量1 919 mm,平均气温7.8 ℃,日照时数2 968.2 h,≥10 ℃年积温2 985.4 ℃;年太阳辐射总量504~630 kJ/cm2,麦收后≥10 ℃有效积温1 350 ℃,属于典型两季不足,一季有余农业生产区。供试土壤为灌漠土,试验地0~10、10~20、20~30 和30 cm 以下土壤容重分别为1.29、1.34、1.41和1.39 g/cm3, 地下水埋深25~30 m。耕层有机质15.71 g/kg、全氮0.87 g/kg、全磷1.02 g/kg、速效磷13.38 mg/kg、速效钾248.63 mg/kg,pH为8.2。
1.4.2 试验材料 玉米品种:金穗4号(白银金穗种业有限公司提供);
化肥(试验区市售化肥):磷二铵(云南三环中化化肥有限公司),总养分≧64%(N∶P2O5∶K2O=18∶46∶0);尿素(刘家峡),总氮含量≧46.4%;
灌溉:采用滴灌;滴灌带规格:滴头间距0.30 m,每卷长度为2 200 m,流量为1.4 L/h;地膜宽1.4 m。
菌肥:自制菌肥含量为全氮5.59 g/kg,全磷0.87 g/kg,有效磷43.73 mg/kg,全钾20.21 g/kg,有效钾5.61 g/kg。
1.4.3 试验设计 试验设5个处理,即A全量化肥,当地高产栽培方式最佳施肥量为纯氮450 kg/hm2,磷素(P2O5)225 kg/hm2,当地土壤是富钾土壤,故不施钾肥;B 85%化肥+菌肥;C 70%化肥+菌肥;D 菌肥(不施化肥);E 不施肥;每处理3个重复,共15个小区,采用随机区组设计,每个小区面积45 m2。行株距为40 cm×30 cm,密度为75 000株/hm2;采用覆膜带状种植,玉米4月中旬播种。
1.4.4 专用菌肥及化肥使用方法 播种前先将种子(宜用未包衣玉米种子)用菌肥拌种,置于阴凉、避光处0.5 h (使促生菌充分粘附在种子表面)播种。菌肥用量7.5 kg/hm2。对照与不施肥处理的种子用无菌水拌种。化肥施肥量:对照(全量化肥)用量为尿素890 kg/hm2和磷二铵489 kg/hm2,其余各处理分别按比例减少化肥施用量以菌肥代之。其中,尿素基肥∶追肥(大喇叭口期和开花期)量比为3∶7,分别为基肥∶大喇叭口期追肥∶开花期追肥=3∶4∶3。田间灌水按苗期900 m3/hm2、拔节期1 100 m3/hm2、大喇叭口期1 100 m3/hm2、开花期1 250 m3/hm2、灌浆期750 m3/hm2灌溉。
1.4.5 测定指标 分别在苗期、拔节期、大喇叭口期、开花期、灌浆期、乳熟期、成熟期每次每小区取样10 株,先称鲜重,量取叶面积(叶面积=长×宽×0.75),然后将植株烘干至恒重,再称干重,供分析测定。分析计算各生育期叶面积,干物质积累量,成熟期经济产量与干草产量。
1.5 数据处理
数据整理与作图用Excel 2007,数据分析用Spss 17.0。
2 结果与分析
2.1 优良促生菌株筛选
筛选出7株具有良好促生特性的菌株(表1),菌株P2-1、P4-4、4N4 具有固氮、溶磷、分泌IAA 特性,其他4 种菌株则不完全具有这3 种特性。这7 种菌株生长速度均较快,且各菌株间的拮抗反应测定,7 株优良菌株间不发生拮抗反应。

表1 优良促生菌株主要特性
注:*表示待鉴定,“-”表示无,“+++”表示生长速度较快
2.2 菌肥质量检测
将7种优良促生菌株按照特定比例混合,再与优化的载体配方搅拌均匀制成玉米专用复合菌肥,其部分质量检测结果见表2。

表2 玉米专用菌肥质量检测
注:“+” 表示污染,“-” 表示无污染。
有效活菌数及杂菌污染是菌肥质量的重要指标。制作的菌肥经恒温培养7~10 d,贮存于避光、室温条件下,在质量检测期间其有效活菌数呈逐渐下降趋势,但在180 d内有效活菌数均达到65.7×108cfu/g,且无杂菌污染,符合《微生物肥料》NY227-94标准[18],其中,30 d后的活菌数最多,菌种特性稳定。180 d后,其活菌数迅速下降至9.1×108cfu/g,且伴有杂菌污染和霉变现象。因此,建议菌肥成品后,最好在6个月内使用,确保其肥效的充分发挥。
2.2 菌肥对玉米生长的影响
2.2.1 对玉米叶面积的影响 在玉米各个生育期测定玉米叶面积发展动态,结果表明(图1),各处理间玉米叶面积在拔节期前增长比较缓慢,拔节期之后玉米叶片增大增多,叶面积迅速增加,至开花期达到最大值,此后灌浆期、乳熟期、成熟期增长速度减慢,且总叶面积呈现下降趋势,但配施菌肥处理的叶面积下降量较全量化肥处理幅度较小。其中100% 菌肥(D)处理和不施肥(E)处理总叶面积整体低于其他3 个处理,但D 处理叶面积高于不施肥处理。全量化肥(A)处理、85% 化肥+菌肥处理(B)和70% 化肥+菌肥(C)处理三者之间叶面积发展变化动态表现为处理B>A 和C,A 与C 总叶面积基本相同。总之,各处理对玉米叶面积的发展动态变化影响各异,但整体发展规律基本一致。
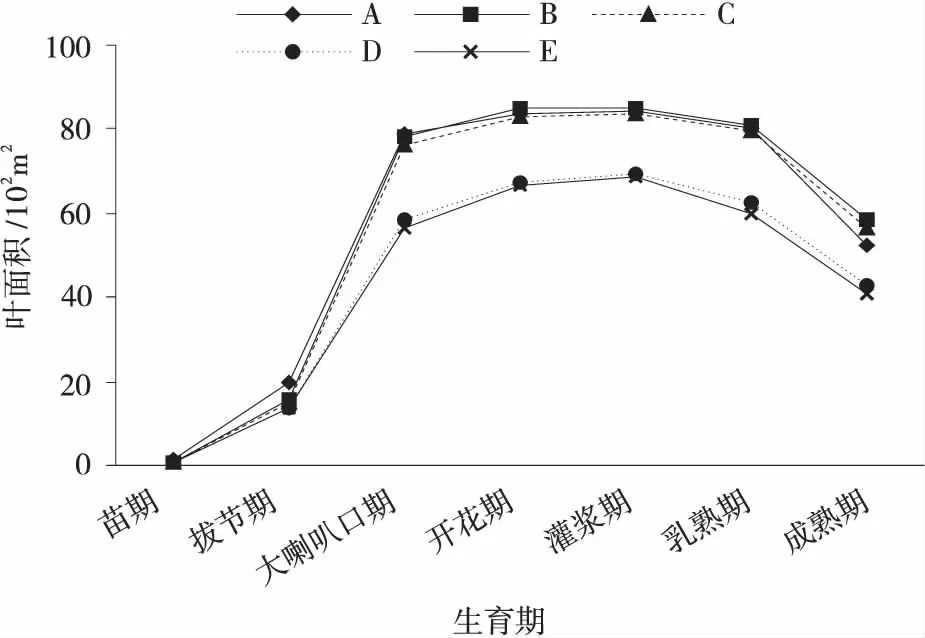
图1 玉米各生育期叶面积变化
2.2.2 对玉米地上干物质积累的影响 对玉米不同生育期干物质积累测定结果表明(图2),不同处理的玉米地上干物质积累速率在拔节期之前相同,拔节期后地上干物质增长速率各不相同,但均在开花期到乳熟期干物质积累速率达到最大,乳熟期之后干物质积累速率减缓;在开花期之后表现出85%化肥+菌肥(B)>全量化肥(A)处理>70%化肥+菌肥(C)>100%菌肥(D)>不施肥(E)。拔节期后,玉米干物质的积累速率与积累量都出现了较大变化,但均符合“慢、快、慢”的“S”型生长规律,且干物质最终的积累量表现为B>A>C>D>E。
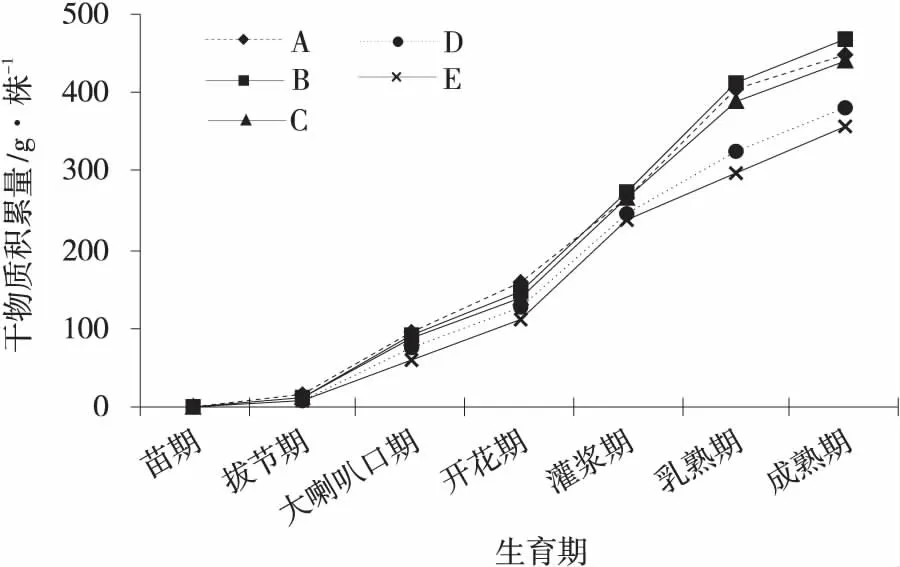
图2 玉米各生育期干物质积累量
2.2.3 对玉米产量的影响 不同施肥处理玉米经济产量表现为B>A>C>D>E,处理B 显著高于其他施肥处理,处理A与C,D与E 间差异不显著,处理B 较E (不施肥对照)增产27.9%,比全量化肥处理A 增产2.7%(表3);不同施肥处理玉米干草产量均表现为处理A、B、C之间差异不显著,均显著高于处理D和E,而且表现为处理B>A>C>D>E,处理B 较E 干草产量增加26.4%,比全量化肥处理A 增产2.1%。表明施用菌肥时,减少15%化肥用量不但不会降低玉米经济产量和干草产量,还略有提高;减少30% 化肥用量对玉米的经济产量及干草产量均有所下降,但差异不显著,在农业生产中可根据玉米的不同用途采取不同菌肥配施化肥减量梯度。
3 讨论与结论
从玉米根际分离出28株菌株,经固氮、溶磷、分泌IAA 特性测定筛选出7 株优良促生菌株,将其制作成玉米固体生物菌肥,以替代15%~30%化肥,测定其对玉米叶面积与干物质积累的影响,结果表明,菌肥替代15%化肥与全量化肥相比,对玉米叶面积与干物质积累有不同程度的提高;菌肥替代30%化肥与全量化肥相比,对玉米叶面积与干物质积累影响不大,与全量化肥基本一致。因此,在菌肥替代化肥15%~30%可能存在一个最佳物替代量,既可以减少化肥投入,又不对玉米造成影响,这个最佳物替代量还需进一步试验。

表3 不同施肥处理玉米经济产量及干草产量
注:表中同列不同小写字母表示差异显著(P<0.05)
玉米菌肥替代部分化肥对玉米地上干物质积累的影响,虽然各处理变化有差异,但干物质积累符合“慢、快、慢”的S 型生长曲线,这与黄智鸿等[19]玉米干物质积累与分配的研究结果一致。苗期到大喇叭口期,由于生长中心以地下为主,同时叶片偏小,光合产生的有机物质主要供给根系生长,地上干物质积累速率较慢。从大喇叭口期到乳熟期,生长中心从地下转移到地上营养器官,再逐步从茎叶转到穗子、籽粒上,此时气温高,光照强,叶面积大,光合作用较强,地上物质积累呈现较快增长。从乳熟期到成熟期,有效叶面积减小,光合作用减弱,干物质积累均呈现平缓增长。干物质积累量最终表现出85%化肥+菌肥>全量化肥>70%化肥+菌肥>100% 菌肥>不施肥处理,在开花期之后的干物质积累量表现为85%化肥+菌肥处理>全量化肥处理≥70%化肥+菌肥,这与微生物的作用较化肥滞后但长效有关,在植物生长后期的促生效果比较明显,其作用优于全量化肥处理。
玉米叶片作为玉米有机物质生产的主要器官,其叶面积大小及光合作用的强弱对玉米的生长发育有着重要影响。结果表明,各处理间玉米叶面积在整个生育期的发展动态一致,均表现出各处理间玉米叶面积在拔节期前增长比较缓慢,拔节期之后玉米叶片增大增多,叶面积迅速增加,至开花期达到最大值,此后在灌浆期、乳熟期、成熟期增长速度减慢,总叶面积呈下降的趋势。这与杨国虎等[20]、黄智鸿等[19]研究结果一致。全量化肥(A)处理、85%化肥+菌肥处理(B)和70%化肥+菌肥(C)处理,三者之间叶面积变化动态表现为处理B>A 和C,A 与C 总叶面积基本一致。而玉米经济产量与干草产量变化显著,处理B相比全量化肥增产均在2.1%~3.6% ,这与席琳乔等[21]利用分离自禾本科牧草根际的联合固氮菌对燕麦株高及产量的显著促进作用及姚拓等[22]报道的联合固氮菌对燕麦株高的明显促进作用研究结果一致。研究分析,不同施肥处理以处理B 对玉米生长的促进效果最佳,处理C 次之,可能由于菌肥配施化肥的原因,菌肥中的PGPR 在玉米根际生长繁殖过程中直接给玉米提供某些营养元素或者溶解土壤中难溶性营养元素供植物吸收,而且产生对植物有益的代谢产物,如CTK、IAA、GA、ABA 等,都不同程度地对玉米生长进行调节,促进其健康生长,营养状况得到改善,从而提高玉米的经济产量及干草产量。同小娟等[23]利用EM 微生物堆肥在夏玉米和冬小麦的试验结果表明,年均总产量比传统堆肥增产8.3%~8.9%,其中,夏玉米增幅最大为9.4%,而冬小麦增产8.3%。试验证明微生物肥料在农业生产过程中,对作物促生及减少化肥投入方面发挥着不可替代的作用,综上所述,玉米专用菌肥在玉米生产中具有很高的应用潜力,同时减少化肥投入也在一定程度上减轻了对生态环境的破坏。
参考文献:
[1] 胡元坤.我国玉米的生产现状和发展目标[J].中国牧业通讯,2010(12):28-29.
[2] 陈新红,韩正光,叶玉秀,等.麦草全量还田与氮肥施用量对水稻产量和品质的影响[J].甘肃农业大学学报,2013,48(6):57-61.
[3] 姚拓.促进植物生长菌的研究进展[J].草原与草坪,2002(4):3-5.
[4] 郑丕尧.作物生理学导论[M].北京:北京农业大学出版社,1992.
[5] 胡昌浩.玉米栽培生理[M].北京:中国农业出版社,1995:1.
[6] ROVIRA A D.The rhizosphere and plant growth[M].The Netherlands:Kluwer Academic Publishers,1991:3-13.
[7] Banchio E,Bogino P C,Zygadlo J,etal.Plant growth promoting rhizobacteria improve growth and essential oil yield inOriganummajoranaL.Biochem[J].Syst Ecol,2008,36:766-771.
[8] Bardas G A,Lagopodi A L,Kadoglidou K,etal.Biological control of three Colletotrichum lindemuthianumraces using Pseudomonas chlororaphis PCL1391 and Pseudomonas fluorescens WCS365 [J].Biol Control,2009,49:139-145.
[9] Esitken A,Yildiz H E,Ercisli S,etal.Effects of plant growth promoting bacteria (PGPB) on yield,growth and nutrient contents of organically grown strawberry[J].Sci Hortic-Amsterdam,2010,124:62-66.
[10] Kumar S,Pandey P,Maheshwari D K.Reduction in dose of chemical fertilizers and growth enhancement of sesame (SesamumindicumL.)with application of rhizospheric competent Pseudomonas aeruginosa LES4[J].Eur J Soil biol,2009,45:334-340.
[11] 荣良燕,姚拓,黄高宝,等.植物根际优良促生菌(PGPR)筛选及其接种剂部分替代化肥对玉米生长影响研究[J].干旱地区农业研究,2013,31(3):59-65.
[12] 段秀梅,高晓蓉,吕军,等.两株土壤分离菌的解磷能力及对玉米的促生作用[J].中国土壤与肥料,2010(2):79-85.
[13] 张堃,姚拓,张德罡,等.高寒地区联合固氮菌肥对青稞的促生效应研究[J].植物营养与肥料学报,2010,16(3):708-713.
[14] Hafeez F Y,Malik K A.Manual on biofertilizer technology[M].NIBGE,Pakistan,2000.
[15] 姚拓,张德罡,胡自治.高寒地区燕麦根际联合固氮菌研究Ⅲ固氮菌分离及鉴定[J].草业学报,2004(2):106-111.
[16] 姚拓.高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J].草业学报,2004(3):85-90.
[17] 韩华雯,姚 拓,王国基,等.根际促生菌肥复合载体配方筛选[J].草原与草坪,2013(4).39-44
[18] 中华人民共和国农业行业标准.微生物肥料NY227-94[S].北京:中国标准出版社,1994.
[19] 黄智鸿,申林,孙刚,等.超高产玉米叶面积及地上部干物质积累与分配[J].安徽农业科学,2007,35(8):2227-2228,2230.
[20] 杨国虎,李建生,罗湘宁,等.干旱条件下玉米叶面积变化及地上干物质积累与分配的研究[J].西北农林科技大学学报(自然科学版),2005,33(5):27-32.
[21] 席琳乔,姚拓,张德罡.固氮菌对燕麦不同生育期促生作用的研究[J].草业学报,2007,16(3):38-42.
[22] 姚拓,蒲小鹏,张德罡,等.高寒地区燕麦根际联合固氮菌研究Ⅲ.固氮菌对燕麦生长的影响及其固氮量测定[J].草业学报,2004(5):101-105.
[23] 同小娟,李俊,李维炯.长期施用有效微生物肥对冬小麦——夏玉米生长和产量的影响[J].华北农业学报,2007,27(6):165-170.
