苜蓿耐药根瘤菌筛选及荧光蛋白标记对根瘤菌耐药性的影响
2014-09-11霍平慧师尚礼苗阳阳
霍平慧,师尚礼,苗阳阳
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
与自然存在的土著根瘤菌比,人工选育的根瘤菌常具有固氮效率高、促生效果好等优势。但释放到田间的目标根瘤菌,需要与环境中的土著根瘤菌以及其他影响目标菌结瘤的杂菌在营养、空间及宿主等方面进行竞争[1]。我国西北内陆土壤相对贫瘠的现状使得豆科牧草的根瘤菌接种效率低下[2]。目前多采用筛选抗性菌株的方法提高菌种适应性,以增加其在不同环境中的竞争能力。此外,所筛选的高效根瘤菌一旦投入生产,制成商业化产品根瘤菌剂后,还面临着贮藏期间因空气中杂菌入侵所导致的高污染率问题[3,4]。因此,常通过向菌剂中添加抑菌剂的措施降低菌剂污染率并增加其施用到田间后的竞争结瘤能力[5,6]。
对有关3种稀土盐抑菌剂La(NO3)3·6H2O,LaCl3和Ce(NO3)3·6H2O及2种植物源抑菌剂苦参碱,除虫菊素的研究发现[7,8],上述抑菌剂均对空气和土壤源杂菌有较好的抑制效果。在此基础上明确所筛选根瘤菌对以上所说抑菌剂的耐受程度,对于制备高竞争型抗污染根瘤菌剂至关重要,同时也是后续菌剂制备工作进行的基础。有效选择对空气及土壤源杂菌抑制效果好、而对根瘤菌的选择毒性低的抑菌剂类型,可降低所制备菌剂的污染率并增加目的菌株施用到田间后的竞争效果。此外,针对根瘤菌研究中占瘤率测定难的现状,以研究方法检测灵敏度高、对试验材料无能源负担为基本原则[9],对所筛选根瘤菌进行青色荧光蛋白(cfp)标记,并测定标记根瘤菌对抑菌剂的耐受性变化,以达到能够更加简单的识别目标根瘤菌,并降低后续工作的强度和技术成本的目的,以期为后期所接种根瘤菌回接效果以及所制备菌剂抗污染效果的测定提供数据支撑。
1 材料和方法
1.1 供试材料
1.1.1 供试植物材料 2012年6月,于甘肃农业大学兰州牧草试验站选取6个苜蓿品种。各苜蓿品种的根瘤分别取自多于3处栽培地的生长健壮、无病虫害、根瘤数多且颜色粉红的苜蓿植株。
1.1.2 供试抑菌剂材料 稀土盐抑菌剂La(NO3)3·6H2O,LaCl3和Ce(NO3)3·6H2O,购自五矿(北京)稀土研究院有限公司,为常规农用稀土,具有抗炎、杀菌等药理活性。
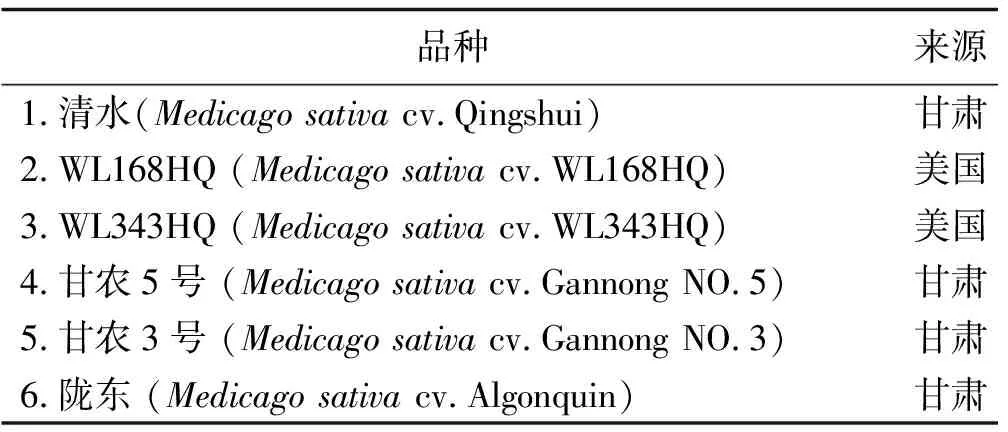
表1 苜蓿品种及来源
植物源抑菌剂,苦参碱和除虫菊素,购自宝鸡方晟生物开发有限公司,均为植物源杀虫剂。苦参碱主要以其生物碱成分发挥抑菌作用,对昆虫、病原菌的毒力较强,对人畜的选择毒性低;除虫菊素属神经毒剂,主要起触杀作用,对高等动物低毒,见光后可缓慢分解为水和CO,环保无公害。
1.2 根瘤菌的分离与鉴定
1.2.1 苜蓿根瘤的分离与处理 将各品种苜蓿植株根系挖出后,以自来水淋洗根系表面附着的土壤和有机质,取下根系上颜色偏红和偏粉红的根瘤,置于无菌三角瓶中,加医用碘伏溶液震荡灭菌2 min后,以无菌水冲洗,重复上述过程3次。最后用无菌滤纸吸干根瘤表面水分待用。
根瘤表面处理药剂,医用碘伏消毒液(聚乙烯吡咯烷酮碘),稀释一倍后有效碘浓度为2 500 mg/L。将表面灭菌处理苜蓿根瘤置于无菌研钵中,加入5 mL无菌水,充分研磨后,将组织匀浆转入5 mL无菌离心管中,于4 000 r/min离心10 min,取上清液,并依次用无菌水配制10-3、10-4、10-5稀释液保存备用。
1.2.2 根瘤菌的筛选鉴定 将各品种苜蓿根瘤研磨上清液及稀释液均匀涂抹于无氮固体培养基,28 ℃下恒温培养6~7 d后选取各平板中的单菌落进行菌株分离。将分离的固氮菌株分别划线接种于含有刚果红和结晶紫的YMA固体培养基上,28 ℃下恒温培养,48 h后挑选每培养皿中不吸附色素并符合根瘤菌形态特征的典型菌株进行划线分离纯化[10],待菌落直径长至最大时,测量并记录各菌株菌落形态(直径、外观、粘稠度)。
溴麝香草酚兰(BTB)反应 向YMA基本培养基中添加终浓度为0.5%的溴麝香草酚蓝的乙醇溶液。将菌株接种于含BTB的平板,培养48 h后,观察菌落周围培养基颜色的变化情况。
3-酮基乳糖反应 将各菌株点接于添加乳糖的YMA平板中,以不添加乳糖的平板为对照,培养48 h后向皿中菌落滴加本尼迪试剂(Benedict) 覆盖菌苔。菌落周围出现黄褐色沉淀者为阳性反应,未出现黄褐色沉淀者为阴性反应。
接触酶反应 将供试菌株点接于YMA培养基上,待菌苔长出后,滴加3%的H2O2溶液并立即检查结果,5 min内出现气泡者为阳性反应,未出现气泡则为阴性反应[11]。
碳源利用类型 以YMA固体培养基作为基础培养基,并分别用淀粉、乳糖、柠檬酸、蔗糖、果糖和葡萄糖作为唯一碳源,测定各菌株的碳源利用特性。
革兰氏染色反应 对上述过程中有待进一步筛选的初筛菌株进行革兰氏染色,将所有制备好的染色载波片置于蔡司荧光倒置显微镜下观察染色后的菌株颜色及形态特征。
上述试验中,所有测定菌株均设3个阳性重复和1个阴性对照,并对各品种苜蓿根瘤中生化特性符合的筛选菌株进行编号保存,作为符合根瘤菌基本特征的初筛菌株。以购自中国农业科学院微生物保藏中心的中华苜蓿根瘤菌S.12531 (Sinorhizobiummeliloti/Ensifermeliloti) 为对照菌株,以实验室保存的R.GN5 (RzhizobiumGN5) 根瘤菌株作为参比菌株。
1.3 含抑菌剂平板的制备及初筛根瘤菌的抑菌剂抗性测试
1.3.1 含抑菌剂平板的制备 以YMA固体培养基作为基本培养基,制备La(NO3)3·6H2O,LaCl3和Ce(NO3)3·6H2O,这3种稀土盐离子的终浓度为200、400、600、800和1 000 mg/L的含药平板,以及含有300、400、500、600和700 mg/L苦参碱和500、1 000、1 500和2 000 mg/L除虫菊素的含药平板,每处理3次重复。
1.3.2 初筛根瘤菌株的抑菌剂抗性测试 将各品种编号保存的初筛根瘤菌点接于含药平板,以购自中国农业科学院微生物保藏中心的中华苜蓿根瘤菌S.12531为对照菌株,以实验室保存的R.GN5(RzhizobiumGN5) 根瘤菌株为参比菌株,测定各筛选根瘤菌的抑菌剂抗性。
将1.3.2中对高浓度抑菌剂耐受性较好的根瘤菌株送往中国农业科学院微生物研究所菌种保藏中心进行生化指标鉴定并测定16sRNA序列。得到1株编号为LH3436的苜蓿根瘤菌(343-6),为对0.6 mg/mL苦参碱具有耐受性的根瘤菌株。
1.4 荧光标记根瘤菌的构建
1.4.1 供试菌株活化 供体菌株E.colipMP 4517,含有cfp(青色荧光蛋白),营养缺陷型菌株,无法在SM培养基上生长,对庆大霉素有抗性(Gmr);
辅助菌株E.colipRK2073,营养缺陷型菌株,无法在SM培养基上生长,对壮观霉素有抗性(Sper);
受体菌株1S.12531,标准菌,购自中国农业科学院微生物保藏中心;
受体菌株2R.GN5,实验室保存的苜蓿根瘤菌;
受体菌株3R.LH3436,1.3.2中筛选出的对苦参碱抑菌剂具有优良抗性的苜蓿根瘤菌。
抗生素平板制备,将0.22 μm滤膜过滤灭菌的高浓度Gm和Spe母液于TY/LB/SM固体培养基冷却至40 ℃加入,使其终浓度分别为40 μg/mL和20 μg/mL。
1.4.2 受体菌感受态菌株制备 受体菌于28 ℃下YMA固体培养基中活化24 h,转入YMA液体培养基,同一温度下振荡培养3~4 h,待菌液D600 nm达到0.4时[12],置于冰上轻轻摇动预冷,15 min后将冷却菌液转入预冷的50 mL离心管,4 ℃下3 000 r/min离心5 min,弃去上清液,加入15 mL预冷的0.1 mol/L的无菌CaCl2溶液,并轻摇使细胞重新悬浮,置于冰上20~30 min后再次于4 ℃下3 000 r/min离心5 min。弃上清液,加入2 mL冰上预冷的0.1 mol/L的CaCl2溶液,轻摇后用于转化或低温冷藏备用。
1.4.3 cfp荧光标记根瘤菌的构建 分别在添加40 μg/mL Gm和20 μg/mL Spe的LB平板上划线活化供体菌4 517和辅助菌2 073,在TY平板上活化受体菌。而后用接种针分别挑取少量活化供体菌株和辅助菌株至添加40 μg/mL Gm和20 μg/mL Spe的LB液体培养基中,37 ℃下培养至对数生长期(D600 nm= 0.3~0.5),挑取少量活化受体菌株至TY液体培养基中,28 ℃下培养至对数生长期(D600 nm=0.5~0.8)。
将活化的供体菌、辅助菌和受体菌(感受态细胞)按1∶1∶1体积比混合,8 000 r/min 离心5 min,得到沉淀混合菌体,加1 mL TY液体培养基并用力摇匀后重复离心,留沉淀,重复2次,而后用200 μL的枪头不断抽吸沉淀菌体,得到打散的浓菌液。
在无菌状态下将浓菌液转移至贴于TY固体培养基表面的无菌滤膜上,3片/皿,28 ℃下正置培养,待菌液中的液体被平板吸收后,改为倒置培养,2~3 d后将皿中滤膜转移至添加5 mL无菌水的西林瓶中,在漩涡振荡器上充分打散菌体,取其10倍稀释液0.2 mL涂抹于SM和SM+Gm固体培养基,28 ℃下恒温培养7 d,SM+Gm平板上新长出的菌落即为具有Gm抗性的受体菌接合子。为进一步确定所筛选出的接合子为荧光标记根瘤菌,可将所有接合子分别对应点接于TY和无N固体培养基上,综合每一接合子在2种培养基上的生长情况,将在TY培养基上发黄绿色荧光并能在无N培养基上正常生长的接合子确定为荧光标记根瘤菌[13]。
1.4.4 标记根瘤菌株的抑菌剂耐受性变化检测 参考1.3.1的方法制备不同浓度的含抑菌剂平板,将制备好的荧光标记菌S.12531f,R.GN5f和R.LH3436f分别点接于各平板,观察其抑菌剂耐受性的变化情况。
1.5 数据分析
采用SPSS16.0以SNK法进行数据分析和差异显著性检验。
2 结果与分析
2.1 根瘤菌的分离过程
6个品种紫花苜蓿的根瘤中均含有大量根瘤菌。经过形态鉴定、革兰氏染色、刚果红色素吸附情况以及在无氮培养基上的生长情况等初步鉴定手段,以各品种根瘤中初筛菌株在无氮培养基上的生长速度和活力状况为主要依据,在6个品种的紫花苜蓿中共筛选出39株固氮效果好、菌种活力高的初筛菌株(表2)。各品种紫花苜蓿根瘤中固氮效果优良的初筛菌株比例相同,其中,WL343HQ和甘农3号2个品种中高固氮活力的菌株较多,为每个品种8株,以Qingshui较少,为5株外,其他3个品种均为6株。
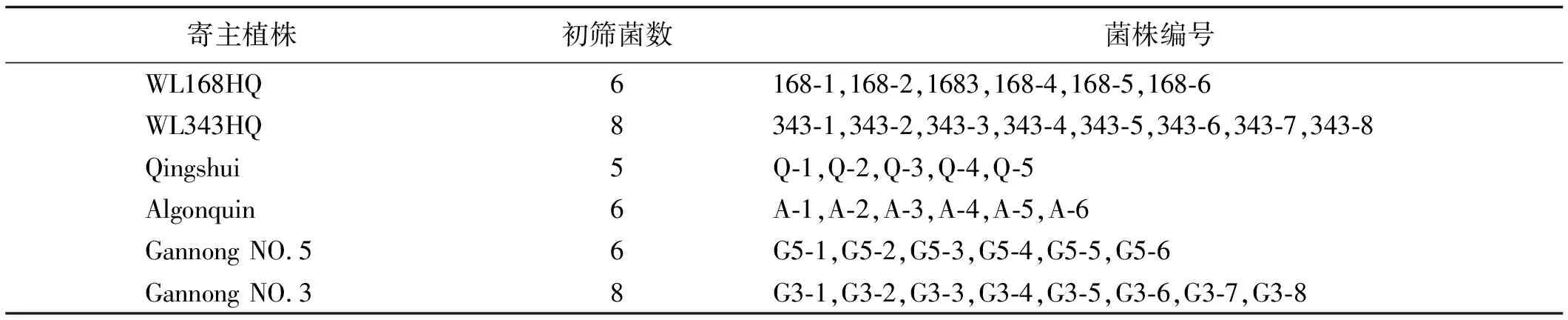
表2 初筛根瘤菌株编号及寄主植株
2.2 初筛根瘤菌株的形态学鉴定、生理生化特性测试及抑菌剂耐受性
将初筛菌株划线接种于YMA刚果红培养基上,36 h观察平板中单菌落形态,进行根瘤菌的初步筛选。发现在39株初筛菌株中,各菌株菌落直径为4.5~6.0 mm,其中,直径集中在5.0和5.5 mm处。各初筛菌株均为含有粘质胞外多糖且不吸附色素的白色半透明菌落,其形态呈平坦凸起或半球形凸起,边缘光滑,基本符合伯杰氏菌种鉴定手册中对根瘤菌形态的定义,可以确定为根瘤菌初筛菌株。
所有初筛39株根瘤菌株为快生型产酸菌,培养36 h时,各菌株单菌落直径即达到4 mm以上[14],同时均为革兰氏阴性菌,均不能利用柠檬酸盐,且在过氧化氢酶测试中都表现出阳性反应,试验测试结果符合根瘤菌的生化代谢特征[15],但所有的初筛菌株及参比菌株均可利用淀粉,这不符合根瘤菌的生理生化特性(表3)。在39株初筛的根瘤菌中,多数菌株难以利用D-果糖,但大多数可以利用乳糖。除Q-3、Q-4和Q-5不能利用葡萄糖,可以基本排除其为根瘤菌的可能性外,其他菌株均可利用葡萄糖;绝大多数菌株在3-酮基乳糖反应中都表现为阴性反应,而343-2、343-4、Q-1、G5-1、G5-5、G3-3、G3-5和G3-6为阳性,也可以排除为根瘤菌株的可能性。
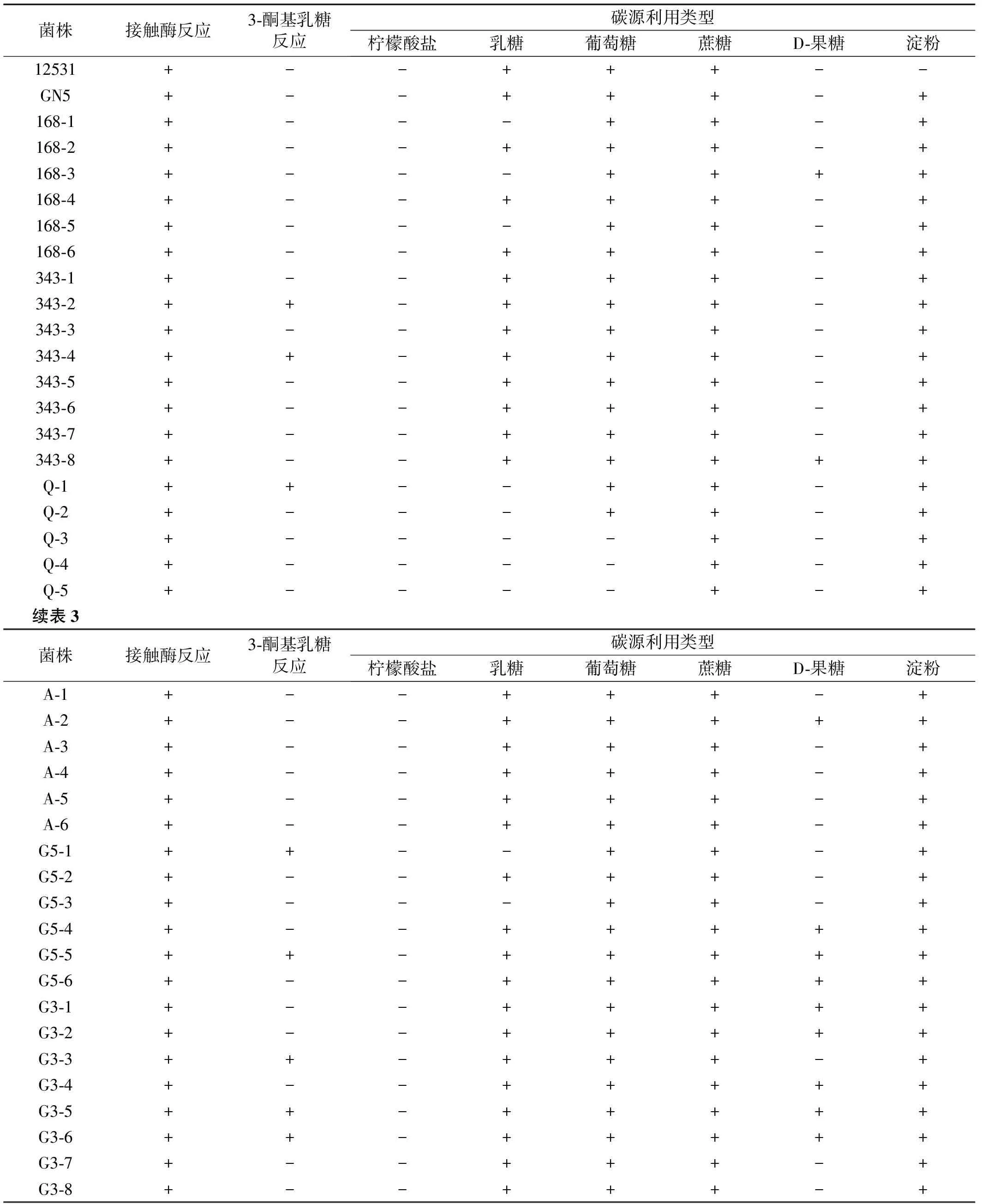
表3 初筛根瘤菌株的主要生理生化特性
注:“+”表示菌株能够生长或呈阳性反应,“-”表示菌株不能生长或呈阴性反应
将所有39株初筛根瘤菌及对照菌株和参比菌株点接于含有不同浓度梯度及类型抑菌剂的平板中,进行培养,观察其生长状况,发现所有点接菌株均可耐受0.4 mg/mL及以下浓度的苦参碱抑菌剂,以及所有类型的0.2 mg/mL的La3+抑菌剂,并且均可耐受试验浓度范围内的除虫菊素抑菌剂(表4)。La(NO3)3·6H2O浓度达到0.4 mg/mL时,所有点接菌株均无法长出,而在同一浓度下添加CeNO3·6H2O和LaCl3的平板中,有少量点接菌长出,La3+浓度为0.6 mg/mL时,所有点接根瘤菌均无法长出,说明La(NO3)3·6H2O对根瘤菌的抑制效果较CeNO3·6H2O和LaCl3强。在含有0.4 mg/mL苦参碱抑菌剂的平板中,仍有少量点接菌长出,部分优秀菌株甚至可耐受0.6 mg/mL的苦参碱抑菌剂。将表4中对某一抑菌剂耐受性较好的菌株送检,进行进一步生理生化指标的鉴定,得到LH3436菌株,为可耐受0.6 mg/mL苦参碱抑菌剂的根瘤菌。
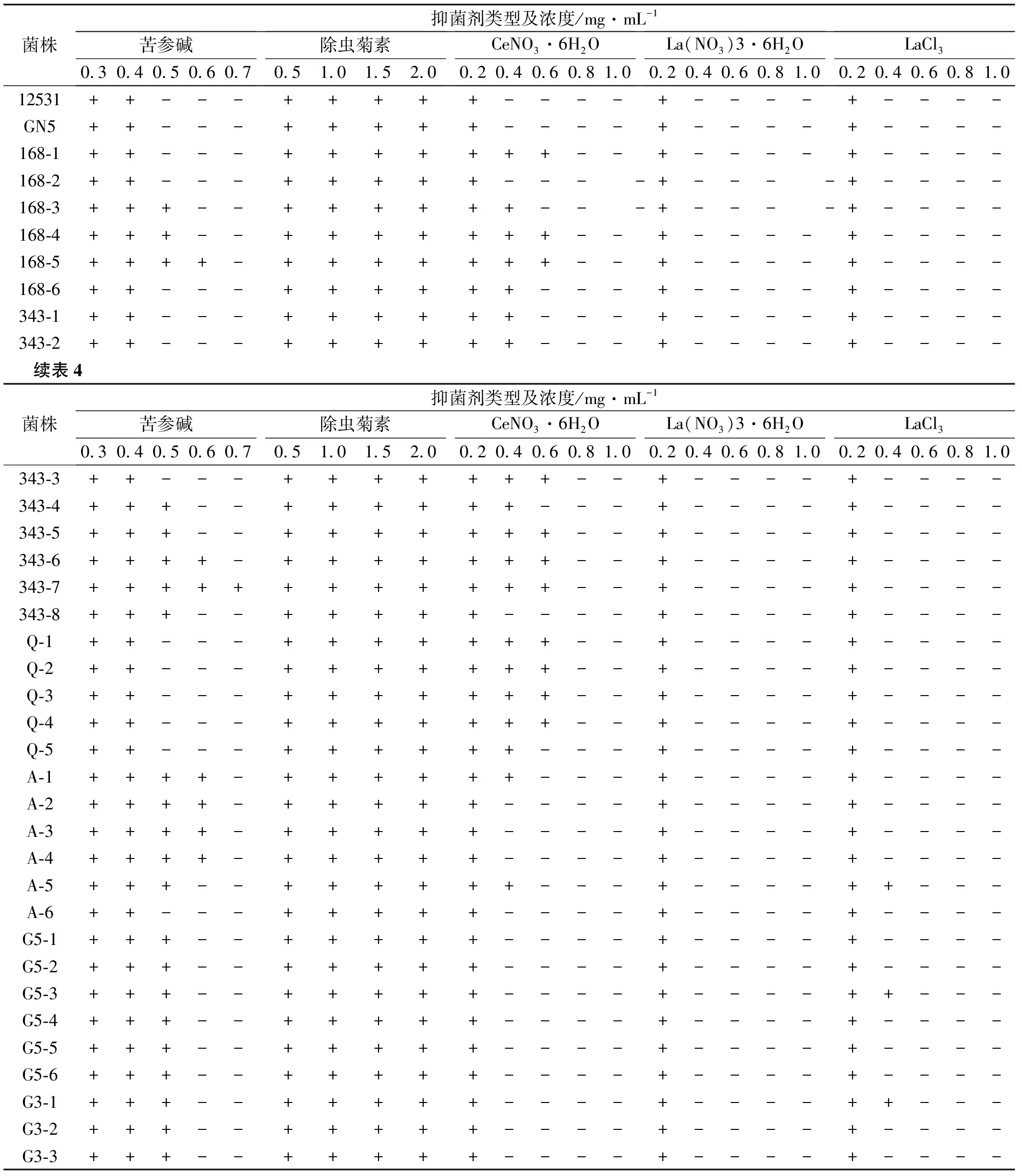
表4 初筛根瘤菌株对各类型及浓度抑菌剂的抗性
注:“+”表示各菌株可以在平板上生长,“-”表示各菌株无法在平板上生长。下同
2.3 荧光标记根瘤菌株的抑菌剂耐受性变化
将对照菌株S.12531,参比菌株R.GN5和筛选根瘤菌R.LH3436构建荧光标记根瘤菌后,经过荧光活性的遗传稳定性测试,选取荧光活性稳定,发光强度大的各标记菌株,参照表3,4点接于含有不同浓度及类型抑菌剂的平板上,进行培养并观察荧光标记对根瘤菌抑菌剂耐受性的影响(表5)。结果与表3,4比较无变化,说明荧光标记并未影响根瘤菌的抑菌剂耐受性。
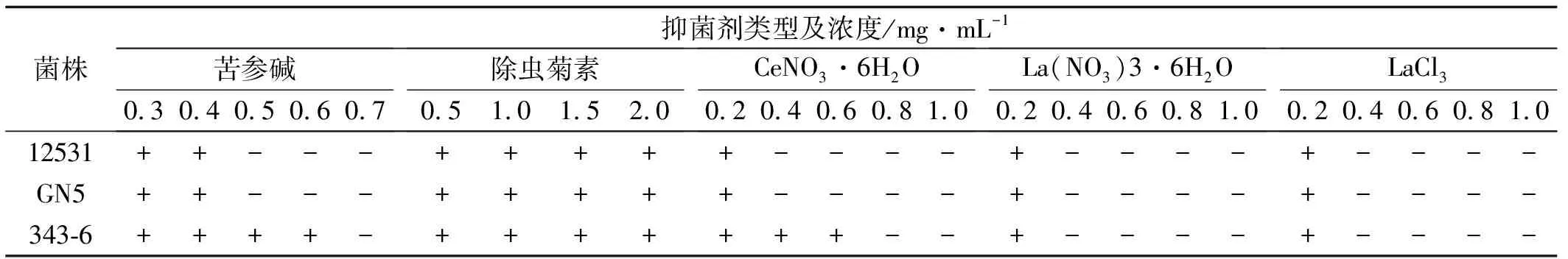
表5 荧光标记根瘤菌的抑菌剂耐受性
3 讨论与结论
研究发现,在根瘤菌的筛选过程中,各初筛菌株在对刚果红吸附状况、BTB反应、接触酶反应、革兰氏染色等的生理生化反应以及对柠檬酸盐和蔗糖等碳源的利用情况表现完全一致,符合根瘤菌的代谢特征,但所有初筛菌株可利用可溶性淀粉,不符合根瘤菌的代谢特征,是由环境影响所致。区域环境因素的改变,在影响了宿主植株生长的同时也改变了根瘤菌的存活环境,造成根瘤菌种群和数量的变化,进而导致根瘤菌表型和遗传型多样性的改变。这与赵佚丽等[16]对台湾相思根瘤菌的研究结果一致,即在特定环境下,根瘤菌的生理生化特性表现出多样性。所有初筛根瘤菌株在3-酮基乳糖反应以及葡萄糖、果糖和乳糖等碳源利用试验中表现出差异性,少数菌株可在上述指标中排除为根瘤菌的可能性。相比较而言,各初筛菌株在无氮培养基上的生长速度及菌落直径指标最能反映各菌株的活力状况,该过程排除根瘤菌可能性的初筛菌株数目最多。
与各类型及浓度梯度抑菌剂对空气和土壤中杂菌的抑制效果相比[7,8],所有初筛根瘤菌株对植物源类抑菌剂的相对耐受效果好,而对稀土盐类抑菌剂的耐受效果差,表明植物源类抑菌剂对试验初筛根瘤菌的选择毒性低,这与环境条件所导致的根瘤菌生理生化特性的一致性有关[17],即根瘤菌株的抗逆性因其所在地区环境的差异而存在差异性[18]。同时,所有初筛菌株对抑菌剂的耐受性均类似或优于对照和参比菌株。一方面可能与初筛菌株刚分离自田间植株根瘤,在实验室中继代培养的次数较少,菌株活力维持的较好有关;另一方面则是由于将所有初筛菌株点接于含抑菌剂平板中,接种量大,促进了菌株耐受性的增强。
将荧光标记的R.LH3436,S.12531和R.GN5根瘤菌点接于含各浓度梯度及类型抑菌剂的平板中,并观察其生长状况,发现所有标记菌的耐受性与原始菌株比无变化。表明荧光蛋白标记技术在将发光基因导入根瘤菌的同时,并未对目标根瘤菌造成额外负担,这符合理想的菌株标记方法,即检测灵敏度高、方法简单、成本低廉且标记基因对标记菌不产生负担,可在宿主细胞中稳定保存等。张淑卿等[19]的研究发现,氯化镧作为外源物质时,对荧光标记根瘤菌的生长有一定的促进作用。而陈力玉等[20]在关于荧光标记根瘤菌和出发菌株对寄主植株回接效果的测试中也发现,进行了荧光标记的根瘤菌对寄主植株的促生效果与原始菌株比无差异,这与试验的研究结果类似,即荧光标记根瘤菌的构建并不影响原始菌株本身的性质,不影响菌株回接对寄主植株的促生效果或是菌株本身的抑菌剂耐受性,表明使用三亲本杂交法构建荧光标记根瘤菌可以当做一种简单且检测灵敏度高的方法用于菌剂耐受性及回接后植株促生效果的测试。
参考文献:
[1] Bashan Y,Bashan L E,Prabhu S R,etal.Plant Soil Advances in plant growth-promoting bacterial inoculant technology:formulations and practical perspectives[J].Published online,2013(11):36-41.
[2] Rodriguez-Navarro D N,Temprano F,Orive R.Survival ofRhizobiumsp.(HedysarumcoronariumL.) on peat-based inoculants and inoculated seeds[J].Soil Biology and Biochemistry,1991,23:375-379.
[3] Bashan Y.Inoculants of plant growth-promoting bacteria for use in agriculture[J].BiotechnologyAdvances,1998,16:729-770.
[4] Schwartz M W,Hoeksema J D,Gehring CA,etal.The promise and the potential consequences of the global transport of mycorrhizal fungal inoculant[J].Ecology Letters,2006(9):501-515.
[5] Jung G,Mugnier J,Diem H G,etal.Polymer-entrapped Rhizobium as an inoculant for legumes[J].Plant Soil,1982,65:219-231.
[6] Sessitsch A,Jjempa P K,Hardarson G,etal.Measurement of the competitive index ofRhizobiumTropicistrain CIAT899 derivatives marked with the GusA gene[J].Soil Biochemistry,1998,39:1099-1110.
[7] Pinghui Huo,Jianfeng Li,Shangli Shi,etal.The broad spectrum inhibitory effect study of 3 rare earth salts used for microbial inoculant additive[J].Applied Mechanics and Materials,2013,310:166-171.
[8] Pinghui Huo,Jianfeng Li,Shangli Shi,etal.Wide spectrum inhibitory effect study of two botanical antimicrobials to soil and air microbes[J].Applied Mechanics and Materials,2013,310:172-176.
[9] Porsser J I.Molecular maker systems for detection of genetically engineered microorganisms in theenvironment[J].Microbiology,1994,140:5-17.
[10] 黄宝灵,吕成群.罗汉松根瘤内生细菌的分离和特性[J].微生物学报,2002,42(5):620-623.
[11] 李乔仙,张斌,戴燕燕,等.南苜蓿根瘤菌生理生化特性研究[J].安徽农业科学,2009,37(22):10365-10369.
[12] 杨坤,巩振辉,李大伟.大肠杆菌高效感受态细胞的制备及快捷转化体系的建立[J].北方园艺,2010,14:127-130.
[13] 陈力玉.基于三亲本杂交的荧光标记根瘤菌的构建及其稳定性检测研究[D].兰州:甘肃农业大学,2013.
[14] Vincent J M.Root-nodule symbiosis with Rhizobium[C]∥The biology of nitrogen fixation.Quispel A.North-Holland Research Monographs:Frontiers of Biology,Amsterdam:North-Holland,1974:265-341.
[15] Jordan D C.Genus I.Rhizobium[C]∥Bergey's Manual of Systematic Bacteriology.Holt J G,Krieg N R.London:Williams & Wilkins Co,1984:235-242.
[16] 赵佚丽,黄宝灵,吕成群,等.台湾相思根瘤菌的生理生化特性及生长适应性研究[J].安徽农业科学,2012,40(8):4612-4617.
[17] 陈文新,吴柏和,曹增良,等.新疆地区豆科根瘤菌特性的分析(一)[J].土壤肥料,1984(3):4-7.
[18] 万晓红,韦革宏,杨亚珍,等.紫花苜蓿品种根瘤菌表型多样性研究[J].草地学报,2004(4):48-49.
[19] 张淑卿,师尚礼,陈力玉,等.LaCl3、IAA及植物体液对荧光标记根瘤菌生长和增殖的影响[J].草原与草坪,2013,33(2):57-61.
[20] 陈力玉,张淑卿,李剑峰,等.接种荧光标记根瘤菌对苜蓿幼苗生长的影响[J].草原与草坪,2013,33(6):1-8.
