棉酚衍生物ApoG2诱导胃癌细胞凋亡及对Wnt6调控作用的研究
2014-09-11李天晓元刚叶丽君孙健黎曙霞
李天晓 元刚 叶丽君 孙健 黎曙霞
胃癌是世界范围难治性肿瘤之一。诱导肿瘤细胞凋亡是研发抗癌药的目标之一,棉酚衍生物ApoG2是针对细胞凋亡调节因子Bcl2蛋白家族中抗凋亡蛋白结构开发出的新型棉酚衍生物,能够拮抗Bcl2抗凋亡作用,释放促凋亡蛋白Bax和Bak,启动细胞凋亡程序[1]。目前ApoG2抗肿瘤能力已被广泛证明,ApoG2不仅能影响Bcl2家族的表达激活线粒体凋亡通路,也能通过诱导内质网应激凋亡、细胞自噬等其他途径引起肿瘤细胞死亡,提示ApoG2可能激活多条抑癌通路[2-4]。近来发现WNT信号通路在消化道系统肿瘤发生过程中扮演了重要角色。胃上皮组织Wnt/β-catenin通路的激活可直接引起肿瘤的形成[5]。Wnt6是WNT家族重要成员,参与调控细胞活动,包括细胞增殖、分化和迁移,在肿瘤细胞中高度表达,并且介导了胃癌细胞对化学治疗的抵抗性[6-7]。WNT与Bcl2信号通路存在广泛的相互作用[8-9]。有研究发现ApoG2能显著下调WNT信号靶基因c-Myc和细胞周期蛋白cyclin D1的表达,但ApoG2对WNT蛋白家族的影响尚未见报道[10]。本研究以人胃腺癌细胞株BGC823为模型研究ApoG2诱导胃癌细胞凋亡的作用,并检测ApoG2对Bcl2家族及Wnt6表达的影响,进一步探讨ApoG2抗肿瘤机制和应用前景,现报告如下。
材料与方法
一、细胞与试剂
人胃癌细胞株BGC823由中山大学附属第一医院消化内科实验室馈赠,培养于完全培养基[含10%胎牛血清(Gibco,美国)、100 kU/L青霉素和100 mg/L链霉素的RPMI1640培养基(Gibco,美国)],培养环境37℃,5% CO2。ApoG2由上海亚盛医药科技有限公司杨大俊教授馈赠,溶解于二甲亚砜(MP Biomedicals,美国)配成20 mmol/L储存液,-20℃保存。
二、方 法
1.ApoG2对胃癌细胞BGC823生长抑制作用的检测
采用噻唑蓝(MTT)法。消化对数生长期的胃癌细胞BGC823,以培养液稀释成终浓度为1×105/ml的单细胞悬液,每孔100μl接种于96孔培养板中,待细胞贴壁后弃去培养液,用不含血清的培养基梯度稀释ApoG2母液至不同浓度(终浓度为10、5、2.5、1.25、0.625、0.3125μmol/L),加入培养孔中,每个浓度设3个复孔,对照组和调零组加入含0.1% 二甲亚砜培养基,其中调零组不接种细胞。分别培养24、48、72 h后,每孔加入5 g/L MTT溶液(MP Biomedicals,美国)20μl,继续培养4 h后小心吸弃孔内溶液,加入二甲亚砜溶解结晶物,用酶标仪 (Thermo Multiskan GO,美国)检测各孔在490 nm处的吸光度(OD),记录OD值。细胞生长抑制率(%) = [1- (OD试验组-OD调零组)/(OD对照组-OD调零组)]×100%。半数抑制浓度(IC50)指与对照组比较抑制50%细胞生长的药物浓度。
2.药物干预
根据MTT实验的结果,ApoG2处理24、48、72 h均对细胞有较明显的生长抑制作用,选取48 h作为药物干预时间,选取给药浓度中最接近48 h IC50值的1.25μmol/L,2倍的IC50值2.5μmol/L和4倍的IC50值5μmol/L作为药物干预浓度。经消化的细胞用完全培养基重悬稀释接种于6孔板,细胞贴壁后分别用0.1% 二甲亚砜或1.25、2.5、5μmol/L ApoG2处理细胞48 h,进行后续实验。
3.细胞凋亡形态的检测
经消化的细胞用完全培养基稀释至105/ml接种于6孔板内,每孔2 ml,培养过夜。按前述方法给药48 h后,弃去培养基,按Hoechst33258染色试剂盒(碧云天,中国)说明书固定并染色。荧光显微镜(ZEISS Axio Imager Z1,德国)下观察拍照。激发波长350 nm,发射波长460 nm。
4.细胞周期分析
将2×105/ml细胞悬液接种于6孔培养板,每孔2 ml,培养过夜。按前述方法给药48 h后,用0.25%的胰蛋白酶消化收集细胞,加入预冷70%乙醇4℃固定过夜。弃固定液后用预冷磷酸盐缓冲液(PBS)洗涤1次,用配好的DNA染色液[含0.2% Triton-X-100,RNase 100μg/ml,碘化丙啶(PI)50μg/ml]重悬细胞沉淀,37℃避光染色30 min,上流式细胞仪(Beckman Coulter FC500,美国)检测细胞周期。分析Sub-G1期(凋亡导致基因组降解,其DNA含量少于G1期)细胞比例。
5.Bcl2家族基因表达水平的检测
常规提取细胞总RNA,采用荧光定量逆转录PCR检测,逆转录使用PrimeScript RT reagent Kit试剂盒(Takara,日本),引物序列见表1。荧光定量PCR反应体系按照预混SYBR试剂盒(Takara,日本)说明书配制,按荧光定量PCR仪(ABI 7500,美国)说明设置反应程序。实验所得数据按ΔΔCt法计算分析。

表1 引物序列
6.Wnt6蛋白表达水平的检测
采用蛋白印迹法法检测。BCA法检测蛋白浓度后,用12% SDS-PAGE胶电泳分离蛋白,电转至PVDF膜上,室温封闭1 h,先后用Wnt6抗体(ab50030,Abcam)或GAPDH抗体(#2118,Cell Signaling Technology)、过氧化辣根偶联的羊抗兔抗体(#7074,Cell Signaling Technology)孵育,于暗房内等体积混匀增强型化学生物发光试剂盒(WBKLS0500,Millipore)工作液,滴于膜上目的蛋白条带处,发光后曝光于X线胶片上。X线胶片在激光光密度图像扫描仪(CanoScan LiDE 25)上扫描后用ImageJ1.44软件计算条带灰度值,以内参GAPDH校正上样量计算蛋白相对表达量。
三、统计学处理
每项实验中,各浓度组均进行3次独立重复实验,采用SPSS17.0软件分析数据。使用回归分析拟合浓度-抑制率曲线计算IC50。计量资料以¯x±s表示,多组比较采用单因素方差分析,进一步两两比较采用Bonferroni法。多组比较以P<0.05为差异有统计学意义,两两比较以P<0.01为差异有统计学意义。
结 果
一、ApoG2对BGC823细胞的生长抑制作用
MTT实验结果显示,各浓度ApoG2均能明显抑制细胞生长,且随着ApoG2干预浓度升高和干预时间延长,抑制作用更加明显。给药24、48、72 h的IC50分别为2.11、1.22、0.59μmol/L,见图1。
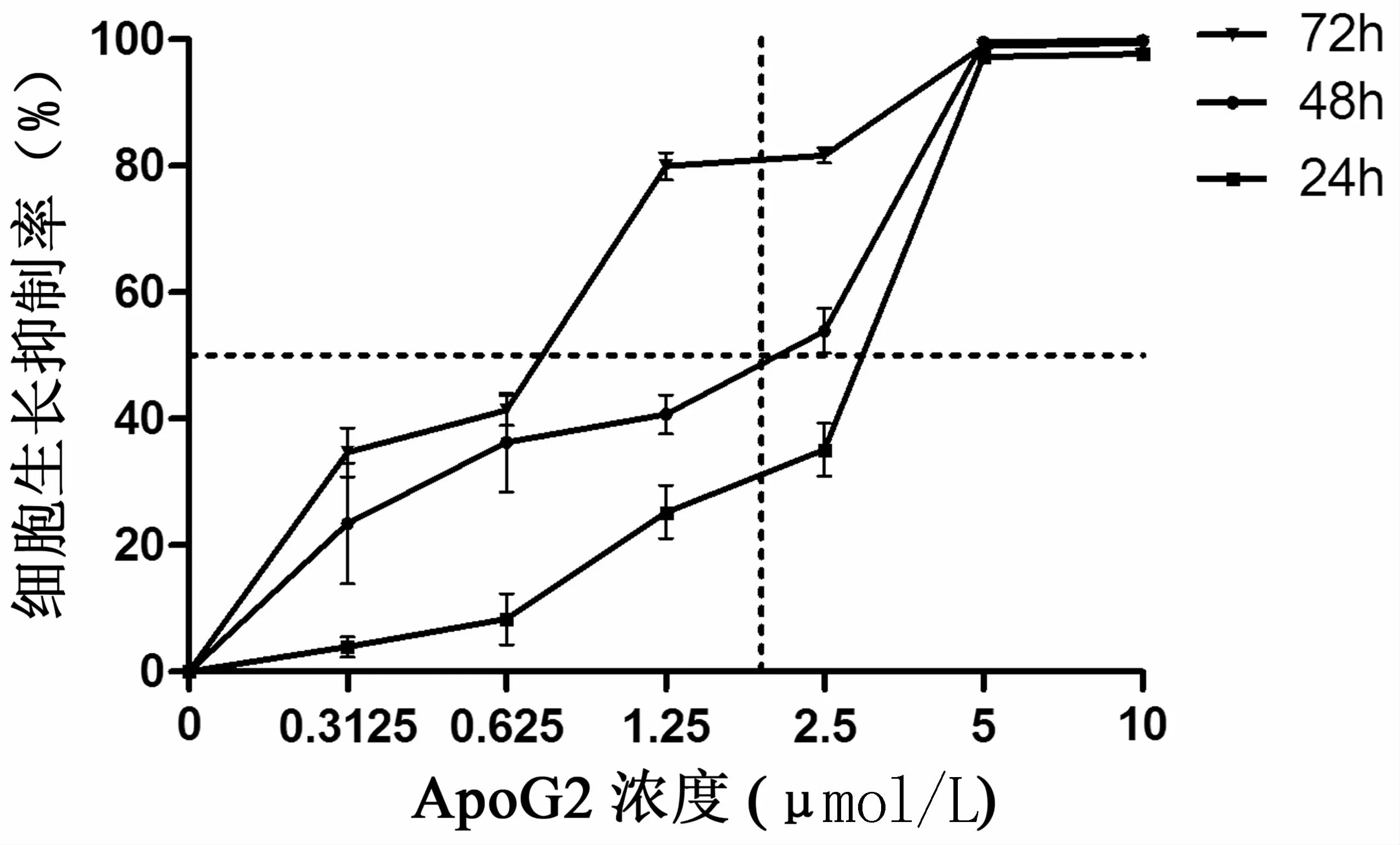
图1 不同浓度ApoG2对人胃癌细胞系BGC823的生长抑制作用
二、ApoG2诱导BGC823凋亡的检测结果
1.形态学变化
ApoG2处理细胞48 h后,经Hoechst33258染色后可见典型凋亡细胞,细胞呈高亮蓝色,核固缩或呈分叶状,而对照组细胞呈淡蓝色。随ApoG2给药浓度升高,细胞数目逐渐减少,高亮细胞比例逐渐升高,见图2。
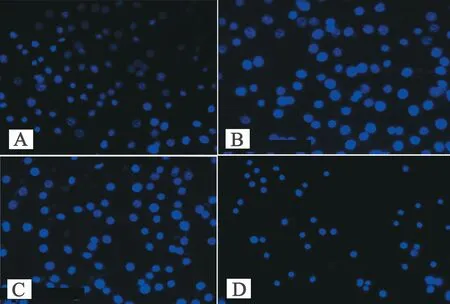
图2 不同浓度ApoG2作用下BGC823细胞的凋亡情况(Hoechst染色,×40)
2.细胞周期变化
与对照组相比,ApoG2处理细胞48 h后Sub-G1期细胞数目明显增多,1.25、2.5、5μmol/LApoG2处理细胞48 h后Sub-G1期细胞比例分别为(27.6±3.2)% 、(33.4±2.1)% 、(54.3±2.8)%,对照组Sub-G1期细胞比例为 (6.4±1.3)%,4组Sub-G1期细胞比例比较差异有统计学意义(F=192.6,P<0.001),各给药组Sub-G1期细胞比例均比对照组明显增高(t分别为10.631、18.935、26.875,P 均 <0.001),且ApoG2 5μmol/L组中Sub-G1期细胞比例高于ApoG2 1.25μmol/L组及2.5μmol/L组,见图3。
三、ApoG2对BGC823细胞Bcl2家族基因表达的影响
BGC823细胞与0.1% 二甲亚砜、1.25、2.5、5μmol/L ApoG2分别孵育48 h后,1.25、2.5、5 μmol/L组Bcl2 mRNA表达水平分别比对照组下调至0.81、0.67、0.42倍(t=11.162,P<0.01)。2.5、5μmol/L组Bax mRNA表达水平分别比对照组上调至1.95倍(t=16.454,P<0.01)、6.24倍(t=90.76,P<0.001),Bak mRNA表达水平则分别上 调 至 2.11、6.23 倍(t分 别 为 19.226、11.323,P均<0.01);1.25μmol/L组Bax、Bak mRNA表达水平分别为对照组的0.91、0.96倍,两组比较差异无统计学意义(P均>0.05),见图4。
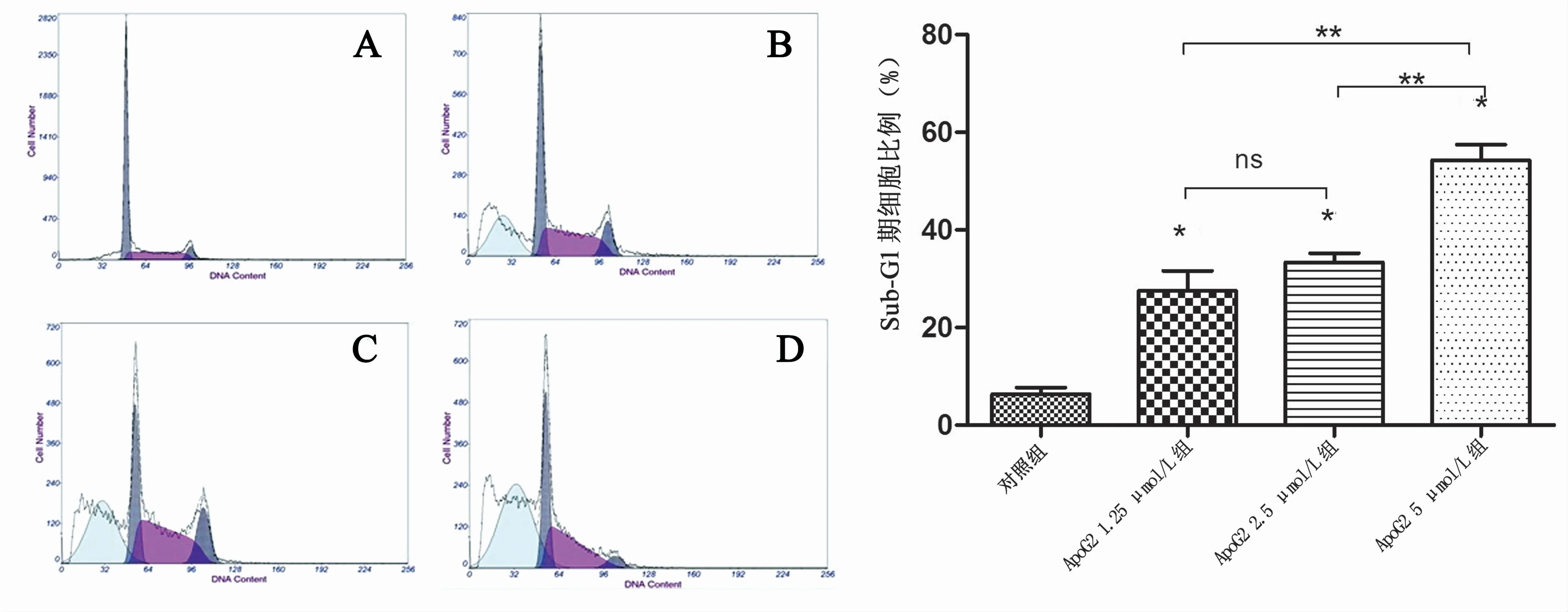
图3 不同浓度ApoG2作用下BGC823细胞周期检测结果
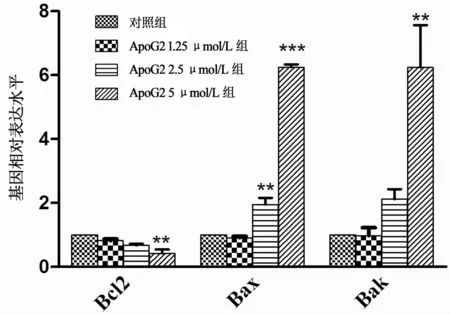
图4 不同浓度ApoG2作用下BGC823细胞Bcl2家族基因表达水平的比较
四、ApoG2对BGC823细胞Wnt6蛋白表达水平的影响
BGC823细胞与0.1%二甲亚砜、1.25和2.5 μmol/LApoG2分别孵育48 h后,1.25和2.5μmol/L组Wnt6蛋白表达水平分别比对照组下调至0.76、0.71倍(t分别为19.226、11.323,P均<0.01),见图5。提取细胞总蛋白后,5μmol/L组在最大上样体积内无法满足最低上样蛋白量,降低蛋白量则影响对Wnt6表达的检测,故未检测5 μmol/L组ApoG2处理后细胞Wnt6蛋白的表达量。
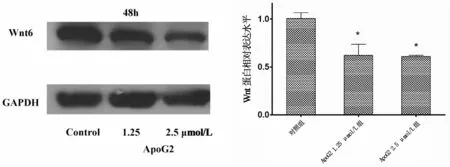
图5 不同浓度ApoG2作用下BGC823细胞中Wnt6蛋白表达水平的比较
讨 论
我国胃癌发生率及病死率均较高,外科手术是治疗胃癌最有效的手段,然而多数胃癌发现时已错过了最佳手术时期,对于不能手术、术后复发或远处转移的胃癌,化学治疗是主要的治疗手段。胃癌对传统的化学治疗方法存在严重的耐药现象,因此寻找安全、有效的抗肿瘤药物是胃癌研究领域的重要任务。Bcl2蛋白家族与肿瘤的发生发展以及肿瘤耐药性的产生密切相关[11]。多种恶性肿瘤中可见Bcl2过度表达,在胃癌组织中Bcl2过度表达率高达60%~70%[12-13]。因此抑制肿瘤细胞过度表达Bcl2的抗凋亡作用可作为治疗胃癌的新策略。
ApoG2是具有Bcl2蛋白家族抗凋亡蛋白泛抑制作用的新型棉酚衍生物,与母体化合物相比具有更强的抗肿瘤作用和较小的毒性作用[14]。已有研究显示ApoG2可在体外诱导包括胃癌细胞系MKN28、MKN45和AGS凋亡[15]。胃癌动物试验也证实了ApoG2的体内抗肿瘤能力[3]。ApoG2可能成为治疗胃癌的新型药物之一,具有进一步研究的价值。本研究以取自中国患者胃癌组织建立的BGC823细胞株为模型,证实了ApoG2能够以低浓度抑制BGC823细胞生长,诱导细胞凋亡。据报道,Wnt6在胃癌细胞中高度表达,且表达量与胃癌细胞对化学治疗的耐药对象呈正相关,敲除Wnt6基因可明显提高胃癌细胞对化学治疗的敏感性[2]。在经典的WNT信号通路中,WNT信号可通过β-链蛋白调控核内基因转录,也有研究表明在结肠癌细胞中WNT信号可激活Bcl2抗凋亡蛋白Bcl-w启动子促进Bcl-w的表达抵抗细胞凋亡[16]。因此,研究进一步检测了ApoG2对Wnt6及Bcl2家族的影响。结果发现,ApoG2能够下调Wnt6蛋白的表达,同时下调抗凋亡标志Bcl2基因的表达水平,并上调促凋亡标志Bax和Bak的表达水平。本研究结果提示,ApoG2可能通过下调Wnt6的蛋白水平影响Bcl2、Bax和Bak的基因转录,引起细胞凋亡。由于Wnt6与胃癌耐药性密切相关,对于Wnt6高表达的耐药性胃癌,ApoG2有可能成为其中一种新型治疗药物。
[1]Hu ZY,Zhu XF,Zhong ZD,et al.ApoG2,a novel inhibitor of antiapoptotic Bcl-2 family proteins,induces apoptosis and suppresses tumor growth in nasopharyngeal carcinoma xenografts.Int J Cancer,2008,123:2418-2429.
[2]Xin J,Zhan Y,Liu M,et al.ApoG2 induces ER stress-dependent apoptosis in gastric cancer cells in vitro and its real-time evaluation by bioluminescence imaging in vivo.Cancer Lett,2013,336:260-269.
[3]Cheng P,Ni Z,Dai X,et al.The novel BH-3 mimetic apogossypolone induces Beclin-1-and ROS-mediated autophagy in human hepatocellular carcinoma[corrected]cells.Cell Death Dis,2013,4:e489.
[4]Sun J,Li ZM,Hu ZY,et al.ApoG2 inhibits antiapoptotic Bcl-2 family proteins and induces mitochondria-dependent apoptosis in human lymphoma U937 cells.Anticancer Drugs,2008,19:967-974.
[5]Radulescu S,Ridgway RA,Cordero J,et al.Acute WNT signalling activation perturbs differentiation within the adult stomach and rapidly leads to tumour formation.Oncogene,2013,32:2048-2057.
[6]Kirikoshi H,Sekihara H,Katoh M.WNT10A and WNT6,clustered in human chromosome 2q35 region with head-to-tail manner,are strongly coexpressed in SW480 cells.Biochem Biophys Res Commun,2001,283:798-805.
[7]Yuan G,Regel I,Lian F,et al.WNT6 is a novel target gene of caveolin-1 promoting chemoresistance to epirubicin in human gastric cancer cells.Oncogene,2013,32:375-387.
[8]Mezhybovska M,Wikström K,Ohd JF,Sjölander A.The inflammatory mediator leukotriene D4 induces betacatenin signaling and its association with antiapoptotic Bcl-2 in intestinal epithelial cells.J Biol Chem,2006,281:6776-6784.
[9]Zeilstra J,Joosten SP,Wensveen FM,et al.WNT signaling controls expression of pro-apoptotic BOK and BAX in intestinal cancer.Biochem Biophys Res Commun,2011,406:1-6.
[10]Hu ZY,Sun J,Zhu XF,et al.ApoG2 induces cell cycle arrest of nasopharyngeal carcinoma cells by suppressing the c-Myc signaling pathway.J Transl Med,2009,7:74.
[11]Adams JM,Cory S.The Bcl-2 apoptotic switch in cancer development and therapy.Oncogene,2007,26:1324-1337
[12]Anagnostopoulos GK,Stefanou D,Arkoumani E,et al.Bax and Bcl-2 protein expression in gastric precancerous lesions:immunohistochemical study.J Gastroenterol Hepatol,2005,20:1674-1678.
[13]Lee SS,Cho KJ,Hong SI,et al.Nuclear overexpression of bcl-2 oncoprotein during the progression of human stomach cancer.J Korean Med Sci,1998,13:153-158.
[14]Wei J,Kitada S,Stebbins JL,et al.Synthesis and biological evaluation of Apogossypolone derivatives as panactive inhibitors of antiapoptotic B-cell lymphoma/leukemia-2(Bcl-2)family proteins.J Med Chem,2010,53:8000-8011.
[15]Xin J,Zhan YH,Xia LM,et al.ApoG2 as the most potent gossypol derivatives inhibits cell growth and induces apoptosis on gastric cancer cells.Biomed Pharmacother,2013,67:88-95.
[16]Lapham A,Adams JE,Paterson A,et al.The Bcl-w promoter is activated by beta-catenin/TCF4 in human colorectal carcinoma cells.Gene,2009,432:112-117.
