塞来昔布胶囊溶出度测定方法的研究
2014-09-10陈文静王崇益
滕 奇,陈文静 ,王崇益
(江苏正大清江制药有限公司,江苏 淮安 223001)
0 引言
炎症刺激可诱导环氧化酶- 2(COX- 2)生成,因而导致炎性前列腺素类物质的合成和聚积[1],尤其是前列腺素E2,可引起炎症、水肿和疼痛[2]。塞来昔布是具有独特作用机制的新一代化合物,即特异性抑制环氧化酶- 2,可通过抑制环氧化酶- 2阻止炎性前列腺素类物质的产生,达到抗炎、镇痛及退热作用[3]。塞来昔布由G.D. SEARLE(美国辉瑞Pfizer旗下)研发,于1998年12月获得FDA批准,商品名为Celebrex,国外许多临床试验证明对关节炎有良好的治疗作用, 并可显著减少胃肠道不良反应[4],无论是对于急性创伤外伤导致的急性疼痛, 还是外科手术后的止痛, 都是理想的镇痛药物[5],也可治疗原发性痛经(PD)。其制剂批准的规格有四种:50mg、100mg、200mg和400mg。2000年8月,国家食品药品监督管理局批准G.D.SEARLE(辉瑞旗下)的塞来昔布胶囊进口,2011年,进口的塞来昔布胶囊年销售额达人民币5亿元。
本品在甲醇、乙醇、丙酮和二甲亚砜中易溶,在水中几乎不溶。目前关于塞来昔布的报道多见于临床研究,也有少部分关于塞来昔布杂质含量检测方面的报道发表[6-7],然而对塞来昔布胶囊溶出度的研究目前国内尚未见报道。本文通过对塞来昔布胶囊溶出度测定方法的研究,建立一种准确可靠、操作简便的溶出度测定方法,以便更好的控制产品质量。
1 仪器与试药
1.1 仪器
溶出度仪:天大天发806型 液相色谱仪;Perkin Elmer;检测器:Flexar UV/Vis可调波长检测器;溶液输送泵;Flexar四元泵
色谱工作站:TotalChrom;色谱柱;Hedera C-8(5 μm, 4.6×250 mm)
流动相:乙腈-0.5 %三乙胺溶液(用磷酸调节pH 7.0±0.1)(55:45)作为流动相; 柱温:30℃
检测波长:256 nm;进样量;20 μL
1.2 药品与试剂
塞来昔布胶囊(批号120829、120830、120831,江苏正大制药有限公司提供 );塞来昔布对照品(U.S.Pharmacopeia The Stand of Quality);水为自制,乙腈为色谱纯(美国天地公司);三乙胺(广东光华化学厂有限公司);磷酸为分析纯(美国天地公司);十二烷基硫酸钠(南京化学试剂有限公司)
2 方法学考察
2.1 系统适用性实验
理论板数以塞来昔布峰计不低于2000,塞来昔布与相邻色谱峰的分离度大于1.5。
2.2 检测波长的选择
本品的水溶液(含0.5%十二烷基硫酸钠)按HPLC法在256 nm的波长处有强紫外吸收。故选择256nm为溶出度的检测波长。
2.3 线性范围
取塞来昔布对照品适量,精密称定,26.23mg置于25mL量瓶中,加流动相溶解并定溶至刻度,分别吸取0.6mL、0.8mL、1.0mL、1.2mL、1.5mL和2.0mL置10mL量瓶中加流动相至刻度。取各浓度的溶液,照HPLC法,分别在256nm波长处测定峰面积,求出回归方程:
Y= 57637371.26X-4487.66 r= 1.0000
线性关系数据见表1,塞来昔布峰面积对浓度线性图如图1所示。
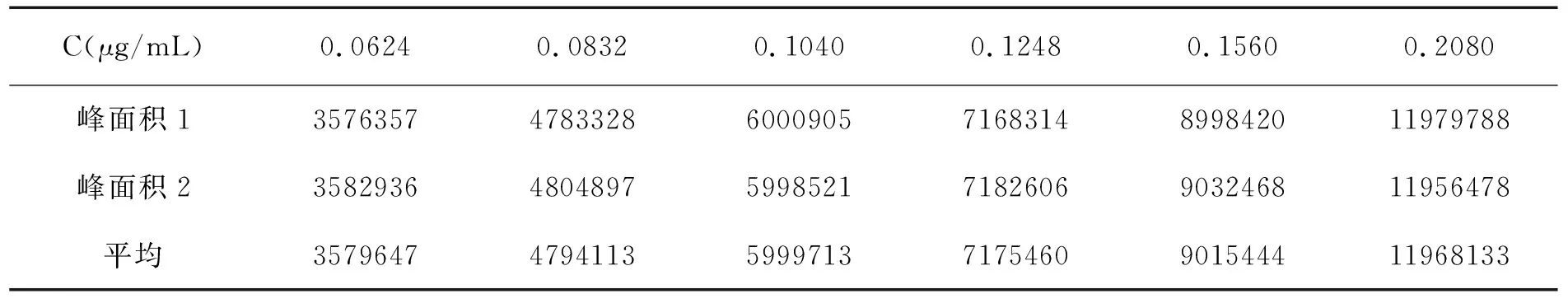
表1 线性关系数据表

图1 塞来昔布线性
实验结果表明,在0.0624mg/mL~0.208mg/mL的质量浓度范围内,峰面积对浓度线性关系良好。
2.4 回收率试验
精密称取处方中主药量的80%、100%、120%和处方中的各辅料适量制成模拟胶囊剂,取模拟胶囊剂细粉适量(约相相当于含塞来昔布160mg、200mg和240mg各3份),精密称定,分别置1000mL溶出杯中,以溶出介质溶解,过滤,吸取续滤液5mL至10mL量瓶中用流动稀释至刻度,摇匀,即得供试品溶液,另取塞来昔布对照品适量,加流动相溶解并稀释制成每1mL含0.1mg的溶液作为对照品溶液,精密量取20ul注入液相色谱仪,并记录色谱图,计算回收率,结果见表2。
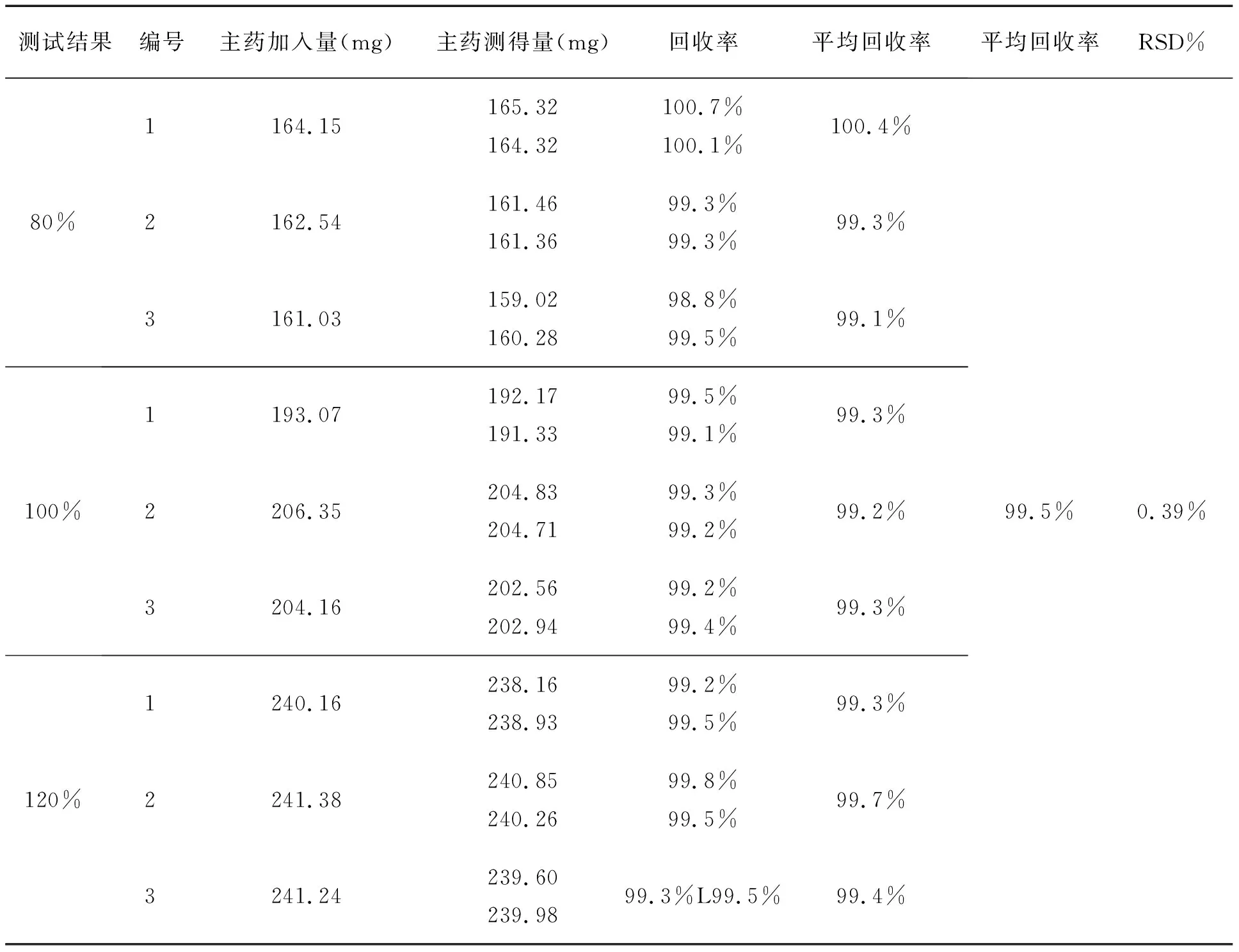
表2 回收率试验结果
由表2中的结果可见,平均回收率为99.5%,RSD为0.39%,表明回收率较好。
2.5 稳定性试验
取本品的溶液,置室温下放置,分别于0、2、4、8、12、24 h测定,峰面积基本不变,表明在24 h内溶液稳定。
3 溶出条件设计
3.1 溶出方法选择
中国药典中规定溶出度的检测方法有转篮法、桨法、小杯桨法,因本品规格为每粒200mg,而舍弃对小杯法的实验研究。对第一法篮法和第二法桨法进行研究和筛选,本品以水(含0.5%十二烷基硫酸钠)为溶出介质,转速50 r/min,照溶出度测定法第一法篮法、第二法桨法进行测定,由测定的结果可知第二法桨法溶出度为91.9%,比第一法篮法溶出量89.6%高,故选用第二法桨法作为本品的溶出方法。
3.2 溶剂的选择
分别以水、0.1mol/L的盐酸溶液、pH6.8的磷酸盐缓冲液中添加十二烷基硫酸钠(浓度分别为0.1% 0.5%、1.0%)HPLC法测定,不同溶剂在同一转速(50 r/min)下的溶出结果见表3。
实验结果表明,胶囊在0.5%十二烷基硫酸钠的稀盐酸溶液和0.5%十二烷基硫酸钠的pH6.8磷酸盐缓冲溶液溶液中溶出不完全,在0.5%、1%十二烷基硫酸钠的水溶液中溶出较完全,故可选用0.5%十二烷基硫酸钠的水溶液。
3.3 转速的选择
取本品以0.5%十二烷基硫酸钠的水溶液为溶剂,分别以50、100 r/min进行实验,结果表明,本品在转速50 r/min、100 r/min溶出相同。从节约能耗和仪器磨损角度出发,故采用转速50 r/min作为本品的溶出度测定转速。
3.4 溶出时间
取本品三批及原研样品,分别照溶出度测定法第二法,以含0.5%十二烷基硫酸钠的水溶液1000mL为溶出介质,转速为每分钟50转,依法操作,分别于5、15、30、45、60分钟时取溶液8mL(同时补充等量溶出介质)滤过,分别精密量取续滤液适量,用溶出介质稀释成每1mL中约含0.1mg的溶液,作为供试品溶液,HPLC法,在256nm波长处分别测定。另取塞来昔布对照品适量,加流动相溶解并稀释制成每1mL含0.1mg的溶液作为对照品溶液,同法测定,计算每粒在不同时间的溶出量,根据时间与溶出量绘制溶出曲线。由表3可见,当取样时间在45 分钟时本样品及原研样品的溶出量均在85%以上。根据原标准中取样时间的规定并考虑到大生产的条件,故本品的取样时间定为45分钟,本品的溶出量限度定为标示量的75%。

表3 溶出介质的筛选
3.5 空白辅料及胶囊壳的干扰性试验
按照处方配比称取除主药外的其他附加剂适量,以含0.5%十二烷基硫酸钠的水溶液1000mL为溶剂,照HPLC法,结果测得,附加剂在256nm处无吸收,表明附加剂对测定无干扰。
3.6 实验结论
取本品适量,照溶出度测定法第二法桨法,以含0.5%十二烷基硫酸钠的水溶液1000mL溶出介质,转速为每分钟50转,依法操作,经45分钟时,取样,滤过,分别精密量取续滤液适量,用流动相稀释成每1mL中约含0.1mg的溶液,作为供试品溶液,照HPLC法,在256nm波长处分别测定。另取塞来昔布对照品,精密称取适量用流动相溶解并稀释制成1mL约含0.1mg的溶液,作为对照品溶液,同法测定,计算每粒在不同时间的溶出量。使用上述方法,操作简便快速、精密度较高、测定结果准确、稳定性良好。
4 结论
在吸取溶出液时应用0.45 μm的滤膜进行过滤,可消除不溶辅料对测定结果的影响。
按照缓释、控释和迟释制剂指导原则规定,释放介质以脱气的新鲜纯化水为常用释放介质,或根据药物的溶解特性、处方特性、吸收部位,使用稀盐酸(0.001~0.1mol/L)或pH3~8的磷酸盐缓冲液,对难溶性药物不宜采用有机溶剂,可加入少量表面活性剂。因为本品在水中极微溶,所以加入适量助溶剂十二烷基硫酸钠溶液助溶。在实验过程中,通过对不同pH值的条件下,不同浓度十二烷基硫酸钠溶液,溶出介质的对比筛选,在发现0.5%十二烷基硫酸钠的稀盐酸溶液;0.5%十二烷基硫酸钠的pH6.8磷酸盐缓冲溶中,溶出不完全,而在0.5%、1%十二烷基硫酸钠的水溶液中溶出较完全,故选用0.5%十二烷基硫酸钠的水溶液作为塞来昔布的溶出介质。
参考文献:
[1] 谭利民.塞来昔布治疗类风湿性关节炎疗效观察[J].中国医学创新, 2012, 9(1): 37-38.
[2] Derry S, Moore R A. Single dose oral celecoxib for acute postoperative pain in adults[J]. Cochrane Database Syst Rev, 2012, 3: 4233.
[3] 方淑贤,刘云海.环氧化酶-2抑制剂:塞来昔布[J].中国药师,2002,5(10):618-621.
[4] 黄建林,吴玉琼,潘云峰.塞来昔布治疗类风湿关节炎和骨关节炎有效性和安全性的临床研究[J].中国药物与临床,2004,12(4):934-938.
[5] 都永强.塞来昔布对急性疼痛的疗效国外医学[J].骨科学,2003,5(24):172-178.
[6] 高洁,曹光,张晓东.HPLC 法测定塞来昔布胶囊中有关物质[J].现代医药与临床,2013,3(2):182-186.
[7] 柯中古,王槐武,郑和国.反相高效液相色谱法测定塞来昔布片含量[J].中国医院药学杂志,2003,23(4):205-208.
