无核葡萄希姆劳特胚挽救中影响胚发育的因子
2014-09-10武书哲田淑芬
武书哲 ,张 娜 ,田淑芬
(1.天津师范大学生命科学学院,天津 300387;2.天津市农业科学院葡萄研究中心,天津 300387;3.天津市葡萄遗传与育种企业重点实验室,天津 300192)
无核葡萄以其食用方便、品质优良在市场上越来越受欢迎,因此选育优质、大粒、无核葡萄品种已成为葡萄育种的重要内容之一。我国的无核葡萄育种多采用传统的杂交方式,即利用有核品种作母本,无核品种作父本,但是其获得无核后代的几率较低,而且育种周期长;三倍体杂交育种虽可以获得无核葡萄,但是二倍体与四倍体的亲和力差,获得杂交后代难度同样很大。1982年,美国葡萄育种学家Ramming等[1]首次报道了利用改良的White培养基进行无核葡萄胚的胚珠内培养,并获得了两株实生苗。自此以后,利用胚挽救技术,将无核葡萄品种做母本,在合子胚败育之前将其取出并在适宜的条件下离体培养,使其继续发育成苗,最终形成完整植株,不仅极大地提高后代的无核率,也加快了无核葡萄的育种速度。
本试验以希姆劳特(欧美杂交种,从日本引入,美国育种,该品种丰产、优质、抗性强、适应性广,在无核葡萄中,属大粒大穗型品种)为母本,与玫瑰香优系(天津市农科院葡萄研究中心从表面上玫瑰香葡萄筛选,较普通玫瑰香品种香气浓郁,果穗松紧度适中,果粒均匀),杂交进行玫瑰香型无核大粒的新品种繁育,研究胚挽救过程中培养基及添加物不同浓度对胚发育的影响,旨在确定适宜无核葡萄希姆劳特的胚挽救幼胚离体培养体系。
1 材料与方法
1.1 试验材料及胚挽救的基本方法
本试验于2013~2014年在天津市农业科学院葡萄研究中心和天津市葡萄遗传与育种企业重点实验室进行。杂交材料为希姆劳特×玫瑰香。
在初花期采集父本的花粉,花前3~4d母本去雄,柱头上开始分泌粘液时授粉,以24h为间隔连续授粉3次。
在葡萄开花授粉后25d起每隔7d对希姆劳特×玫瑰香胚珠的发育及败育势态进行了定期观察。随机取20粒果实,称其浆果单粒重,然后剥开果实,取出胚珠,称取胚珠的平均重量,统计其胚珠平均发育程度及不同时期浆果内的胚珠数。
胚挽救的程序参照王爱玲[2]的方法进行,从剖开的胚珠中选取长度大于2mm的胚珠接种在发育培养基上进行胚珠内胚培养。每个三角瓶(150mL)内接种15个胚珠,培养60d后无菌条件下剖开胚珠,在胚珠喙端发现的白色胚即为发育胚。统计接种胚珠数、胚发育数、胚发育率。胚发育率=胚发育数/接种胚珠数×100%。
1.2 试验方法
1.2.1 不同基本培养基试验
取希姆劳特×玫瑰香授粉后32d的杂交胚珠接种在ER/Nitsch+GA30.5mg/L+IAA1.5mg/L+6-BA0.5mg/L+蔗糖60g/L+活性炭1g/L+琼脂5g/L这两种培养基中,筛选适宜的基本培养基。
1.2.2 培养基中添加不同浓度6-BA的离体培养试验
取希姆劳特×玫瑰香授粉后32d的杂交胚珠接种在 Nitsch+GA30.5mg/L+IAA1.5mg/L+蔗糖60g/L+活性炭1g/L+琼脂5g/L培养基中,其中分别添加不同浓度(0.2、0.5、0.8mg/L)的 6-BA,研究不同浓度的6-BA对胚发育的影响。
1.2.3 培养基中添加不同浓度活性炭的离体培养试验
取希姆劳特×玫瑰香授粉后32d的杂交胚珠接种在 Nitsch+GA30.5mg/L+IAA1.5mg/L+蔗糖60g/L+6-BA0.5mg/L+琼脂5g/L培养基中,其中分别添加不同浓度(1、1.5、3g/L)的活性炭,研究不同浓度的活性炭对胚发育的影响。
2 结果与分析
2.1 希姆劳特果实、胚珠重及胚珠数的变化
通过定期观察胚珠的发育动态,可以看出母本果实重量一直呈增加趋势,胚珠重呈先增加后下降趋势,在授粉后32d胚珠重达到最大。由此可知,希姆劳特胚败育时期在授粉后32d。单粒浆果内发育胚珠的平均数随浆果的逐渐增大而减少,也说明了胚珠的败育逐渐增强(表1)。
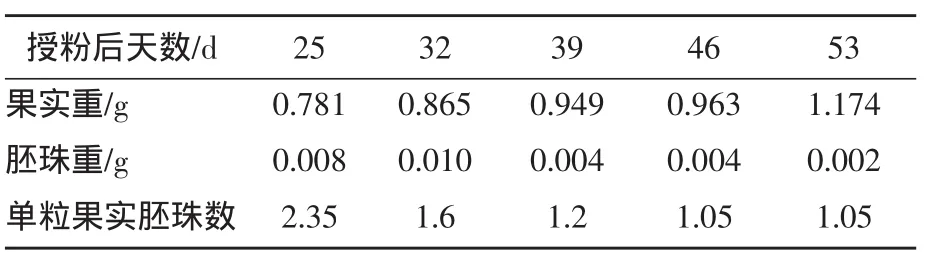
表1 不同时期希姆劳特果实、胚珠重及胚珠数
2.2 不同基本培养基对葡萄离体幼胚发育的影响
通过不同基本培养基离体培养胚珠试验,可以看出希姆劳特×玫瑰香的杂交胚珠在Nitsch培养基中胚发育率明显高于ER,所以希姆劳特幼胚较适宜在Nitsch培养基中培养(表2)。

表2 不同基本培养基对胚发育的影响重及胚珠数
2.3 不同浓度6-BA对葡萄离体幼胚发育的影响
通过培养基中添加不同浓度6-BA的离体培养试验,可以看出0.5mg/L 6-BA的胚发育率最高,为13.33%,其次是0.8mg/L 6-BA,胚发育率为10.67%,而0.2mg/L 6-BA的胚发育率最低,为9.33%(表3)。

表3 不同浓度6-BA对胚发育的影响
2.4 不同浓度活性炭对葡萄离体幼胚发育的影响
通过培养基中添加不同浓度活性炭的离体培养试验,可以看出1g/L活性炭的胚发育率最高,为13.33%,其次是1.5g/L活性炭的胚发育率为5.33%,而3g/L活性炭的胚发育率最低,为5.17%(表4)。

表4 不同浓度活性炭对胚发育的影响
3 讨论
胚挽救技术虽然使无核葡萄生物育种成为可能,但是它目前仍然存在很多问题,成苗率低,技术要求高,胚挽救苗较弱等,如何提高胚挽救过程中胚发育率,是提高无核育种技术效率的关键技术环节。
培养基在胚珠离体培养条件下可以提供幼胚继续发育所需的营养物质和激素,是影响胚挽救是否成功的重要因素之一[1]。郝燕、田莉莉[3-4]经过试验研究认为,在胚珠培养阶段使用ER固-液双相培养基胚发育较好。而唐冬梅[5]则认为,MM3作为胚发育培养基效果最好。蒋爱丽等则育成了胚培的新品种[6]。
未成熟葡萄幼果中含有较多的酚类物质,使得在胚挽救中发生严重褐变,从而降低胚挽救成苗率。活性炭有助于降低胚珠褐化的几率[7-8]。虽然活性炭有吸附作用,可以吸收有害物质,但也可能吸收培养基中的营养物质,因此要适量添加,一般为0.1%~0.3%。Nookaraju[9]发现在圆锥花序上喷涂吡效隆(CPPU)并且在胚珠培养基中添加丙烯酸丙酯(BA)可以提高胚珠败育型葡萄的胚挽救效率。
本研究确定了适宜无核葡萄希姆劳特的胚挽救幼胚离体培养体系:无核葡萄希姆劳特品种适宜用含 GA30.5mg/L、蔗糖 60g/L、琼脂 5g/L、pH值5.8的Nitsch培养基作胚珠发育培养基,添加0.5mg/L 6-BA、1.0mg/L活性炭,胚发育率最高,达到13.33%。此结果为进一步研究利用无核葡萄希姆劳特胚挽救选育玫瑰香型大粒无核葡萄技术奠定了基础。
[1]Ramming D-W,Emershad R L.In-ovule embryo culture of seeded and seedlessVitis vinifera(Abst)[J].Hortseience,1982,17(3):487.
[2]王爱玲,王跃进,唐冬梅,等.提高无核葡萄胚挽救中幼胚成苗率的研究[J].中国农业科学,2010,43(20):4238-4245.
[3]郝燕,杨瑞,王鸿,等.无核葡萄剥胚胚挽救技术关键影响因子[J].西北农业学报,2013,(9).
[4]田莉莉.抗病无核葡萄胚挽救育种及种质创新[D].陕西安:西北农林科技大学,2007.
[5]唐冬梅,王跃进,赵荣华,等.我国研究出无核葡萄育种新技术[J].吉林农业农村经济信息,2005,(8):47.
[6]蒋爱丽,李世诚,金佩芳,等.胚培无核葡萄新品种—沪培 1号[J].果树学报,2007,24(3):402-403.
[7]郭印山.葡萄胚败育机理与胚挽救技术研究[D].沈阳:沈阳农业大学,2006.
[8]田莉莉.抗病无核葡萄胚挽救育种及种质创新[D].西安:西北农林科技大学,2007.
[9]ANookaraju,M S Barreto,G S Karibasappa,et al.Synergistic effect of CPPU and benzyladenine on embryo rescue in six stenospermocarpic cultivars of grapevine[J].Vitis,2007,46(4):188-191.
