罗汉果甜苷Ⅴ合成生理规律的研究
2014-09-10莫长明王海英马小军唐其万凌云翟勇进
莫长明,王海英,马小军,唐其,万凌云,翟勇进
(1广西大学农学院,广西南宁 530004;2广西药用植物园广西药用资源保护与遗传改良重点实验室,
广西南宁 530023;3中国医学科学院药用植物研究所,北京 100193;4天津中医药大学中药学院,天津 300193; 5四川省中医药科学院,四川成都 610041)
罗汉果甜苷Ⅴ合成生理规律的研究
莫长明1,2,王海英3,4,马小军1,3,唐其2,万凌云5,翟勇进2
(1广西大学农学院,广西南宁 530004;2广西药用植物园广西药用资源保护与遗传改良重点实验室,
广西南宁 530023;3中国医学科学院药用植物研究所,北京 100193;4天津中医药大学中药学院,天津 300193; 5四川省中医药科学院,四川成都 610041)
【目的】探讨罗汉果甜苷Ⅴ合成生理规律.【方法】通过不同品种以及遮阴、气调贮藏、低温贮藏比较试验,分析罗汉果苷类和糖类代谢的关系,以及光合作用、呼吸作用、温度对它们代谢的影响.【结果和结论】不同品种罗汉果和遮阴果实均在30 d时只含罗汉果苷ⅡE、苷Ⅲ,蔗糖、葡萄糖含量较低,30~70 d时罗汉果苷ⅡE、苷Ⅲ迅速减少、消失,蔗糖、葡萄糖含量持续升高,甜苷Ⅴ出现并急剧积累接近最高含量,70~90 d时仅含甜苷Ⅴ,蔗糖含量继续升高,葡萄糖含量则明显下降;但是,光合速率高的品种果实葡萄糖和甜苷Ⅴ含量也高;遮阴使叶片光合速率降低,果实葡萄糖和甜苷Ⅴ含量却均升高;气调和低温贮藏均促进果实葡萄糖积累,而抑制甜苷Ⅴ合成.这些结果表明,罗汉果甜苷Ⅴ由低糖苷与葡萄糖逐渐结合转化而来,通过调控生育后期叶片光合速率与果实呼吸来增加葡萄糖量不能促进其合成积累,其合成积累所需葡萄糖量是充足的,主要限制因子可能是低糖苷量和合成关键酶活性.
罗汉果;甜苷Ⅴ;葡萄糖;光合速率;酶活性
中国特有植物罗汉果Siraitia grosvenorii为驰名中外的中药材,果实味甘、性凉,具止咳祛痰、凉血舒胃、润肠通便[1]、抗氧化[2]、抗癌[3]、免疫调节[4]、降血糖[5]等功效,是“罗汉果定喘片”、“罗汉果止咳露”、“金嗓子喉宝”等数十种著名中成药与保健品的重要原料.其主要活性成分甜苷Ⅴ[6]为低热[7]、无毒[8-9]、高甜度[10]、不引发龋齿[11]的纯天然甜味剂,可为糖尿病和肥胖病患者食用,开发应用受到广泛关注.但罗汉果果实中的种子太多,甜苷Ⅴ仅存在于果肉中[12],因而含量很低,鲜果中甜苷Ⅴ的质量分数仅为0.3%~0.4%,致使甜苷Ⅴ生产和使用成本太高,无法与蔗糖等竞争,应用范围受到严重制约.甜苷Ⅴ提取得率已达80.0%~90.0%,因此通过改进提取工艺降低成本的潜力有限,加之罗汉果适宜栽培区域狭窄,不宜连茬,亟待寻找提高罗汉果甜苷Ⅴ生产效率的新理论、新方法.20世纪80年代,日本学者竹本常松等分离得到罗汉果苷ⅡE、苷Ⅲ、苷Ⅳ和甜苷Ⅴ[13].苷ⅡE、苷Ⅲ、苷Ⅳ和甜苷Ⅴ随着果实发育依次积累出现,甜苷Ⅴ分子由苷元(罗汉果醇)与5个葡萄糖连接而成,与低糖苷的差异仅在苷元C3和C24上连接的葡萄糖数目和方式不同,生物合成的唯一糖类底物是光合作用直接产物葡萄糖[14].果实中的糖主要来自叶片的光合产物[15].甜苷Ⅴ是否由低糖苷与葡萄糖结合转化而来?葡萄糖的积累与代谢对甜苷Ⅴ合成影响如何?增强叶片光合作用是否会增加果实中葡萄糖积累促进甜苷Ⅴ合成?这些基本问题仍不清楚.针对这些问题,本研究通过不同品种以及遮阴、气调贮藏与低温贮藏比较试验,分析罗汉果甜苷Ⅴ合成积累与叶片光合、果实糖代谢、果实呼吸等因素的关系,探讨罗汉果甜苷Ⅴ合成的生理规律,为培育高甜苷Ⅴ含量新品种以及改进栽培、采后处理技术和提高药材品质提供理论依据和方法.
1 材料与方法
1.1 材料种植
1.1.1 高苷与低苷品种比较试验以罗汉果甜苷Ⅴ高含量品种‘农院B6’和低含量品种‘野红1号’为材料,4月中旬,于广西南宁广西药用植物科研试验基地,按随机区组试验设计,重复3次,每个小区定植10株,田间栽培管理参照杭玲等[16]方法,8月初的盛花期进行人工授粉挂牌.
1.1.2 遮阴试验以‘农院B6’品种为材料,设置不遮阴(对照)和遮阴2种处理,定植、田间管理和授粉挂牌同1.1.1.遮阴处理于授粉后30(果实定型)~90 d(果实成熟)进行,在冠层叶片上方1.0 m处,采用黑色遮阳网搭建荫棚,对小区植株进行遮阴,用照度计反复测定控制透光率为70%.
1.1.3 气调和低温贮藏试验分别以‘农院B6’和‘永青1号’品种为试验材料,每个品种随机种植15株,田间管理和授粉挂牌同1.1.1.
1.2 样品采集制备
1.2.1 高苷与低苷品种比较试验果实发育到30、50、70和90 d时,于各处理的每一重复小区,分别随机采集二级蔓第3~5节位的果实5个,迅速回到室内取出果肉,混合作为一个样品,液氮速冻后储存于-80℃冰箱,用于测定罗汉果苷和糖含量.
1.2.2 遮阴试验遮阴试验的样品采集制备方法同1.2.1.
1.2.3 气调贮藏试验以空气贮藏为对照组,采集‘农院B6’品种40 d果实,放入聚乙烯塑料袋,充入钢瓶盛装的体积分数为15%的CO2混合气体(其余气体为N2),密封袋口,于常温下分别贮藏15和45 d,每个处理20个果实.
1.2.4 低温贮藏试验采集‘永青1号’品种60和70 d果实,分别于5、10和15℃贮藏15 d,每个处理20个果实.
1.3 样品测定方法
1.3.1 光合与温度测定在果实发育30、50、70和90 d时的上午9:30—11:00,于二级蔓的第4~6片叶间随机选取生长良好的3片叶,采用CI-310便携式光合仪(美国CID公司)测定叶片净光合速率,叶面积6 cm2,LED光源光合有效辐射1 100.00 μmol·m-2·s-1.荫棚下温度采用温度计测定.
1.3.2 苷含量测定精确称取1 g果肉冻干粉(过 40目筛),按照刘金磊等[17]方法进行罗汉果苷ⅡE、苷Ⅲ、苷Ⅳ和苷Ⅴ含量测定.
1.3.3 糖含量测定称取0.1 g果肉冻干粉,加入1 mL体积分数为80%的乙醇,研磨成匀浆,倒入离心管中,再用4 mL体积分数为80%的乙醇洗净研钵,倒入离心管中.将匀浆液80℃水浴保温10 min,7 500 r·min-1离心10 min,收集上清液于蒸发皿中.残留物再用5 mL体积分数为80%乙醇重复提取2次,然后将装有3次上清混合液的蒸发皿85℃水浴蒸干,再加2 mL蒸馏水溶解,经7 500 r·min-1离心10 min后,上清液经过SEP-C18(Supelclean ENVI C18 SPE)萃取柱和0.22 μm微孔滤膜过滤,滤液用于可溶性糖、蔗糖、葡萄糖测定.用高氯酸法提取淀粉[18],于提取可溶性糖后的残留物中加5 mL体积分数为30%的高氯酸,混匀后,80℃水浴20 min(用碘液测试淀粉,待溶液颜色不变蓝说明淀粉分解完全),7 500 r·min-1离心10 min,取上清液,用于淀粉含量测定.可溶性糖、淀粉含量参照徐迎春等[18]蒽酮比色法于620 nm下测定,根据葡萄糖标准曲线计算出样品的可溶性糖、淀粉含量.蔗糖、葡萄糖含量用高效液相色谱-示差折光检测法测定.液相色谱仪:Waters测定系统;色谱柱:Waters Sugar-Pak-Ⅰ(6.5 mm×300 mm);柱温:75℃;示差折光检测器;流动相:脱气后的重蒸水;流速0.5 mL/min;进样量:20 μL.
1.3.4 酶活性测定酶溶液参照Keller等[19]方法制备,透析后用于α-淀粉酶(AM)、酸性转化酶(AI)、蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)活性的测定.淀粉酶活性按照Merlo等[20]方法测定,酸性转化酶活性参照Moron等[21]方法测定,蔗糖合成酶(合成方向,SSS)和蔗糖磷酸合成酶活性参照Zhu等[22]方法测定,蔗糖合成酶(分解方向,SSC)活性参照赵智中等[23]方法测定,酶活性以单位鲜质量样品单位时间内催化生成产物的量表示.

其中,ρ1为根据标准曲线计算出的葡萄糖质量浓度(μg/mL);M1为葡萄糖的摩尔质量(g/mol);V1为反应终体积(mL);V2为酶提取液的总体积(mL);m1为样品鲜质量(g);V3为反应时所加酶液的体积(mL);t1为反应时间(h);ρ2为根据标准曲线算出的蔗糖质量浓度(μg/mL);M2为蔗糖的摩尔质量(g/mol).
1.3.5 呼吸强度与果实硬度测定果实硬度采用GY-3硬度计测定:每个处理抽取6个果实,于果实中部对称测定3处,以探针穿破果皮为标准.呼吸强度采用滴定法测定:吸取0.4 mol/L的NaOH溶液10 mL于培养皿中,置于呼吸室内的隔板上,装入6个已称质量且气调贮藏15或45 d的果实,静置1 h后,取出培养皿,将碱液迅速转移入三角瓶中,加5 mL饱和BaCl2,滴加酚酞指示剂(10 mg/mL)2滴,用0.1 mol/L的草酸溶液进行滴定.以同样方法做空白滴定.呼吸强度以单位质量果实在单位时间内呼吸释放的CO2的质量表示.

其中,V4为空白消耗草酸的体积(mL);V5为样品消耗草酸的体积(mL);c为草酸浓度(mol/L);M3为CO2的摩尔质量(g/mol);m2为样品鲜质量(kg);t2为呼吸测定时间(h).
1.4 数据统计分析
数据平均值计算采用EXCEL2003软件,差异显著性统计分析采用SPSS 13.0软件.
2 结果与分析
2.1 高、低甜苷品种罗汉果的苷与糖积累动态
由表1可知发育30~90 d的高甜苷品种‘农院B6’(苷Ⅴ质量分数为4.25%)和低甜苷品种‘野红1号’(苷Ⅴ质量分数为3.40%)罗汉果果实的苷、糖积累变化.30 d果实主要含低糖苷苷ⅡE、苷Ⅲ,随着30~70 d果实苷ⅡE、苷Ⅲ的迅速减少、消失,50~70 d果实高糖苷苷Ⅳ、苷Ⅴ开始积累,虽然苷Ⅳ很快减少、消失,但苷Ⅴ迅速积累,且接近最高含量,70~90 d果实则只可检测到苷Ⅴ;淀粉含量急剧下降(降解),可溶性糖含量则急剧上升(积累),其中可溶性糖的主要组分蔗糖含量持续上升,葡萄糖含量则先升后降(70 d后出现明显下降).然而,除淀粉含量外,‘农院B6’与‘野红1号’品种间叶片净光合速率以及果实苷ⅡE、苷Ⅲ、苷Ⅳ、苷Ⅴ、可溶性糖、蔗糖和葡萄糖含量存在显著差异.尤其,在甜苷Ⅴ主要积累期(50~90 d),‘农院B6’品种叶片净光合速率和果实可溶性糖、蔗糖、葡萄糖含量均显著或极显著高于‘野红1号’.这些显示,不同甜苷含量品种的苷、糖积累动态变化规律一致,光合效率高品种的葡萄糖含量高,甜苷Ⅴ含量也相应较高.
2.2 遮阴对罗汉果苷与糖积累的影响
表2显示,遮阴处理50 d时叶片净光合速率与对照无显著差异,但70~90 d时则显著或极显著低于对照.遮阴处理与对照30~90 d果实苷、糖积累动态变化规律一致,同高、低苷品种的积累动态变化规律.除淀粉含量外,遮阴处理各苷含量和可溶性糖、蔗糖、葡萄糖含量与对照均存在明显差异,其中50 d果实苷ⅡE、苷Ⅲ含量分别极显著和显著高于对照,苷Ⅳ、苷Ⅴ含量则均极显著低于对照,但70~90 d果实苷Ⅴ含量均极显著高于对照,且增幅也大大高于对照;70~90 d果实可溶性糖、蔗糖含量显著或极显著低于对照,50~90 d果实葡萄糖含量显著高于对照.这些说明,遮阴显著降低了罗汉果叶片净光合速率,延缓了果实苷ⅡE、苷Ⅲ消耗和苷Ⅳ、苷Ⅴ合成积累,降低了果实可溶性糖、蔗糖含量,但显著提高了果实葡萄糖含量和苷Ⅴ含量.
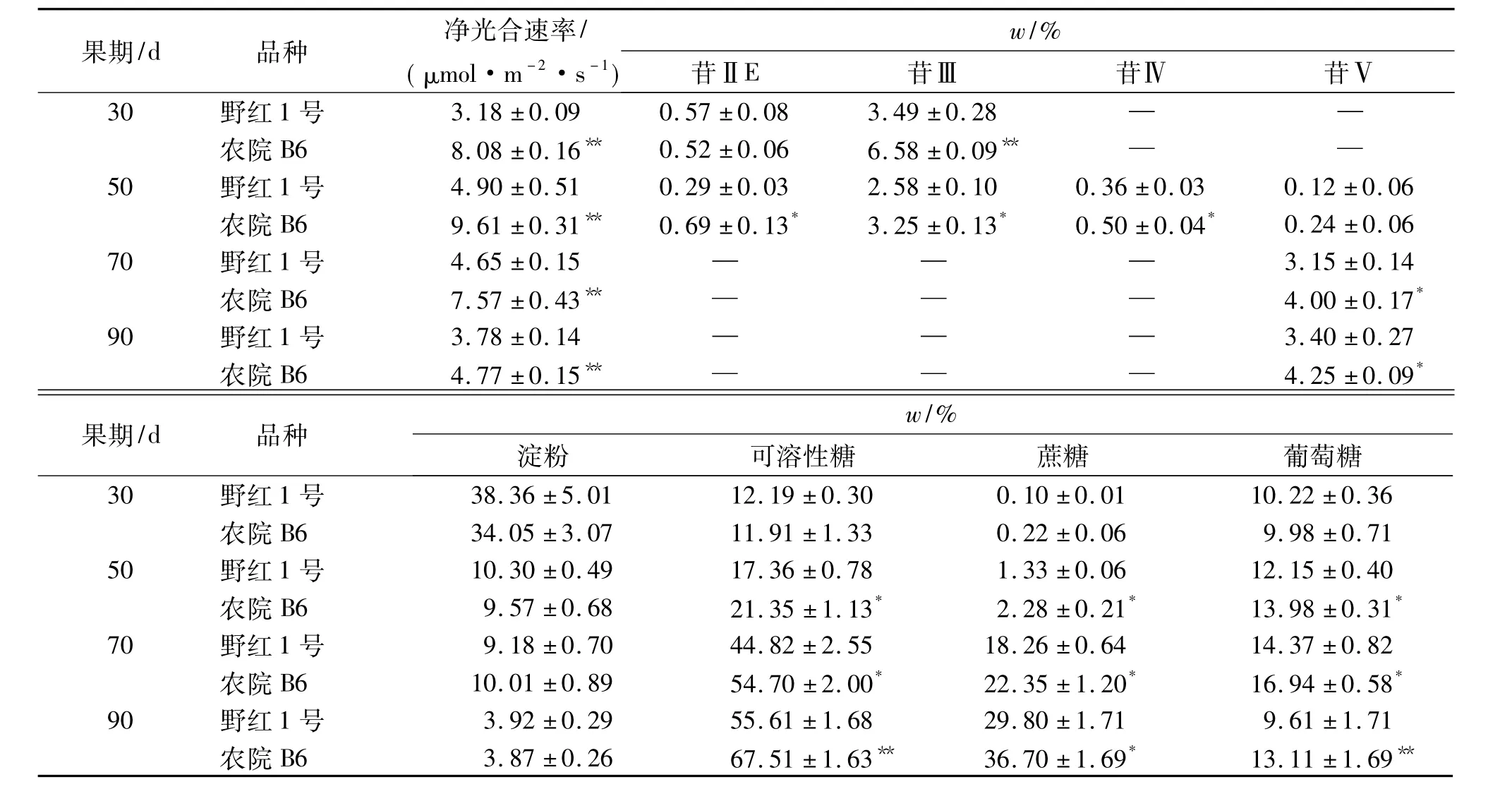
表1 不同品种罗汉果苷和糖含量变化1)Tab.1 Mogroside and saccharide content changes in different Siraitia grosvenorii varieties
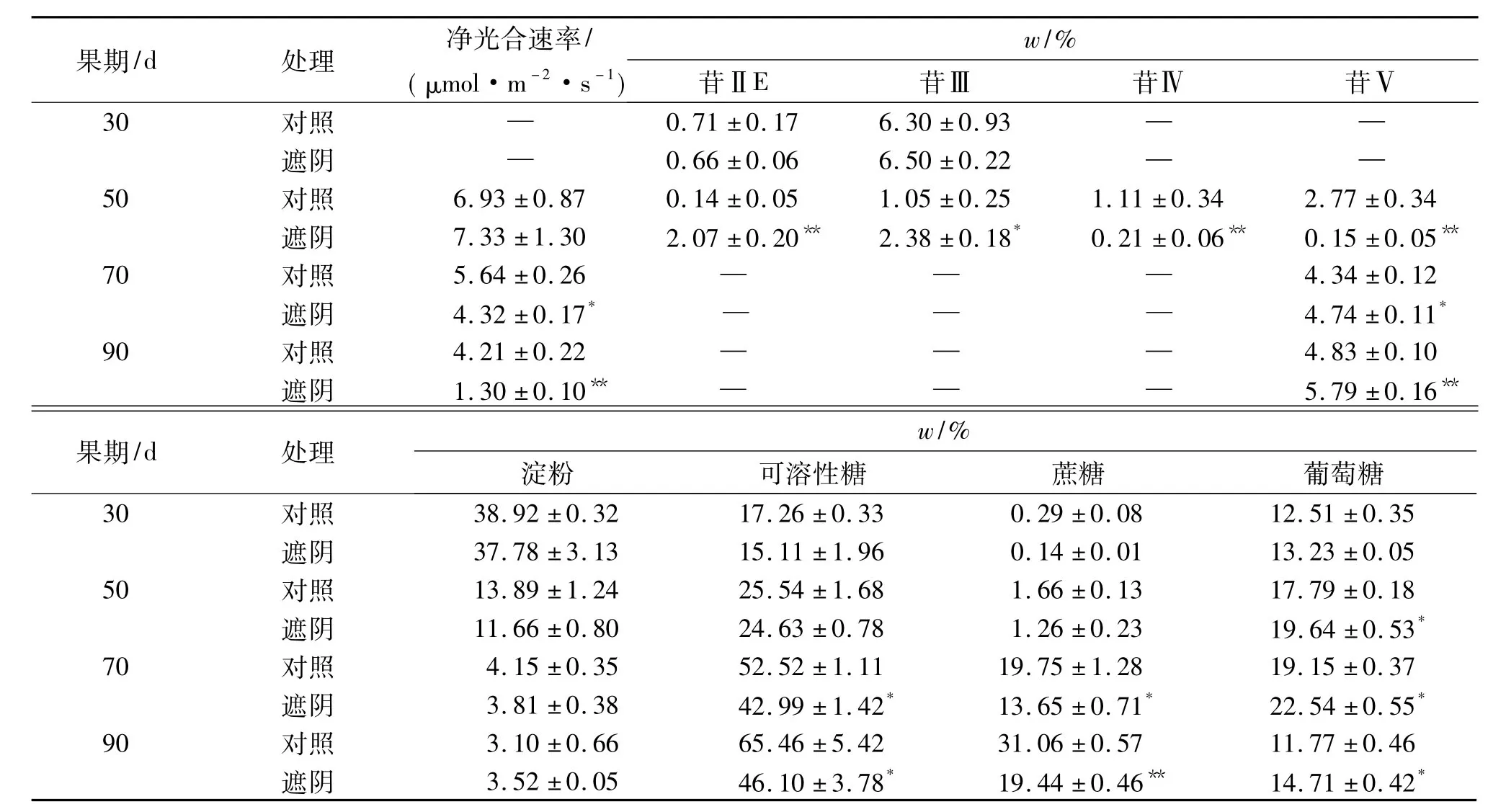
表2 遮阴下的罗汉果苷和糖含量变化1)Tab.2 Mogroside and saccharide content changes in shading
表3显示,与对照相比,遮阴未改变果实发育30~90 d糖代谢酶活性动态变化规律,即α-淀粉酶活性呈上升趋势,与蔗糖合成相关的酶蔗糖磷酸合成酶和蔗糖合成酶(合成方向)活性也均呈上升趋势,与蔗糖分解相关的酶酸性转化酶和蔗糖合成酶(分解方向)活性则呈下降趋势.但除α-淀粉酶和蔗糖合成酶(合成方向)活性外,遮阴处理的蔗糖磷酸合成酶、酸性转化酶和蔗糖合成酶(分解方向)活性则均与对照存在显著差异,其中70~90 d果实的蔗糖磷酸合成酶活性显著低于对照,50~90 d果实的酸性转化酶和蔗糖合成酶(分解方向)活性显著或极显著高于对照.这些说明,30~90 d时,罗汉果将增强α-淀粉酶活性使淀粉分解消耗,增强蔗糖磷酸合成酶和蔗糖合成酶(合成方向)活性,降低酸性转化酶和蔗糖合成酶(分解方向)活性,促进蔗糖合成积累,遮阴则会阻碍蔗糖磷酸合成酶活性增强和酸性转化酶、蔗糖合成酶(分解方向)活性降低,从而减少蔗糖合成积累.
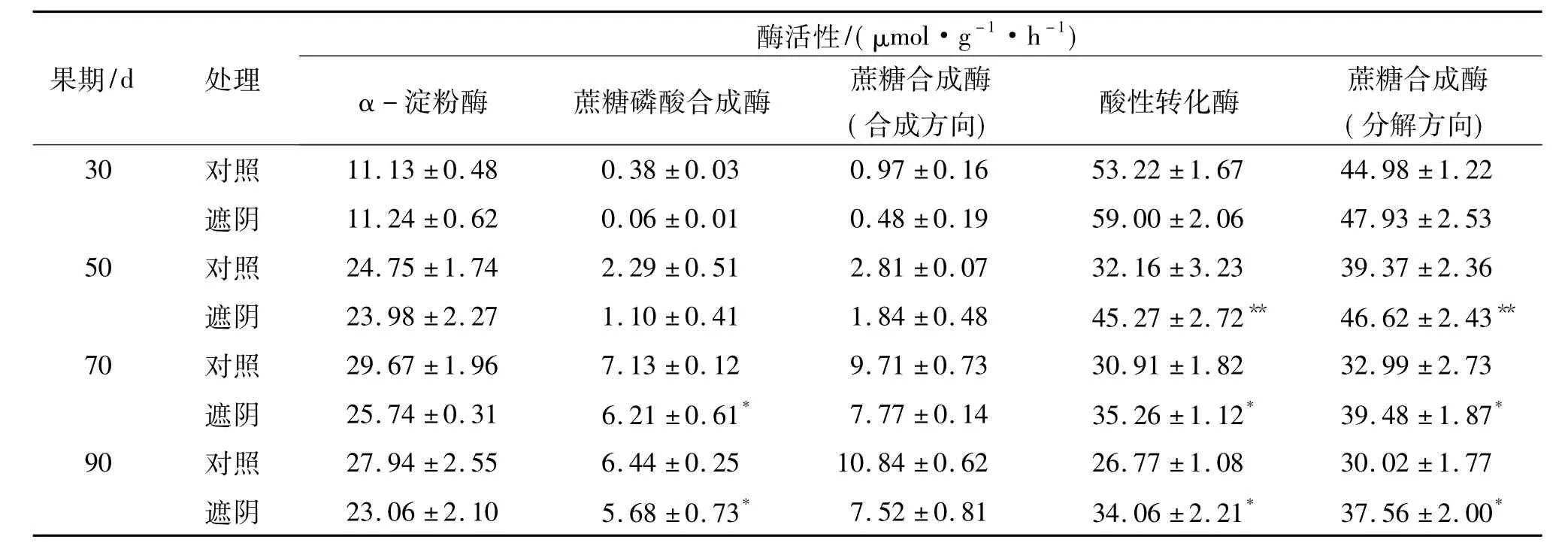
表3 遮阴下的罗汉果糖代谢酶活性变化1)Tab.3 The changes of saccharide metabolizing enzymatic activities in shading
2.3 呼吸对罗汉果苷与糖积累的影响
表4显示,CO2贮藏15 d果实在空气中呼吸强度与对照相近,CO2贮藏45 d果实在空气中呼吸强度则明显高于对照,在贮藏15~45 d期间,对照果实呼吸强度大幅降低,CO2贮藏果实则大幅升高;CO2贮藏15 d果实的苷Ⅱ、苷Ⅲ、苷Ⅳ含量均高于对照,45 d时CO2贮藏与对照果实的苷Ⅱ、苷Ⅲ和苷Ⅳ含量均减少、消失;CO2贮藏果实的苷Ⅴ和可溶性糖、蔗糖、葡萄糖含量均低于同期的对照,在贮藏15~45 d期间,CO2贮藏与对照果实的苷Ⅴ、蔗糖含量均升高,可溶性糖、葡萄糖含量均降低,且对照果实苷Ⅴ含量增幅大,葡萄糖含量降幅也大,CO2贮藏果实苷Ⅴ含量增幅小,葡萄糖含量降幅也小.这些表明,减少果实呼吸会促进葡萄糖积累,抑制苷Ⅴ合成积累,但未改变各处理果实随苷Ⅱ、苷Ⅲ迅速减少、消失和苷Ⅴ急剧合成积累而葡萄糖含量明显下降的变化规律,葡萄糖含量减少幅度随苷Ⅴ含量升高幅度增大而增大,其减少非呼吸消耗所致.
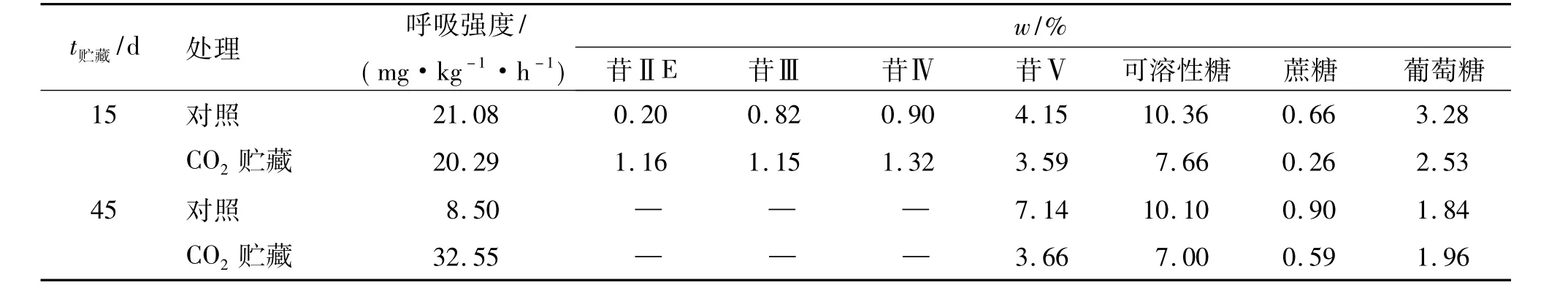
表4 气调贮藏下的罗汉果苷和糖含量变化Tab.4 Mogroside and saccharide content changes in gas storing conditions
2.4 温度对罗汉果苷与糖积累的影响
表5显示,随着贮藏温度升高,60和70 d离体果实硬度和葡萄糖含量均降低,苷Ⅴ和蔗糖、可溶性糖含量均升高,且70 d果实苷Ⅴ含量增加幅度大于60 d果实,葡萄糖含量降低幅度也大于60 d果实;所有处理苷ⅡE、苷Ⅲ、苷Ⅳ都未检出.这些表明,低温贮藏下,升高温度明显促进果实后熟和甜苷Ⅴ合成积累,使葡萄糖因消耗而减少且加剧,葡萄糖减少幅度随苷Ⅴ含量升高幅度增大而增大.相反,随着贮藏温度降低,则将延缓果实后熟和抑制甜苷Ⅴ合成积累,促使葡萄糖积累增加.
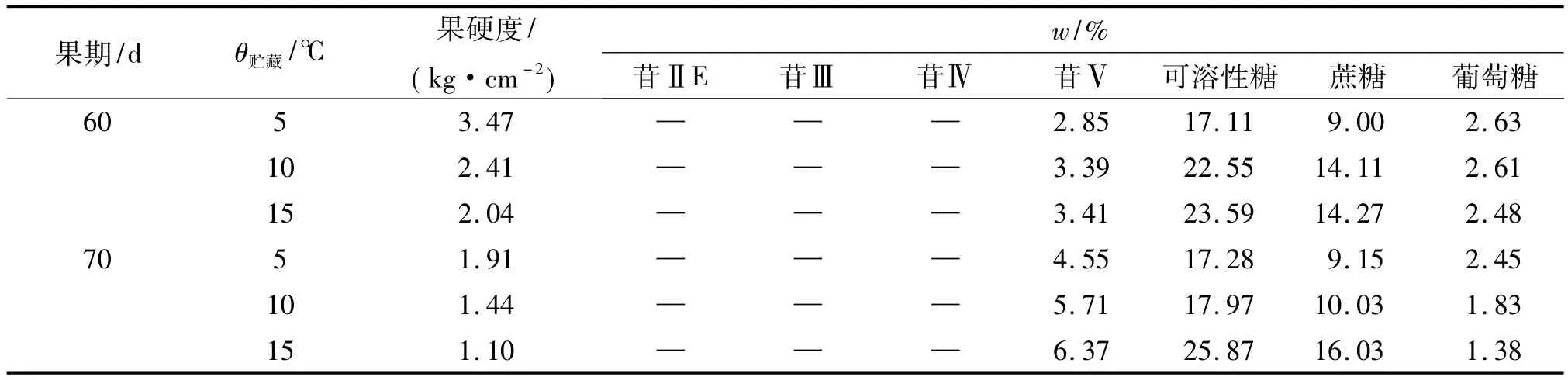
表5 不同低温贮藏下的罗汉果苷和糖含量变化Tab.5 Mogroside and saccharide content changes in different low temperature storing conditions
3 讨论
李典鹏等[14]TLC检测5~85 d罗汉果果实发现,苷ⅡE、苷Ⅲ、苷Ⅳ和苷Ⅴ随着果实发育依次出现.刘金磊等[17]HPLC法进一步研究表明,5 d果实即可检测到苷ⅡE、苷Ⅲ,50 d前果实仅检测到苷ⅡE、苷Ⅲ,60 d后果实则仅检测到苷Ⅴ,苷ⅡE、苷Ⅲ、苷Ⅴ依次主要存在于5~30、30~50、60~85 d果实.本研究中不同品种和不同遮阴条件下,果实中罗汉果苷、糖积累规律一致,即30 d果实主要含低糖苷苷ⅡE、苷Ⅲ,随着30 d~70 d果实苷ⅡE、苷Ⅲ的迅速减少、消失,50~70 d果实高糖苷苷Ⅳ、苷Ⅴ开始积累出现,虽然苷Ⅳ很快减少、消失,但苷Ⅴ迅速积累接近最高含量,70~90 d果实则只可检测到苷Ⅴ,与二者研究结果类似;30~90 d果实的淀粉逐渐分解,转化为葡萄糖、蔗糖等可溶性糖,葡萄糖含量先升后降(70 d后含量出现明显下降),气调和低温贮藏试验进一步表明葡萄糖含量下降不是呼吸消耗所致,且其下降幅度随苷V合成积累量增加幅度增大而增大.糖类可作为重要信号调节次生代谢产物的生成[24].因此,罗汉果甜苷Ⅴ生物合成与低糖苷、葡萄糖代谢密切相关,其可能是在葡萄糖积累信号诱导下,以苦味低糖苷苷ⅡE为前体物,依次与葡萄糖结合,经由苷Ⅲ、苷Ⅳ等转化而成.
光合作用的直接产物是葡萄糖.本研究中高光合效率品种‘农院B6’果实的葡萄糖含量高,甜苷Ⅴ含量也高,但是遮阴条件下降低了叶片净光合速率,果实葡萄糖、甜苷Ⅴ含量却升高.气调贮藏减少果实呼吸促进葡萄糖积累,却抑制苷V合成积累.这与增强叶片光合效率和减少果实呼吸,将增加果实葡萄糖含量,从而提高甜苷Ⅴ含量的预期结果相反,说明调控生育后期叶片光合速率和果实呼吸增加葡萄糖量不能促进其合成积累.虽然遮阴果实甜苷Ⅴ含量升高,葡萄糖含量也升高,但随着果实发育,不同品种和遮阴果实,蔗糖含量均持续急剧上升,且成熟时(90 d)葡萄糖含量仍达10%左右,减少、消失的是苷ⅡE、苷Ⅲ等低糖苷,故认为葡萄糖量对甜苷Ⅴ合成需求是充足的,无需过度消耗储存的蔗糖来加以补充,供应不足的可能是低糖苷.遮阴使甜苷Ⅴ含量增加的原因可能是罗汉果喜阴凉环境,露天栽培气温太热,遮阴降低了生境温度,植株处于最佳生长温度24~26℃,增强了甜苷Ⅴ合成关键酶活性所致.果实低温贮藏降低酶活性,甜苷V合成则明显受到抑制.再有,Tang等[25]报道,50~70 d甜苷V急剧积累期,果实中调控罗汉果苷元前体合成的鲨烯环氧酶(SQE)、葫芦二烯醇合酶(CS)和苷元糖基化的葡萄糖基转移酶(UDPG)基因表达水平大幅上调或下调.因此,甜苷Ⅴ生物合成可能主要受到低糖苷量不足和限速酶活性影响.高光合效率品种果实甜苷Ⅴ含量高,可能是其低糖苷合成和相关葡萄糖基转移酶活性也较高所致.
综上所述,罗汉果甜苷Ⅴ由低糖苷与葡萄糖逐渐结合转化而成,调控生育后期叶片光合和果实呼吸增加葡萄糖量不能促进其合成积累,其合成积累主要限制因子可能是低糖苷量和合成关键酶活性.选择高光合效率品种,于凉爽生态区进行栽培或利用基因工程技术调控SQE、CS、UDPG等关键酶基因过表达,促进低糖苷合成及其与葡萄糖结合,将有利于改善罗汉果甜苷品质.
[1]国家药典委员会.中华人民共和国药典:第1部[M].北京:中国医药科技出版社,2010:197.
[2]戚向阳,陈维军,张俐勤,等.罗汉果皂甙清除自由基及抗脂质过氧化作用的研究[J].中国农业科学,2006,39(2):382-388.
[3]TAKASAKI M,KONOSHIMA T,MURATA Y,et al.Anticarcinogenic activity of natural sweeteners cucurbitane glycosides fromMomordica grosvenori[J].Cancer Lett,2003,198(1):37-42.
[4]陈维军,宋方方,刘烈刚,等.罗汉果皂甙提取物对1型糖尿病小鼠细胞免疫功能的影响[J].营养学报,2006,28(3):221-225.
[5]戚向阳,陈维军,宋云飞,等.罗汉果对糖尿病小鼠的降血糖作用[J].食品科学,2003,24(12):124-127.
[6]刘婷,王旭华,李春,等.罗汉果皂苷V的镇咳、祛痰及解痉孪作用研究[J].中国药学杂志,2007,42 (20):1534-1536.
[7]SUZUKI Y A,MURATA Y,INUI H,et al.Triterpene glycosides ofSiraitia grosvenoriinhibit rat intestinal maltase and suppress the rise in blood glucose level after a single oral administration of maltose in rats[J].J Agric Food Chem,2005,53(8),2941-2946.
[8]JIN Meilan,MUGURUMA M,MOTO M,et al.Thirteenweek repeated dose toxicity ofSiraitia grosvenoriextract in Wistar Hannover(GALAS)rats[J].Food Chem Toxicol,2007,45(7):1231-1237.
[9]XU Qing,SU Xiaojian,LIANG Ronggan,et al.Subchronic 90-day oral(gavage)toxicity study of a Luo Han Guo mogroside extract in dogs[J].Food Chem Toxicol,2006,44(12):2106-2109.
[10]RYOJI K,NIE R L,KENJI N,et al.Sweet cucurbitaneglycosides from fruits ofSiraitia siamensis(chi-ziluo-hanguo):A Chinese folk medicine[J].Agric Biol Chem,1989,53(12):3347.
[11]KINGHORN A D,KANEDA N,BAEK N I,et al.Noncariogenic intense natural sweeteners[J].Med Res Rev,1998,18(5):347-360.
[12]苏小建,刘国雄,聂晓,等.罗汉果甜甙V在各部位的含量分布[J].食品科技,2007(5):76-78.
[13]李峰,李典鹏,蒋水元,等.罗汉果栽培与开发利用[M].北京:中国林业出版社,2003:113.
[14]李典鹏,陈月圆,潘争红,等.不同生长日龄罗汉果甙类成分变化研究[J].广西植物,2004,24(6):546-549.
[15]赵智中.柑橘果实糖积累的生理基础研究[D].杭州:浙江大学,2001.
[16]杭玲,苏国秀,夏阳升,等.罗汉果组培苗栽培技术[J].广西农业科学,2003(6):70-72.
[17]刘金磊,李典鹏,黄永林,等.HPLC法测定不同生长期罗汉果甙ⅡE、Ⅲ、Ⅴ的含量[J].广西植物,2007,27(4):665-668.
[18]徐迎春,李绍华,柴成林,等.水分胁迫期间及胁迫解除后苹果树源叶碳同化物代谢规律的研究[J].果树学报,2001,18(1):1-6.
[19]KELLER F,LUDLOW M M.Carbohydrate metabolism in drought-stressed leaves of pigeonpea(Cajanus cajanL.)[J].J Exp Bot,1993,44(8):1351-1359.
[20]MERLO L,PASSER C.Changes in carbohydrate and enzyme levels during development of leaves ofPrunus persica,a sorbitol synthesizing species[J].Plant Physiol,1991,83(4):621-626.
[21]MORON D,SCHAFF A A.Sucrose phosphate synthase,sucrose synthase,and acid invertase activities in developing fruit ofLycopersicon escufenfumMill.and the sucrose accumulatingLycopersicon hirsutumHumb.and Bonpl.[J].Plant Physiol,1991,95(2):623-627.
[22]ZHU Y J,EWALD K,PAUL H M.Sucrose accumulation in the sugarcane stem is regulated by the difference between the activities of soluble acid invertase and sucrose phosphate synthase[J].Plant Physiol,1997,115(2):609-616.
[23]赵智中,张上隆,徐昌杰,等.蔗糖代谢相关酶在温州蜜柑果实糖积累中的作用[J].园艺学报,2001,28(2):112-118.
[24]HUMME M,RAHMANI F,SMEEKENS S,et al.Sucrose-mediated translational control[J].Ann Bot,2009,104(1):1-7.
[25]TANG Qi,MA Xiaojun,MO Changming,et al.An efficient approach to findingSiraitia grosvenoriitriterpene biosynthetic genes by RNA-seq and digital gene expression analysis[J].BMC Genomics,2011,12:343.
【责任编辑李晓卉】
Physiological regularities of Siraitia grosvenorii mogrosideⅤbiosynthesis
MO Changming1,2,WANG Haiying3,4,MA Xiaojun1,3,TANG Qi2,WAN Lingyun5,ZHAI Yongjin2
(1 Agricultural College,Guangxi University,Nanning 530004,China;2 Guangxi Key Laboratory of Medicinal Resources Protection and Genetic Improvement,Guangxi Botanical Garden of Medicinal Plant,Nanning 530023,China; 3 Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences,Beijing 100193,China; 4 College of Chinese Materia Medica,Tianjin University of Traditional Chinese Midicine,Tianjin 300193,China; 5 Sichuan Academy of Chinese Medicine Sciences,Chengdu 610041,China)
【Objective】To discuss physiological regularities ofSiraitia grosvenoriimogrosideⅤbiosynthesis.【Method】Comparative experiments of variety,shading,gas storing and low-temperature storing were carried out.Through these experiments,correlations betweenSiraitia grosvenoriimogrosides and saccharides metabolizing in fruits,effects of photosynthesis,respiration and temperature on them were analysed.【Result and conclusion】In 30 d fruits,mogrosides were mainly mogrosideⅡE andⅢ,sucrose and glucose content were low.During 30-70 d,mogrosideⅡE andⅢcontent rapidly decreased;sucrose and glucose content increased;mogrosideⅤoccrred,and its content sharply rose to near the peak value.During 70-90 d,mogrosideⅤwas what only detected and found among mogrosides;sucrose content continually increased;glucose content obviously decreased.The higher photosynthetic rates of the variety,the higher its mogrosideⅤand glucose content.In shading conditions,photosynthetic rate of leaves decreased,but mogrosideⅤand glucose content of fruits both climbed up.Both gas storing and low-tem-perature storing improved glucose accumulation but inhibited mogrosideⅤbiosynthesis.These studies suggested that low saccharide group mogrosides gradually combined glucoses into mogrosideⅤ.It did not improve mogrosideⅤbiosynthesis that leaf photosynthesis and fruit respiration were regulated to increase glucose amount at a late developmental stage.These results showed that low saccharide group mogrosides amount and key enzymatic activities,not the glucose amount,were possibly the main factors of limiting mogrosideⅤbiosynthesis.
Siraitia grosvenorii;mogrosideⅤ;glucose;photosynthetic rate;enzymatic activity
S 667;Q53
A
1001-411X(2014)01-0093-07
莫长明,王海英,马小军,等.罗汉果甜苷Ⅴ合成生理规律的研究[J].华南农业大学学报,2014,35(1):93-99.
2012-11-29优先出版时间:2013-11-07
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20131107.1610.012.html
莫长明(1977—),男,副研究员,硕士,E-mail:mochming@126.com;通信作者:马小军(1958—),男,研究员,博士,E-mail:xjma@public.bta.net.cn
国家自然科学基金(81373914);国家科技支撑计划项目(2011BA101B03);广西科技攻关项目(桂科攻11107010-2-11)
