牛白细胞介素-17真核表达载体的构建及在牛乳腺上皮细胞中的表达
2014-09-10王婷崔新洁刘秉春陶琳胡庆亮修磊王潇
王婷,崔新洁,刘秉春,陶琳,胡庆亮,修磊,王潇
(内蒙古大学生命科学学院,内蒙古呼和浩特 010021)
牛白细胞介素-17真核表达载体的构建及在牛乳腺上皮细胞中的表达
王婷,崔新洁,刘秉春,陶琳,胡庆亮,修磊,王潇
(内蒙古大学生命科学学院,内蒙古呼和浩特 010021)
【目的】在体外分离培养牛乳腺上皮原代细胞,并构建牛白细胞介素-17(bIL-17)基因真核表达质粒,观察重组质粒在牛乳腺上皮细胞的表达.【方法】提取牛脾脏细胞总RNA,通过RT-PCR扩增bIL-17,将bIL-17连入pMD19-T进行测序,测序成功后将bIL-17插入含有增强型绿色荧光蛋白报告基因的真核表达质粒pEGFP-N3上,构建真核表达质粒pEGFP-N3-bIL-17.用脂质体法将pEGFP-N3-bIL-17质粒转染于牛乳腺上皮细胞,荧光显微镜观察绿色荧光蛋白在细胞中的表达,RT-PCR检测bIL-17基因在细胞内的转录,定量ELISA检测bIL-17蛋白在细胞内的表达情况.【结果和结论】成功构建具有绿色荧光和新霉素抗性的双选择标记的牛白细胞介素-17真核表达载体,并可在牛乳腺上皮细胞成功表达.
牛白细胞介素- 17;载体构建;牛乳腺上皮细胞;转染;表达
奶牛金黄色葡萄球菌乳房炎是影响奶牛养殖业健康发展的主要疾病之一[1].金黄色葡萄球菌Staphyloccocus aureus造成乳房持续性感染的发病机制复杂,现已发现乳腺持续感染与奶牛乳腺上皮细胞分泌炎性因子能力不足,从而无法招募足够的中性粒细胞到达炎性部位而清除病原细菌有关[2].乳腺上皮细胞作为泌乳的功能性细胞,是病原菌进入乳腺后首先接触的细胞,对病原微生物的识别显得尤为重要,同时对乳腺的先天性免疫起到促进作用.故体外如何增强牛乳腺上皮细胞分泌炎性因子能力是解决乳腺持续感染的关键所在[3].
牛白细胞介素-17(IL-17)由CD4+T细胞中的Th17细胞、单核细胞等分泌,最初被命名为细胞毒T淋巴细胞抗原8(CTLA-8),是一种促炎性细胞因子[4].研究发现IL-17存在6个家族成员(IL-17A、IL-17 B、IL-17 C、IL-17D、IL-17E、IL-17F),目前对于IL-17A研究最为广泛,一般所说的IL-17即为IL-17A[5].现已表明,IL-17A具有强大的招募激活中性粒细胞和单核细胞的作用,IL-17可以诱导趋化性细胞因子如IL-8、单核细胞趋化因子21(MCP21)和GRO2-α的表达增高;IL-17还能够诱导刺激机体分泌IL-1、IL-6、TNF-α等多种炎症因子,在细菌、真菌、病毒等所致的感染性疾病中起着重要的抗感染作用[6-7].已有试验表明,重组IL-17在体外可刺激乳腺上皮细胞分泌细胞因子,增强乳腺上皮细胞的抗感染能力[8].
本研究用逆转录-聚合酶链式反应技术克隆牛IL-17cDNA,构建具有绿色荧光和新霉素抗性的双选择标记真核表达重组质粒,并在牛乳腺上皮细胞中得以表达,为后续奶牛金黄色葡萄球菌乳房炎基因防治以及抗病转基因奶牛的研究奠定基础.
1 材料与方法
1.1 动物组织与细胞培养
牛脾脏取自呼和浩特北亚清真屠宰场.牛乳腺上皮细胞的培养采用从乳汁中分离乳腺上皮细胞的方法,新鲜牛奶取自内蒙古呼和浩特市小黑河镇二道河村奶农饲养的日产奶量40 kg的荷斯坦奶牛,取奶时间是产后2~4个月常乳.
1.2 主要试剂及仪器
PrimeScript RT reagent Kit、TaqTM、MiniBEST Agarose Gel DNA Extraciong Kit Ver 3.0为TaKaRa公司产品;TIANprep Mini Plasmid Kit为TIANGEN公司产品;EcoRⅠ、SalⅠ、pMD19-T vector、T4 DNA Ligase为 TaKaRa公司产品;pEGFP-N3 vector及DH5α感受态大肠埃希菌Escherichia coli菌株由内蒙古大学生命科学学院本科生创新实验室保存;牛乳腺上皮细胞培养试剂:完全培养液成分是FBS(体积分数为10%)+DMEM/F12+100 U双抗+氢化考的松(1 μg/mL)+孕酮(1 μg/mL)+转铁蛋白(5 μg/mL)+胰岛素(5 μg/mL)+L-谷氨酰胺(292 μg/mL)+EGF (10 ng/mL),其中FBS、EGF、DMEM/F12为Hyclone公司产品,其余添加因子均为Sigma公司产品;卡那霉素为北京索莱宝生物有限公司产品;兔抗人的荧光单克隆抗体keratin 8为北京莱兹生物公司产品; LipofectamineTM2000为Invitrogen公司产品;mIL-17定量ELISA试剂为eBioscience公司产品.
1.3 bIL-17基因引物设计
从GenBank中查找下载牛的bIL-17基因序列,由MEGA 4.0分析软件对序列进行分析,阅读其框架,选取具有功能的540 bp片段,根据引物设计原则设计1对引物:上游引物5'-GCGAATTCCTCACAGCGAGCACAAGT-3';下游引物5'-CCCTCGAGTAGGGGTCAGGCAGAAAG-3',分别在上下游引物中设计了EcoRⅠ、SalⅠ酶切位点.
1.4 bIL-17基因克隆
根据RNAiso Plus试剂盒说明,从牛脾脏提取组织总RNA.按逆转录试剂盒使用说明以总RNA为模板,进行RT-PCR反应合成cDNA第1链,以cDNA为模板进行PCR反应:取逆转录产物1 μL,加入5 μL10×Reaction buffer,4 μL dNTP混合物(2.5 mmol/L),1 μL Pyrobest DNA聚合酶(2 U/μL),上、下游引物各1 μL,加ddH2O至总体积50 μL.循环条件:94℃5 min;94℃30 s、64℃30 s、72℃30 s,30个循环;72℃延伸10 min.10 g/L琼脂糖凝胶电泳检测扩增产物,并按回收试剂盒说明对产物纯化回收.
1.5 PCR扩增产物的克隆和鉴定
将纯化的PCR产物连于pMD19-T vector:pMD19-T vector 1 μL、纯化bIL-17 4 μL、SolutionⅠ5 μL,16℃条件下反应2 h,连接产物转化入E.coliDH5α感受态细胞,37℃条件下培养过夜,挑取转化生长的阳性菌落,应用质粒提取试剂盒提取重组质粒,用EcoRⅠ、SalⅠ双酶切重组质粒,对其进行鉴定.将鉴定含有阳性质粒的菌液送往上海生物工程公司进行序列测定.
1.6 pEGFP-N3-bIL-17重组真核表达载体的构建
用EcoRⅠ和SalⅠ双酶切pMD19-T-bIL-17质粒,回收bIL-17片段,将回收片段定向插入用同法酶切的pEGFP-N3载体启动子下游,得到重组质粒pEGFP-N3-bIL-17,构建过程见图1.
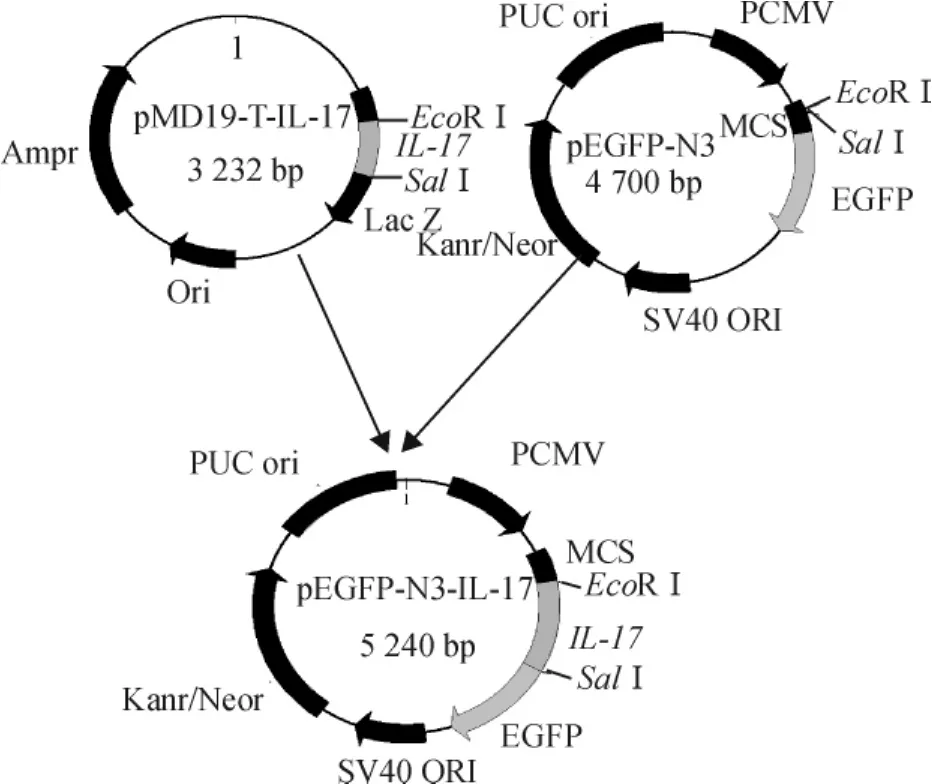
图1 pEGFP-N3-bIL-17构建示意图Fig.1 The schematic diagram of pEGFP-N3-bIL-17 plasmid construction
1.7 pEGFP-N3-bIL-17重组真核表达载体的鉴定
将连接产物转化到感受态E.coliDH5α,卡那霉素筛选阳性克隆,对重组质粒进行PCR及EcoRⅠ、SalⅠ双酶切鉴定,鉴定正确后将菌液送至上海生物工程公司进一步测序鉴定.
1.8 乳汁中乳腺上皮细胞的分离、培养
用无菌水清洗牛乳房,乙醇消毒后,手挤牛乳于灭菌的蓝盖瓶中,放于盛有37℃温水的保温盒中带回实验室.将200 mL乳汁与含双抗的PBS按体积比2∶1混合后,转入15 mL离心管中,1 500 r/min离心20 min,小心吸取细胞层,加入5 mL完全培养液,接种于25 cm2细胞培养瓶中,于37℃体积分数为5%的CO2培养箱中培养,隔2 d换液,之后每3 d换1次液,待细胞长出单克隆后原瓶消化,待长至80%汇集时传代培养,冻存第3代细胞.
1.9 牛乳腺上皮细胞的鉴定
采用免疫组化方法检测培养的细胞角蛋白8的表达:将细胞复苏后,于常温下用体积分数为4%的多聚甲醛固定生长于24孔板中的细胞30 min,PBS清洗3次,每次5 min;加入体积分数为0.2%的TritonX-100通透处理5 min,PBS清洗3次,每次5 min;加入PBS稀释10倍的正常山羊血清封闭处理30 min;加兔抗人的细胞角蛋白8多克隆抗体(体积比1∶100稀释)于37℃条件下振荡孵育1 h,PBS清洗3次,每次5 min;加入FITC标记的山羊抗兔IgG (体积比1∶50稀释),室温下避光振荡孵育30 min,PBS清洗3次,每次5 min;加入DAPI使用液(10 μg/mL),室温避光孵育10 min,荧光显微镜下观察结果,同时以牛成纤维细胞作阴性对照.
1.10 真核表达载体pEGFP-N3-bIL-17转染牛乳腺上皮细胞
将pEGFP-N3-bIL-17质粒转化感受态细胞DH5α,取菌液50 μL接种到50 mL含100 μg/mL氨苄青霉素的LB培养基中,在37℃摇床上振荡过夜.按照质粒抽提试剂盒说明书方法提取并纯化质粒DNA.将冻存的乳腺上皮细胞复苏到6孔板中,每孔接种5×104个细胞,待细胞汇合度为70%时,用DMEM-F-12培养基对细胞进行6 h饥饿处理.处理后,将4 μg重组质粒、5 μL PLUSTM Reagents加入到500 μL DMEM-F-12培养基中轻轻混匀,室温静置5 min后加入8 μL LipofectamineLTX,轻轻混匀并室温静置30 min.用PBS洗孔板中细胞,每孔加2 mL,洗3次,将转染液加入到6孔板中,细胞放置于37℃、体积分数为5%的CO2培养箱孵育6 h,去除转染复合物并加入含FBS(体积分数为10%)的新鲜培养液,培养24~48 h,在488 nm波长激发光下,应用荧光显微镜观察EGFP表达情况.
1.11 RT-PCR法检测重组质粒转染牛乳腺上皮细胞后bIL-17基因的表达
收集转染质粒的乳腺上皮细胞(1.5×106个/mL),按RNAiso Plus试剂法提取组织总RNA,并以它为模板进行RT-PCR,扩增bIL-17,其方法同1.4.
1.12 定量ELISA法检测重组质粒转染牛乳腺上皮细胞后bIL-17基因的表达
根据IL-17定量ELISA试剂盒说明书进行.用双抗体夹心酶标免疫分析法测定样品中bIL-17表达水平.设置4组,分别为IL-17标准品组、牛乳腺上皮细胞组、转染pEGFP-N3质粒组、转染pEGFP-N3-bIL-17质粒组.用IL-17一抗包被96孔板,4℃条件下过夜孵育后,缓冲液洗板;使用缓冲液倍比稀释IL-17A标准品,加入96孔板,每孔100 μL,剩余3组收集细胞培养上清,12 000 r/min离心40 min,每孔加入100 μL上清液,4℃条件下过夜孵育后洗板;加入IL-17二抗,室温孵育1 h后洗板;加入辣根过氧化物酶标记的生物素(Avidin-HRP*)室温孵育30 min后洗板;加入显色剂室温孵育15 min后洗板;最后加入终止液,室温孵育15 min;酶标仪检测各孔D450nm值,绘制标准曲线,依据标准曲线计算bIL-17基因的蛋白表达量.最后通过t检验方法分析转染pEGFP-N3质粒组、转染pEGFP-N3-bIL-17质粒组与未转染组细胞表达IL-17蛋白的差异.
2 结果
2.1 bIL-17基因片段扩增
用所设计的引物,从牛脾脏中扩增出大约为540 bp基因片段,其与预期目的片段大小相符,结果如图2所示.
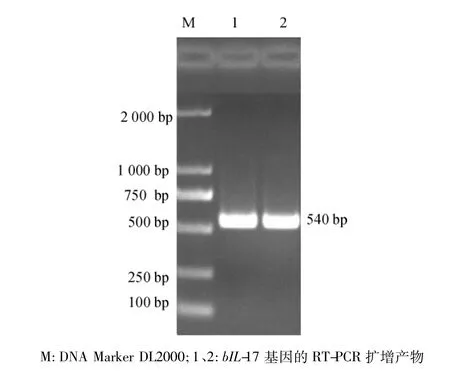
图2 bL-17基因的RT-PCR扩增凝胶电泳图Fig.2 Agarose gel electrophoresis of bovine IL-17 gene amplified by RT-PCR
2.2 bIL-17基因片段与pMD19-T质粒连接和重组质粒的鉴定
纯化的PCR产物经T4 DNA连接酶与pMD19-T质粒连接后,转化DH5α,随机挑选出阳性重组菌落进行扩增培养,用PCR法扩增出约540 bp的bIL-17基因片段;同样用EcoRⅠ和SalⅠ双酶切重组质粒也可分离到540 bp的基因片段和开环质粒pMD19-T,结果见图3a.测序及Blast分析显示与GenBank中的序列完全相同(登录号:NM_018865),测序结果图略.
2.3 重组质粒pEGFP-N3-bIL-17酶切鉴定
纯化的PCR产物经T4 DNA连接酶与pEGFPN3质粒连接后,转化DH5α,随机挑选出阳性重组子菌落进行扩增培养,用PCR法扩增出约540 bp的bIL-17基因片段;同样用EcoRⅠ和SalⅠ双酶切重组质粒也可分离到540 bp的基因片段和开环质粒pEGFP-N3(4.7 kb),测序及Blast分析显示bIL-17基因已经成功插入到pEGFP-N3载体.结果见图3b.
2.4 牛奶中乳腺上皮细胞的分离培养
新鲜牛奶离心获得的细胞接种3 d后,均可见许多鹅卵石样细胞聚集生长形成的克隆,以及分散生长的呈梭形的单个细胞,同时还可见少量的吞噬细胞(图4A、4B);每3 d换液,继续培养9 d后,形成许多大的、生长均匀的单细胞克隆,呈现鹅卵石状和多角形2种形态(图4C、4D),在细胞克隆的表面可观察到分泌到胞外的乳滴(图4E),同时观察到大量吞噬细胞转移到乳滴中(图4F).原瓶消化使细胞分散,继续培养2 d后,细胞在瓶底80%汇集,吞噬细胞消失,形成均匀的多角形和鹅卵石状细胞混合生长的乳腺上皮细胞层(图4G).细胞传至第3代时将其冻存,复苏后存活率高达90%,如图4H所示.
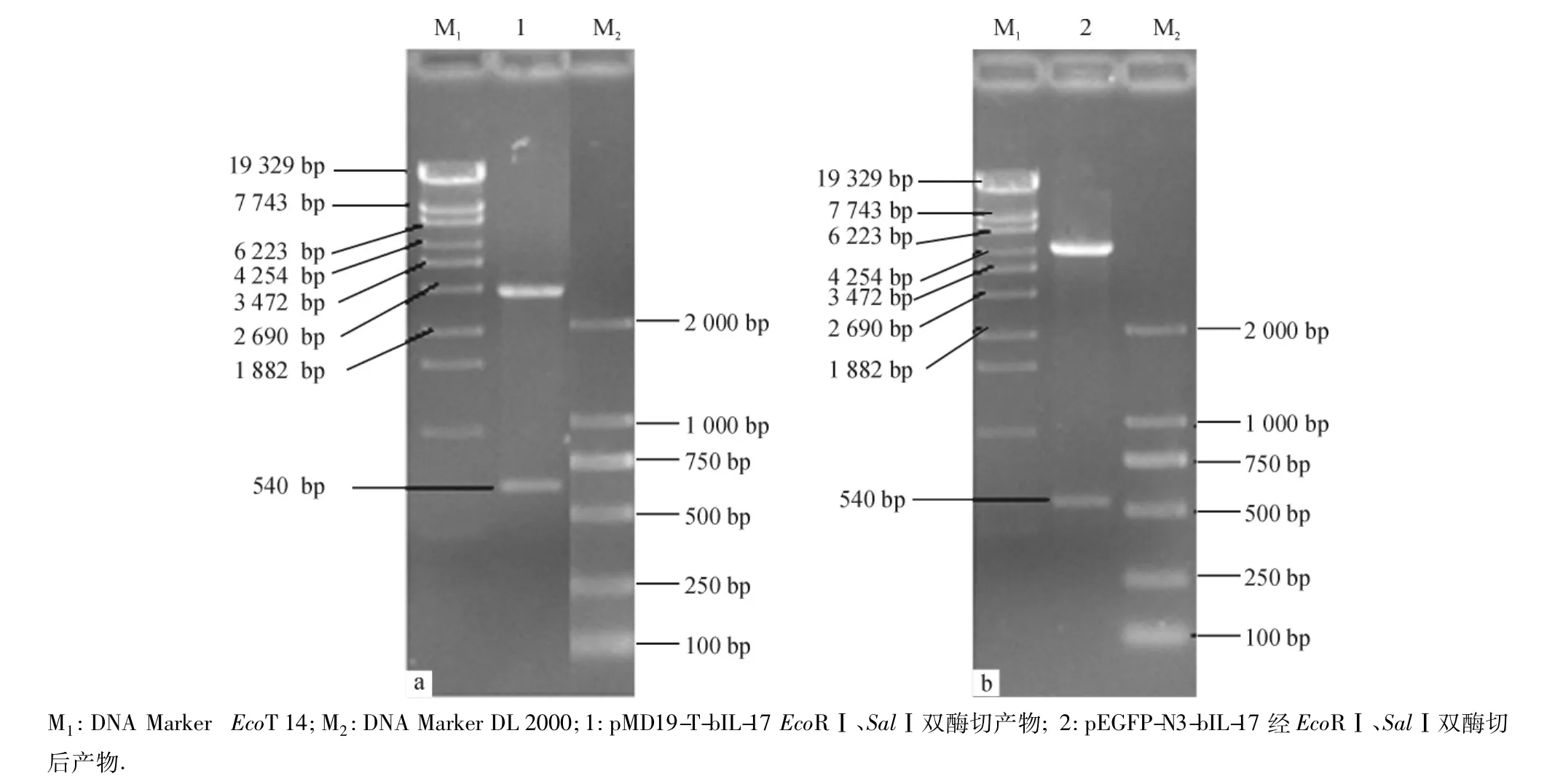
图3 pMD19-T-bIL-17(a)、pEGFP-N3-bIL-17(b)重组质粒双酶切鉴定电泳图Fig.3 Agarose gel electrophoresis of recombinant plasmid pMD19-T-bIL-17(a)and pEGFP-N3-bIL-17(b)digested by double-enzyme cleavage methed
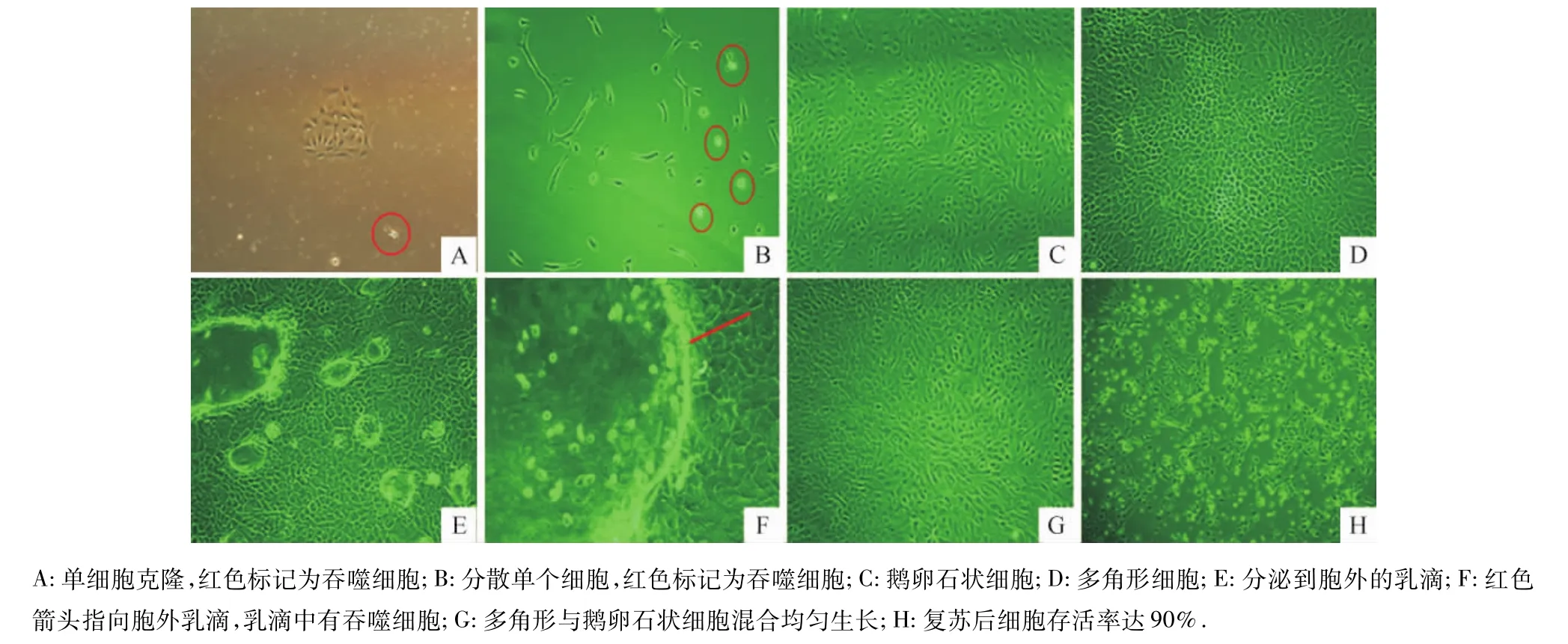
图4 乳汁中分离培养的牛乳腺上皮细胞形态(100×)Fig.4 The picture of the cultured bovine mammary epithelial cells from milk(100×)
2.5 原代牛乳腺上皮细胞的鉴定
应用免疫荧光细胞染色法检测纯化牛乳腺上皮细胞的骨架蛋白——角蛋白8的表达情况,结果显示,从牛乳中分离培养的乳腺上皮细胞角蛋白8表达呈阳性(图5).图中绿色荧光为表达于细胞质中的角蛋白8,蓝色部分为DAPI染色的细胞核,进一步在蛋白水平上证明分离培养的细胞是乳腺上皮来源.
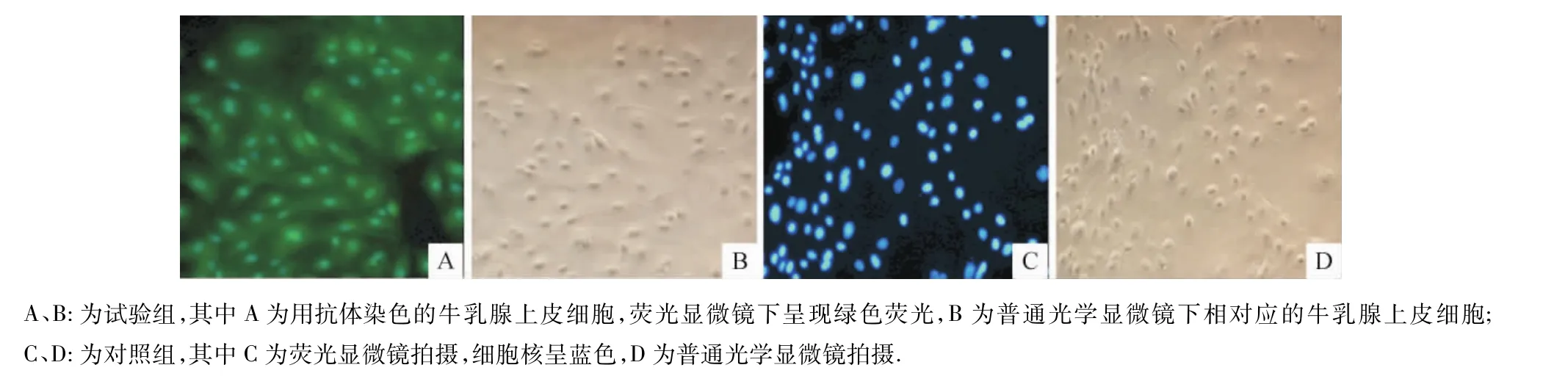
图5 免疫荧光细胞染色鉴定角蛋白8表达(100×)Fig.5 Keratin 8 expression identified by the immunohistochemistry assay(100×)
2.6 真核表达载体pEGFP-N3-bIL-17转染牛乳腺上皮细胞
重组pEGFP-N3-bIL-17质粒转染牛乳腺上皮细胞48 h后,荧光显微镜下观察到约20%的细胞有梭形或圆形的绿色荧光(图6),证实重组质粒pEGFPN3-bIL-17能有效转染至牛乳腺上皮细胞并在细胞中表达.
2.7 RT-PCR鉴定重组质粒pEGFP-N3-bIL-17在牛乳腺上皮细胞中的表达
重组质粒pEGFP-N3-bIL-17转染牛乳腺上皮细胞48 h后,采用RT-PCR方法对外源bIL-17基因的表达进行鉴定,结果(图7)显示,重组质粒pEGFPN3-bIL-17转染牛乳腺上皮细胞组在约540 bp处出现bIL-17基因目的条带,而未转染组和空质粒转染组都没有检测到bIL-17基因目的条带,证实重组质粒pEGFP-N3-bIL-17转染细胞后,外源bIL-17基因可以获得很好地转录.

图6 荧光显微镜下观察pEGFP-N3-bIL-17转染牛乳腺上皮细胞(100×)Fig.6 Detection of GFP expression in bovine mammary epithelial cells by fluorescence microscope(100×)
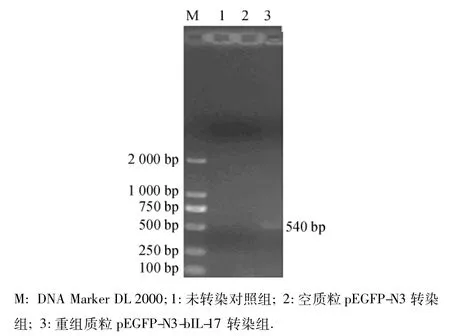
图7 RT-PCR检测bIL-17基因在转染乳腺上皮细胞中的表达Fig.7 The bIL-17 expression in the transfected bovine mammary epithelial cells detected by RT-PCR
2.8 真核载体pEGFP-N3-bIL17转染牛乳腺上皮细胞后bIL-17蛋白表达水平ELISA检测结果
为进一步验证重组质粒pEGFP-N3-bIL-17转染牛乳腺上皮细胞后bIL-17基因是否表达,我们应用定量ELISA的方法对转染重组质粒pEGFP-N3-bIL-17的牛乳腺上皮细胞培养液上清中bIL-17蛋白量进行了检测,结果如图8所示,转染pEGFP-N3-bIL-17质粒牛乳腺上皮细胞组bIL-17蛋白含量高于未转染质粒细胞组(t-检验,P<0.05),转染pEGFP-N3质粒组bIL-17蛋白含量与未转染质粒组基本无差异.
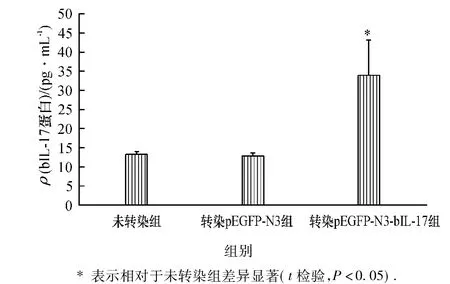
图8 ELISA法检测bIL-17基因在转染牛乳腺上皮细胞中的蛋白表达量Fig.8 The protein expression of bIL-17 in the transfected bovine mammary epithelial cells detected by ELISA
3 讨论
乳腺上皮细胞具有合成和分泌乳汁的特殊功能,体外培养的奶牛乳腺上皮细胞作为一种模型,既可用来研究乳蛋白基因表达[9],又可作为乳腺特异性表达载体的检测系统[10],因此被广泛应用于乳蛋白基因表达及调控、细胞形态学及乳腺生物反应器的基础理论研究.另外,在乳腺炎的发病过程中,乳腺上皮细胞是病原菌在穿过乳头末端的机械屏障后进入机体内部之前最先接触的细胞,多种病原菌侵入乳腺后可通过各种方式黏附和侵入牛乳腺上皮细胞,因此,乳腺上皮细胞亦是体外研究乳腺炎发病机制和动物基因治疗的理想模型[11-14],此外,牛乳中乳腺上皮细胞来源广泛,易于取材,可以分离培养,易于接受外源基因尤其是质粒DNA,并能稳定表达对应的基因产物,因此在动物基因治疗方面亦有良好的应用前景.IL-17由CD4+T细胞中的Th17细胞,单核细胞等分泌,最初被命名为细胞毒T淋巴细胞抗原8(CTLA-8),是一种促炎性细胞因子.有研究显示hIL-17可以刺激表皮成纤维细胞、滑膜细胞、内皮细胞、支气管上皮细胞分泌IL-6和IL-8[15].大量证据表明,IL-17具有强大的促炎作用和抗感染作用.在防御革兰阴性细菌如肺炎克雷伯菌Klebsiella pneumoniae及脆弱类杆菌Bacterookdes fragilis等的感染中,可在感染早期募集中性粒细胞,通过刺激上皮细胞分泌IL-8、G-CSF等细胞因子诱导刺激树突状细胞等免疫细胞的成熟分化,从而加强局部炎症反应,加强机体清除细胞外感染的细菌,防止慢性感染和组织化脓发生[16-18].IL-17还通过刺激IL-6和PGE2的产生,加强局部炎症反应,诱导细胞间黏附因子(ICAM)产生,协同促进T细胞反应[19],从而在非特异性免疫和特异性免疫之间建立联系.因此,对IL-17在乳腺炎发病中作用的深入研究,可能为解决乳腺炎发病机制尚未解决的问题带来新的希望.
本研究采用RT-PCR方法从牛脾脏中扩增获得牛IL-17基因编码序列,并将其插入到真核表达载体pEGFP-N3中.用LipofectamineTM2000脂质体转染牛乳腺上皮细胞,获得良好的转染效率,转染pEGFPN3-bIL-17之后可以检测到外源IL-17获得了高效表达.以牛乳腺上皮细胞作为靶细胞结合IL-17基因转染技术的进一步研究,可能为后续奶牛金黄色葡萄球菌乳房炎基因防治以及抗病转基因奶牛的研究奠定基础.
[1]LE MARECHAL C,THIERY R,VAUTOR E,et al.Mastitis impact on technological properties of milk and quality of milk products-a review[J].Dairy Sci Technol,2011,91 (3):247-282.
[2]HALASA T,NIELEN M,HUIRNE R B M,et al.Stochas-tic bio-economic model of bovine intramammary infection[J].Livestock Sci,2009,124(1/2/3):295-305.
[3]BADIOU C,DUMITRESCU O,CROZE M,et al.Panton-Valentine leukocidin is expressed at toxic levels in human skin abscesses[J].Clin Microbiol Infec,2008,14(12):1180-1183.
[4]YAO Zhengbin,PAINTER S L,FANSLOW W C,et al.Human IL-17:A novel cytokine derived from T cells[J].J Immunol,1995,155(12):5483-5486.
[5]MOSELEY T A,HAUDENSCHILD D R,ROSE L,et al.Interleukin17 family and IL-17 receptors[J].Cytokine Growth Factor Rev,2003,14(2):155-174.
[6]JONES C E,CHAN K.Interleukin-17 stimulates the expression of interleukin-8,growth-related oncogene-alpha,and granulo-cyte-colony-stimulating factor by human airway epithelial cells[J].Am J Respir Cell Mol Biol,2002,26 (6):748-753.
[7]CRUZ A,FRAGA A G,FOUNTAIN J J,et al.Pathological role of interleukin 17 in mice subjected to repeated BCG vaccination after infection with Mycobacterium tuberculosis[J].J Exp Med,2010,207(8):1609-1616.
[8]BOUGAM S,CUNHA P,GILBERT F B,et al.Staphylococcal-associated molecular patterns enhance expression of immune defense genes induced by IL-17 in mammary epithelial cells[J].Cytokine,2011,56(3):749-759.
[9]ZHAO Ke,LIU Hongyun,ZHOU Miaomiao,et al.Establishment and characterization of a lactating bovine mammary epithelial cell model for the study of milk synthesis[J].Cell Biol Int,2010,34(7):717-721.
[10]多曙光,吴应积,罗奋华,等.牛乳腺上皮细胞的分离培养及其生物学特性[J].动物学研究,2006,27(3):299-305.
[11]RAUL A A,KARL R M,EDUARDO C,et al.Staphylococcus aureusinvasion of bovine mammary epithelial cells[J].J Dairy Sci,1996,79(6):1021-1026.
[12]WELLNITZ O,KERR D E.Cryopreserved bovine mammary cells to model epithelial response to infection[J].Vet Immunol Immunopathol,2004,101(3/4):191-202.
[13]YANG Wei,ZERBE H,PETZL W,et al.Bovine TLR2 and TLR4 properly transduce signals fromStaphylococcus aureusandE.coli,butS.aureusfails to both activate NF-κB in mammary epithelial cells and to quickly induce TNF and interleukin-8(CXCL8)expression in the udder[J].Mol Immunol,2008,45(5):1385-1397.
[14]HEBERT A,SAYASITH K,SENECHAL S,et al.Demonstration of intracellularStaphylococcus aureusin bovine mastitis alveolar cells and macrophages isolated from naturally infected cow milk[J].FEMS Microbiol Lett,2000,193(1):57-62.
[15]AGGARWAL S,GURNEY A L.IL-17:Prototype member of an emerging cytokine family[J].J Leukoc Biol,2002,71(1):1-8.
[16]GABR M A,JING Liufang,HELBLING A R,et al.Interleukin-17 synergizes with IFNgamma or TNFalpha to promote inflammatory mediat or release and intercellular adhesion molecule-1(ICAM-1)expression in human intervertebral disccells[J].J Orthop Res,2011,29(1):1-7.
[17]MIYAZAKI Y,HAMANO S,WANG Seng,et al.IL-17 is necessary for host protection against acute-phase Try panosoma cruzi infection[J].J Immunol,2010,185(2):1150-1157.
[18]MIYAMOTO M,PRAUSE O,SJOSTRAND M,et al.Endogenous IL-17 as a mediator of neutrophil recruitment caused by endotoxin exposure in mouse airways[J].J Immunol,2003,170(9):4665-4672.
[19]ALBANESI C,CAVANI A,GIROLOMONL G.IL-17 is produced by nickel-specific T lymphocytes and regulates ICAM21 expression and chemokine production in human keratinocytes:Synergistic or antagonist effects with IFN-gamma and TNF-alpha[J].J Immunol,1999,162(1):494-502.
【责任编辑李晓卉】
Construction of bovine interleukin-17 eukaryotic expression vector and its expression in the bovine primary mammary epithelial cells
WANG Ting,CUI Xinjie,LIU Bingchun,TAO Lin,HU Qingliang,XIU Lei,WANG Xiao
(College of Life Sciences,Inner Mongolia University,Hohhot 010021,China)
【Objective】To construct bovine interleukin-17(bIL-17)gene eukaryotic expression vector and detect its expression in bovine mammarily epithelial cells which were primarily culturedin vitro.【Method】Bovine interleukin-17 gene(bIL-17)was amplified from the spleen tissue of cow by RT-PCR,which was inserted into pMD19-T vector and then sequenced.ThebIL-17 was inserted into an expression vector pEGFP-N3 carrying the enhanced green fluorescent protein to generate a new plasmid pEGFP-N3-bIL-17.The pEGFP-N3-bIL-17 eukaryotic expression vector was transfected into bovine primary mammary epithelial cells with LipofectamineTM2000 liposome.After the transfection,the green fluorescent protein was observed under fluorescence microscopy,andbIL-17 transcription was examined by RT-PCR and bIL-17 protein expression in cells detected by ELISA methods.【Result and conclusion】The recombinant vector pEGFP-N3-bIL-17 with a green fluorescence and neomycin resistance was constructed and bIL-17 protein could be normally expressed in mammary epithelial cells.
bovine interleukin-17(bIL-17);vector construction;bovine primary mammary epithelial cell;transfection;expression
S852.42
A
1001-411X(2014)01-0079-07
王婷,崔新洁,刘秉春,等.牛白细胞介素-17真核表达载体的构建及在牛乳腺上皮细胞中的表达[J].华南农业大学学报,2014,35(1):79-85.
2013-02-04优先出版时间:2013-11-07
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20131107.1459.002.html
王婷(1990—),女,硕士研究生,E-mail:fenziwang90@gmail.com;通信作者:王潇(1978—),男,副教授,博士,E-mail:wxiao1978@yahoo.com.cn
国家自然科学基金(30901066);内蒙古自然科学基金(2010MS0514)
