多b值扩散加权成像在鉴别肺肿块良恶性中的价值
2014-09-09王晓华段江晖袁慧书北京大学第三医院放射科北京009
王晓华,段江晖,袁慧书北京大学第三医院放射科,北京009
2中日友好医院放射科,北京100029
肺癌是对人类健康威胁最大的恶性肿瘤,发病率和死亡率居所有恶性肿瘤之首[1]。尽管目前胸部X线和电子计算机断层扫描 (computed tomography,CT)仍是肺部肿瘤的常规检查方法,但有时仅靠形态学改变很难鉴别肺部肿块的良恶性[2-3],而正电子发射型计算机断层显像 (positron emission tomography/computed tomography,PET/CT)评估肺肿块的标准摄取值(standard uptake value,SUV)易受机体大小、血液葡萄糖水平及注射后时间等因素的影响[4]。
磁共振成像 (magnetic resonance imaging,MRI)具有软组织分辨率高、无电离辐射等特点,不但能提供组织的形态学信息,还能提供功能信息。扩散加权成像 (diffusion-weighted imaging,DWI)是一种检测体内水分子扩散运动的功能成像方法,在肿瘤领域的应用比较广泛。早期研究发现,恶性肿瘤的表观弥散系数 (apparent diffusion coefficient,ADC)值比良性病变低,因此ADC值可用于鉴别肺部肿块的良恶性[5-7],但也有部分学者认为ADC值不能鉴别两者[8-10]。可见,利用ADC值别肺部肿块的良恶性仍存在较大争议。
1986年,Le Bihan等[11]首先提出了DWI的体素内不相干运动模型 (intravoxel incoherent motion,IVIM)。应用该模型可以分离组织扩散效应和组织灌注效应。此后,许多应用IVIM模型的研究涌现出来,如在肝脏[12]、胰腺[13]、乳腺[14]和前列腺[15]等器官,各研究均反映出更加全面和真实的组织扩散和灌注状态。根据IVIM理论,笔者推测早期研究可能由于b值设定的限制,导致所测得的肺肿块ADC值未能去除组织灌注效应的影响,从而使扩散参数不同程度地混有组织灌注的信息。为了更好地探究肺部肿块真实的水分子扩散特性及微循环灌注作用的影响,本研究采用多b值扩散加权成像研究了不同参数值在鉴别肺肿块良恶性中的价值。
对象和方法
对象2013年4月至2014年4月在北京大学第三医院就诊、准备行胸部MRI检查的患者,以CT影像表现作为入选标准:(1)CT扫描肺内实性团块直径≥2 cm;(2)肿瘤内部钙化、坏死、囊变或空洞部分不超过实体肿瘤的50%;(3)患者一般状况良好,能均匀规律呼吸,配合完成检查;(4)未接收过放化疗或其他抗肿瘤治疗。共有38例患者入选,其中30例有病理结果证实,8例经临床证实;恶性23例,良性15例。恶性组中23例患者中,男12例,女11例,平均年龄 (57.7±12.7)岁 (21~74岁);腺癌15例,鳞癌5例,小细胞癌、大细胞癌和霍奇金淋巴瘤各1例。良性组15例患者中,男9例,女6例,平均年龄 (55.0±14.8)岁 (23~74岁);炎性病变9例,良性肿瘤3例,增殖性肺结核2例,肺段隔离症1例。本研究经北京大学第三医院伦理委员会批准,所有患者均签署知情同意书。
MRI检查采用美国GE Discovery MR 750 3.0 T磁共振扫描仪,8通道相控阵表面线圈联合并行采集技术。检查前对患者进行呼吸训练,打开呼吸和心电监控,采用呼气末和R波触发。主要序列包括:(1)呼吸或脉搏门控轴位压脂FSE T2WI,TR 6000~9000 ms,TE 85 ms,矩阵320×224,FOV 36 cm×36 cm,回波链18,层厚7.0 mm,层间距0.7 mm,NEX 2。 (2)脉搏门控双反转轴位 T1W1,TR 600~1000 ms,TE 5 ms,矩阵256×192,FOV 36 cm×36 cm,回波链16,层厚7.0 mm,层间距0.7 mm,NEX 0.5。 (3)DWI序列选择呼吸触发的单次激发自旋回波平面回波成像,采用局部匀场技术,TR 12 000~14 000 ms,TE 70 ms,矩阵160×160,FOV 36 cm×36 cm,层厚/层间隔7.0 mm/0.7 mm。扩散敏感梯度脉冲在空间3个方向上应用,每个方向上选择9个b值,分别为0、50、100、150、200、400、600、1000、1500 s/mm2。
图像分析将DWI图像数据传输到GE AW4.5后处理工作站,点击FuncTool软件包的MADC图像后处理软件。IVIM模型方程为:Sb/So=(1-f)·exp(-b·D)+f·exp[-b·(D+D*)],其中,D为扩散系数,其意义在于表示感兴趣区内 (region of interest,ROI)水分子真实扩散效应;D*为假扩散系数,表示局部ROI内由于微循环的灌注所致扩散效应,因此又被称为灌注相关扩散系数;f为灌注分数,表示ROI内局部微循环灌注效应占总体的扩散效应的比率。
参照病变在常规序列和DWI图像上的位置画ROI。在DWI图像上选取实性部分较大的数个层面,每层分别设置3个ROI,避开明显的血管及肉眼可辨的坏死、囊变及钙化区,并避开病变边缘,取3次测量平均值作为病变最终测量值。
统计学处理采用SPSS 19.0统计软件,肺部肿块恶性组及良性组数据采用Mann-WhitneyU检验;对相关参数进行受试者工作特征 (receiver operating characteristic,ROC)曲线分析,计算曲线下面积 (area under curve,AUC),并采用MedCalc软件确定最佳阈值,分析各参数诊断恶性肿瘤的敏感性、特异性、准确性、阳性预测值和阴性预测值;P<0.05为差异有统计学意义。
结 果
影像表现病灶实质信号特点为T1WI呈等、低信号,T2WI呈等、高信号,其中,囊变、坏死区呈长T1、长T2信号,钙化区呈低信号,良恶性病灶信号不具特征性。恶性病灶长径平均为 (5.2±2.7)cm(2.1~13.1 cm),病灶边缘多不规则。良性病变长径平均为 (5.8±1.8)cm(3.5~9.5 cm),病灶边缘光滑锐利。
多b值DWI不同参数值在肺良恶性肿块间的比较肺恶性组D值明显低于良性组 (Z=3.308,P=0.001),两组间D*(Z=1.646,P=0.100)和f值(Z=1.254,P=0.210)差异没有统计学意义 (表1,图1、2)。
不同参数值ROC曲线分析以恶性为病变组,良性为对照组进行ROC曲线分析,结果显示D、D*、f的AUC分别为0.839、0.683、0.639。尽管D值显示最高的AUC,但两两比较差异无统计学意义 (P均>0.05)。当D值阈值为0.90×10-3mm2/s时,诊断恶性病变的敏感性为95.7%,特异性为80.0%,准确性为90.9%,阳性预测值为91.7%,阴性预测值为88.9%(表2)。
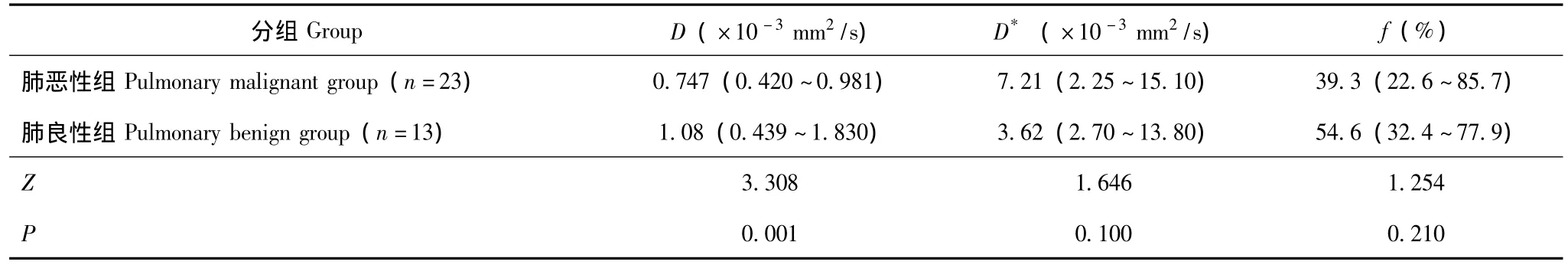
表1 肺良恶性肿块各参数比较Table 1 Comparison of parameters in pulmonary benign and malignant tumors

表2 肺部良恶性肿块各参数值的ROC曲线分析Table 2 ROC curve analysis of each parameter in lung benign and malignant tumors

图1 男,69岁,术后病理证实为小细胞肺癌Fig 1 A 69-year-old male patient with pathologically confirmed small cell lung cancer
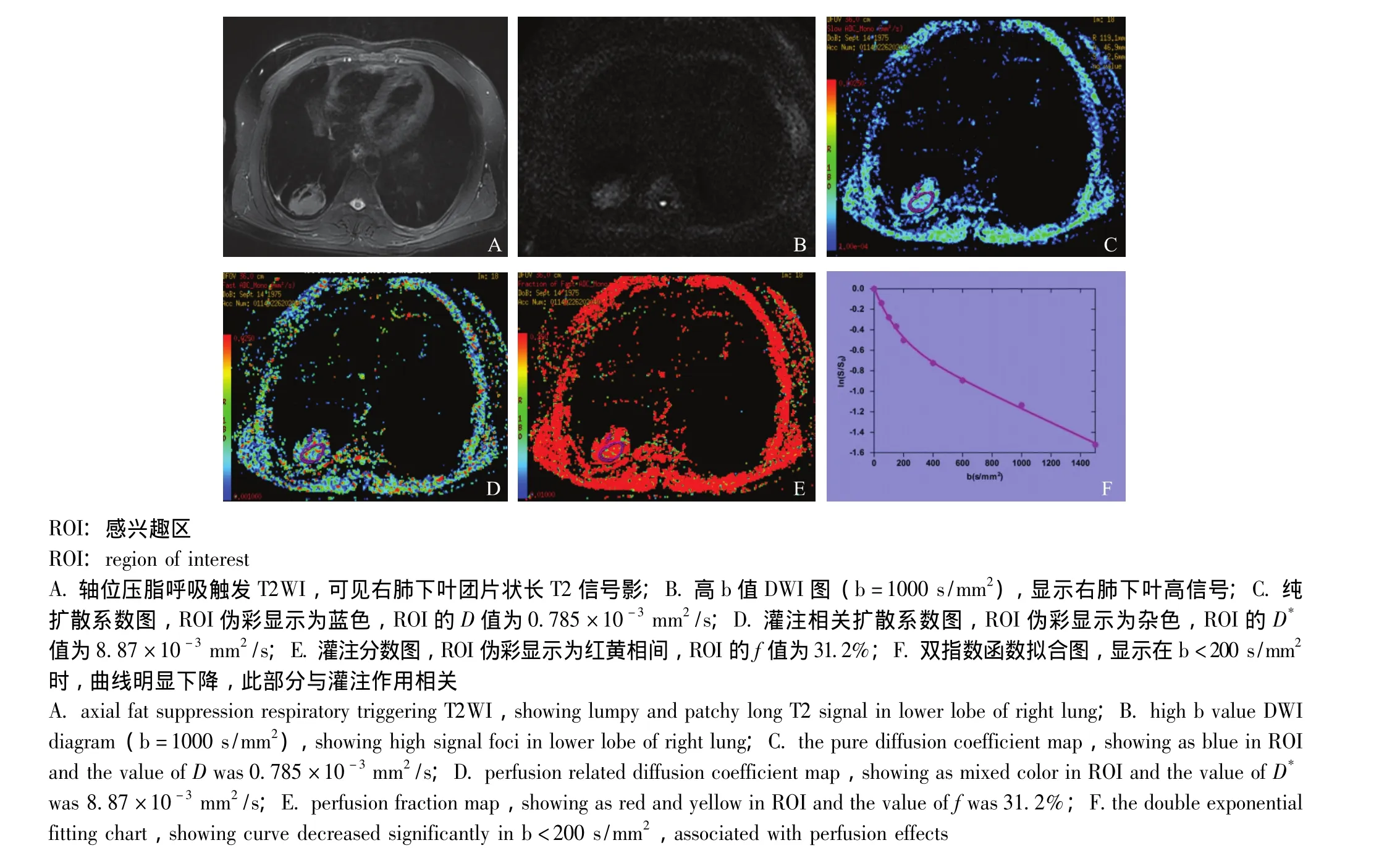
图2 男,54岁,临床诊断为右肺下叶慢性炎症Fig 2 A 54-year-old male patient with clinically diagnozed chronic inflammation in lower lobe of right lung
讨 论
以往肺肿块的DWI研究常用病变的信号强度来鉴别良恶性,得到恶性病变的信号强度显著高于良性病变[8-10],但是利用信号强度鉴别有一定的局限性。这是因为DWI图像本身含有T2的成分,所以对于非常长的T2弛豫组织,由于T2透射效应影响,在DWI图中也会显示高信号,单纯利用病变的信号强度鉴别良恶性难以避免T2透射效应影响,因此必须要结合ADC值才能更准确地鉴别。由于恶性肿瘤具有更高的细胞密度、丰富的大分子蛋白、大的核浆比和较少的细胞外间隙,常导致水分子的扩散受限,ADC值减低,Tondo等[16](b 值为0、1000 s/mm2)、Mori等[5](b 值为0、1000 s/mm2)、Liu 等[6](b 值为 0、500 s/mm2)的研究结果表明了这一点。但是,另外一些学者则认为肺部良恶性病变ADC值并没有显著差异[8-9],分析原因可能与设定的b值、不同的场强、不同的门控技术等有关。再者即使采用同一MR系统,后处理时不同的ROI面积、DWI图像的低信噪比和磁敏感伪影,都可能导致ADC值出现变化。
根据IVIM理论,早期研究的ADC值不同程度混合有灌注的成分,而IVIM模型可以分离组织纯扩散效应和微灌注效应,所以参数D才是反映真实组织扩散的指标。本研究中,肺部恶性病变的D值显著低于良性病变,D*值大于良性病变,f值小于良性病变,肺内良恶性病变的灌注相关参数D*和f均没有显著性差异。这说明原先研究的肺良恶性病变之间的ADC值差异主要是由D值差异所造成,进一步证实了良恶性病变组织内微结构的不同。根据其他部位的IVIM研究,预计灌注参数可能与肿瘤的微血管密度 (Microvessel density,MVD)有关。许多实体肿瘤的MVD与肿瘤的发生、进展和预后相关[17-18]。MVD增多导致血流量增加,故肺恶性病变D*较高。由于血管生成增加不仅发生在恶性肿瘤,而且也发生于良性肿瘤中,因此良恶性病变的MVD有重复[19-20],部分良性病变D*较高可能与病变内部血流量增加有关。
本研究的局限性在于:(1)样本量不大,良性病例数不多。由于大部分病例为穿刺病理结果,病理取材较少,故未能研究肺内肿块的MVD与灌注参数之间的关系、以及扩散参数与病变细胞密度之间的关系,在今后的研究中需要进一步拓展。(2)技术因素仍然制约着肺部DWI的发展。本研究虽然应用了呼吸触发技术,但有些肺下叶近膈面的病变由于呼吸运动幅度较大,导致图像的错配,可能会使测量参数产生偏差。另外由于采用EPI扫描方式以及肺内病变界面固有的磁化率差异较大,部分病变的磁敏感伪影较重,导致图像变形,这需要在今后的研究中进一步改善。
[1]Chen W,Zheng R,Zhang S,et al.Annual report on status of cancer in China,2010 [J].Chin J Cancer Res,2014,26(1):48-58.
[2]Ettinger DS,Akerley W,Borghaei H,et al.Non-small cell lung cancer,version 2.2013 [J].J Natl Compr Canc Netw,2013,11(6):645-653.
[3]Cronin P,Dwamena BA,Kelly AM,et al.Solitary pulmonary nodules:meta-analytic comparison of cross-sectional imaging modalities for diagnosis of malignancy [J].Radiology,2008,246(3):772-782.
[4]Ohno Y,Koyama H,Matsumoto K,et al.Differentiation of malignant and benign pulmonary nodules with quantitative firstpass 320-detector row perfusion CT versus FDG PET/CT[J].Radiology,2011,258(2):599-609.
[5]Mori T,Nomori H,Ikeda K,et al.Diffusion-weighted magnetic resonance imaging for diagnosing malignant pulmonary nodules/masses comparison with positron emission tomography[J].J Thorac Oncol,2008,3(4):358-364.
[6]Liu H,Liu Y,Yu T,et al.Usefulness of diffusion-weighted MR imaging in the evaluation of pulmonary lesions [J].Eur Radiol,2010,20(4):807-815.
[7]Coolen J,Vansteenkiste J,De Keyzer F,et al.Characterisation of solitary pulmonary lesions combining visual perfusion and quantitative diffusion MR imaging [J].Eur Radiol,2014,24(2):531-541.
[8]Gumustas S,Inan N,Akansel G,et al.Differentiation of malignant and benign lung lesions with diffusion-weighted MR imaging [J].Radiol Oncol,2012,46(2):106-113.
[9]UtoT,Takehara Y,Nakamura Y,et al.Higher sensitivity and specificity for diffusion-weighted imaging of malignant lung lesions without apparent diffusion coefficient quantification [J].Radiology,2009,252(1):247-254.
[10]Satoh S,Kitazume Y,Ohdama S,et al.Can malignant and benign pulmonary nodules be differentiated with diffusionweighted MRI[J].AJR Am J Roentgenol,2008,191(2):464-470.
[11]Le Bihan D,Breton E,Lallemand D,et al.MR imaging of intravoxel incoherent motions:application to diffusion and perfusion in neurologic disorders [J].Radiology,1986,161(2):401-407.
[12]Woo S,Lee JM,Yoon JH,et al.Intravoxel incoherent motion diffusion-weighted MR imaging of hepatocellular carcinoma:correlation with enhancement degree and histologic grade[J].Radiology,2014,270(3):758-767.
[13]Kang KM,Lee JM,Yoon JH,et al.Intravoxel incoherent motion diffusion-weighted MR imaging for characterization of focal pancreatic lesions[J].Radiology,2014,270(2):444-453.
[14]Bogner W,Gruber S,Pinker K,et al.Diffusion-weighted MR for differentiation of breast lesions at 3.0 T:how does selection of diffusion protocols affect diagnosis [J].Radiology,2009,253(2):341-351.
[15]Pang Y,Turkbey B,Bernardo M,et al.Intravoxel incoherent motion MR imaging for prostate cancer:an evaluation of perfusion fraction and diffusion coefficient derived from different b-value combinations[J].Magn Reson Med,2013,69(2):553-562.
[16]Tondo F,Saponaro A,Stecco A,et al.Role of diffusionweighted imaging in the differential diagnosis of benign and malignant lesions of the chest-mediastinum [J].Radiol Med,2011,116(5):720-733.
[17]Fujimoto K.Usefulness of contrast-enhanced magnetic resonance imaging for evaluating solitary pulmonary nodules [J].Cancer Imaging,2008,8(1):36-44.
[18]Xiong Z,Liu JK,Hu CP,et al.Role of immature microvessels in assessing the relationship between CT perfusion characteristics and differentiation grade in lung cancer[J].Arch Med Res,2010,41(8):611-617.
[19]Schaefer JF,Schneider V,Vollmar J.Solitary pulmonary nodules:association between signal characteristics in dynamic contrast enhanced MRI and tumor angiogenesis [J].Lung Cancer,2006,53(1):39-49.
[20]Yi CA,Lee KS,Kim EA,et al.Solitary pulmonary nodules:dynamic enhanced multi-detector row CT study and comparison with vascular endothelial growth factor and microvessel density [J].Radiology,2004,233(1):191-199.
