嫩江下游浮游植物群落结构及其影响因子
2014-09-08卞少伟于洪贤马成学霍堂斌
卞少伟,于洪贤,马成学,霍堂斌
(1.天津市环境监测中心,300191,天津;2.东北林业大学,150040,哈尔滨;2.中国水产科学研究院黑龙江水产研究所,150070,哈尔滨)
嫩江下游浮游植物群落结构及其影响因子
卞少伟1,于洪贤2*,马成学2,霍堂斌3
(1.天津市环境监测中心,300191,天津;2.东北林业大学,150040,哈尔滨;2.中国水产科学研究院黑龙江水产研究所,150070,哈尔滨)
2011年春季(5月)和夏季(7月),系统调查研究了嫩江下游对浮游植物结构群落组成、丰度的分布特征及与环境因子的关系。10个采样点中共鉴定出浮游植物7门101种及变种,春季和夏季的优势种以硅藻门为主:变绿脆杆藻、尖针杆藻、梅尼小环藻、短线脆杆藻、肘状针杆藻。不同季节各采样点浮游植物生物量在0.03~3.19 mg/L之间,丰度变幅在(0.60~32.40)×105ind./L之间。Shannon-Wiener多样性指数(H′)在2.00~3.94之间,Pielou均匀度指数(J′)的在0.46~0.98之间,Margalef丰富度指数(d)在1.72~4.89之间。典范对应分析(CCA)表明,水体温度是影响该水域浮游植物分布格局的重要因子,电导率和总磷浓度也对浮游植物的分布有较大的影响。CCA排序图较好显示了浮游植物物种分布和环境因子之间的关系。
嫩江;浮游植物;群落结构;环境因子;典范对应分析
0 引言
嫩江是中国松花江最大支流,位于黑龙江省的中西部。源出于大兴安岭北麓伊勒呼里山,南流到镇赉县,最终经吉林省大安市在三岔河汇入松花江。全长1 370 km,流域面积28.3×104km2。依其地形、地貌和河谷特征,分为上游、中游、下游3段。自嫩江河源到嫩江县城为上游段;由嫩江县城到莫力达瓦达斡尔族自治旗的尼尔基(前称布西)为中游段;从尼尔基到三岔河口为下游段。嫩江的年内和年际及地区上的降水变化差异较大,最大年降水量为937.4 mm,最小年降水量为152.5 mm。年降水量主要集中在6-9月份,约占全年降水量的82%,其中7、8月的2个月所占比重最大。
近几年,随着嫩江流域毗邻城市的社会经济不断发展,人类活动的加剧,导致嫩江流域的水生态问题日益凸显,水质状况出现局部恶化的现象[1-3]。现今对嫩江下游水环境质量状况进行的研究还不全面,主要集中在水环境理化指标的监测,利用浮游植物对嫩江进行生物监测方面的研究很少。浮游植物是水域生态系统的重要组成成分,也是生态系统中的初级生产者[4]。所以其组成和多样性的变化将直接影响到生态系统的结构与功能,对维持淡水生态系统平衡起到至关重要的作用[5-8]。浮游植物的动态变化直接影响着水体的水质变化,富营养化水体最直接的表现是水体中浮游植物繁殖迅速,出现水华。在不同的地区,不同水域中,浮游植物季节变化不同,而且引起浮游植物群落结构变化的环境因子也不相同,其群落结构的特征,往往也是水环境状况的重要指标[9-12]。本文首次较系统地调查分析了嫩江下游浮游植物群落组成、丰度及其空间分布特征,应用典范对应分析(canonical correspondence analysis,CCA)初步探讨了嫩江下游浮游植物群落与环境因子间的关系,为利用浮游植物进行河流水质监测工作提供基础数据。
1 材料与方法
1.1浮游植物样品采集与分析
2011年5月和7月根据嫩江下游的气候特点,共布设10个采样点,进行采样工作。采样具体位置(见图1)。定性样品用25#的浮游生物网(网孔直径0.064 mm)在水体表面(0~0.5 m)按“∞”字形拖取3-5 min,滤液用1.5%体积的鲁哥试液和2%~4%甲醛固定,沉淀48 h,浓缩为30 mL保存。显微镜检计数时充分摇匀,吸取0.1 mL滴入0.1 mL计数框内计数、分析、鉴定[13-14]。
1.2环境因子测定
透明度(SD)用塞奇氏盘测定;水温(WT)、酸碱度(pH)、溶解氧(DO)、叶绿素a(chlorophyll a)、电导率(COND)用多功能水质分析仪YSI-6600来测定,总氮(TN)、总磷(TP)、化学需氧量(CODMn)、5日生化需氧量(BOD5)等参照《水和废水监测分析方法》(国家环保总局,2002)测定。
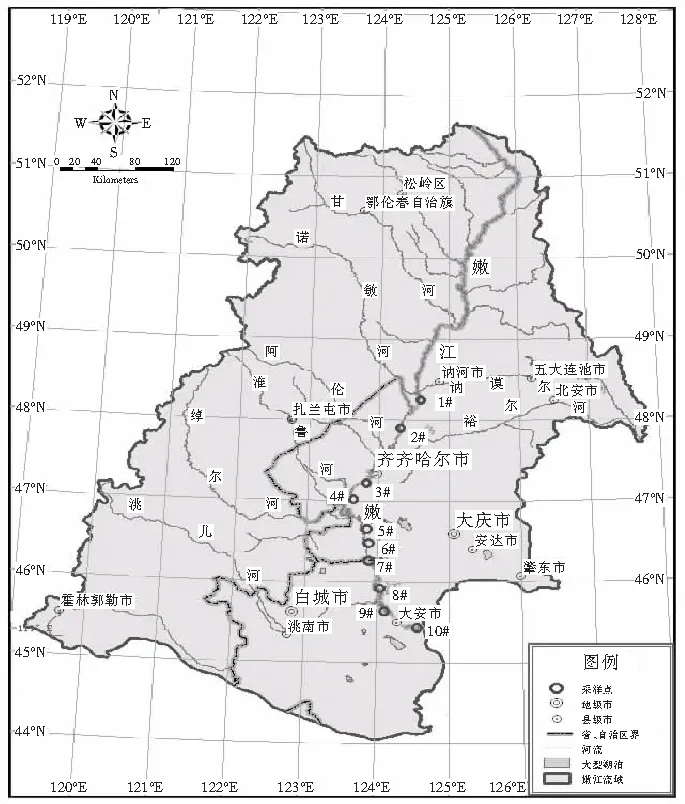
图1 嫩江下游浮游植物采样点分布示意图
1.3数据处理
1.3.1 多样性指数的计算 多样性指数包括优势度、Shannon-Wiener指数(H′)、Pielou均匀度指数(J′)、Margalef丰富度指数(d),计算公式如下[15-19]:



式中,ni为第i种的数量,N为采集样品中的所有种类总个体数;S为采集样品中的种类总数;fi为该种在各样品中出现的频率,y>0.02 为优势种。
采用Canoco for Windows 4.5软件对物种数据和环境数据进行典范对应分析,物种数据采用浮游植物丰度指标,按照物种在各样点出现的频度>12.5%,物种在至少一个样点的相对密度≧1%[20]入选矩阵,物种矩阵经过lg(x+1)转换,环境数据进lg(x+1)转换[21],排序结果用物种-环境因子关系的双序图表示[22]。
2 结果与分析
2.1嫩江下游浮游植物群落结构特征
2.1.1 浮游植物的种类组成和优势种 2011年春季(5月)和夏季(7月),对嫩江下游浮游植物调查,共鉴定出浮游植物7门101种及变种。其中:硅藻门52种及变种,占总数51.5%,绿藻门24种及变种,占23.8%,蓝藻门14种,占13.9%,金藻门6种,占5.9%,裸藻门2种,占2.0%,隐藻门2种,占2.0%,甲藻门1种,占1.0%。从季节的变化上看,春季共鉴定浮游动物80种;夏季共鉴定浮游植物48种。不同季节浮游植物主要优势种类不同,春季(5月)优势种为8种,夏季(7月)为5种,在春季(5月)和夏季(7月)均形成以硅藻门为优势的浮游植物群落,见表1。
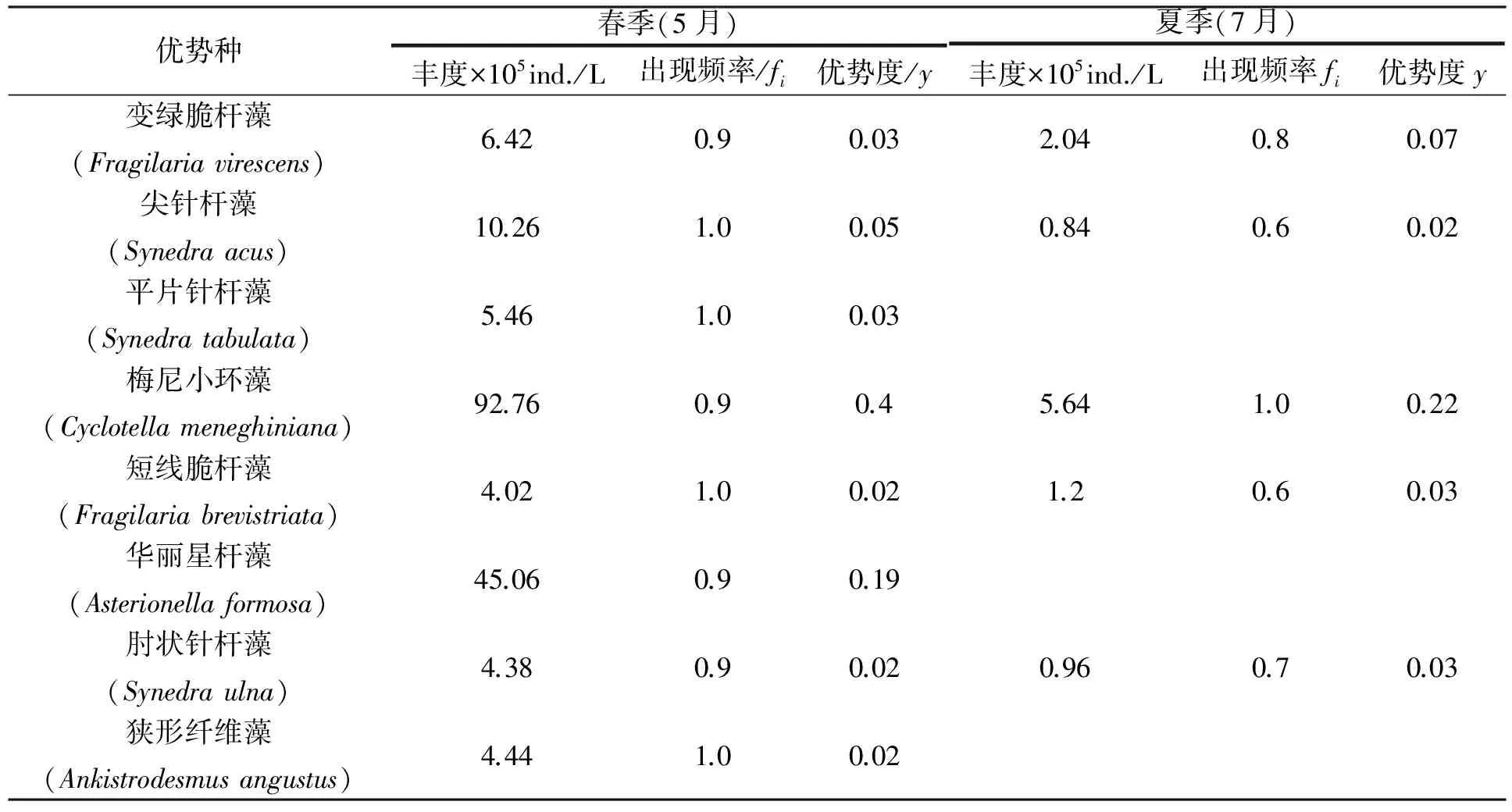
表1 嫩江下游不同季节浮游植物优势种及其丰度
2.1.2 浮游植物的数量特征 嫩江下游浮游植物数量分布特征,春季和夏季各采样点浮游植物细胞丰度在0.60×105~32.4×105ind./L之间,生物量在0.03~3.19 mg/L之间。其中:春季9#采样点浮游植物丰度最大,春季6#采样点次之,夏季3#和6#采样点浮游植物丰度最小;春季6#采样点浮游植物的生物量最大,春季9#采样点次之,夏季6#采样点生物量最小。如图2所示嫩江下游浮游植物丰度和生物量的变化趋势基本一致。
2.1.3 生物多样性指数 嫩江下游浮游植物多样性指数(H′)、均匀度指数(J′)和丰富度(d)的变化如图3所示, Shannon-Wiener多样性指数(H′)在2.00~3.94之间变化;Pielou均匀度指数(J′)的在0.46~0.98之间变化;Margalef丰富度指数(d)在1.72~4.89之间变化。
使用Shannon-Wiener指数值评价结果显示,嫩江下游春季和夏季整体上水体轻污染或无污染(其中1>H′>0为重污染,1>H′>3为中污染,H′>3为轻污染或无污染)。经计算后采用Pielous均匀度指数(J′)评价结果显示,嫩江下游为轻污染或无污染水质(其中0.3>J′>0为重污染,0.>J′>0~3为中污染,0.8>J′>0.5为轻污染或无污染)。经计算后采用Margalef指数值(d)评价结果显示,春季重污染点位有30%,中污染点位有40%,轻污染或无污染点位有30%;夏季重污染点位有80%,中污染点位有20%(其中3>d>0为重污染,4>d>3为中污染,d>4为轻污染或无污染)。

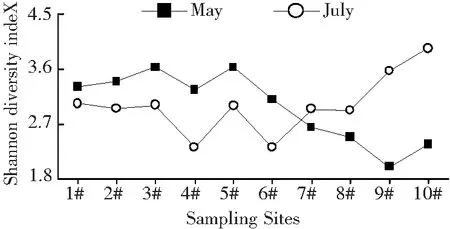


图3 嫩江下游不同季节浮游植物的多样性、均匀度、丰富度指数变化
2.2嫩江下游浮游植物与环境因子的关系
根据浮游植物出现频率和相对丰度,选取了22种浮游植物用于CCA分析,浮游植物代码见表2。分析结果中,第1、第2排序轴的特征值分别为0.178 和0.148,环境因子轴与物种排序轴之间的相关系数分别为0.891 和0.977(表3)。物种变异积累百分数分别为23.5%和43.0%;物种-环境变异积累百分数分别为36.3%和66.5%;2个物种排序轴近似垂直,相关系数为0.044,2个环境排序轴的相关系数为0(表3),说明了排序结果可靠[23],排序轴与环境因子间线性结合的程度较好地反映了物种与环境之间的关系。在由主轴l和主轴2构成的排序图中,环境因子用带有箭头的线段表示,向量长短代表了其在主轴中的作用,所以经图4可知,水体的水温、电导率、总磷是影响嫩江下游浮游植物群落结构的主要因子。

表2 CCA分析中浮游植物种类代码
3 讨论与结论
在调查期内,共观察到浮游植物7门101种及变种,浮游植物的细胞丰度范围在0.60×105~32.4×105ind./L之间。有研究表明,营养较低的水体中常以甲藻、隐藻、硅藻类占优势,而富营养水体则常以绿藻、蓝藻类占优势[24]。调查发现,嫩江下游群落组成以硅藻为主,同时结合水质生物学评价,表明大多数点位水体营养化程度不高。
表3 CCA排序中前2个排序轴的特征值与环境排序轴间的相关系数

SPECAX1SPECAX2ENVIAX1ENVIAX2SPECAX11.000SPECAX20.0441.000ENVIAX10.8910.0001.000ENVIAX20.0000.9770.0001.000WT/℃0.762-0.1280.855-0.131SD/m-0.5100.412-0.5720.422pH0.1310.4340.1470.444DO/mg·L-1-0.6100.227-0.6850.232COND/μs·cm-10.169-0.8620.189-0.882NH4-N/mg·L-10.334-0.7480.375-0.765TOC/mg·L-1-0.6470.249-0.7260.255CODMn/mg·L-1-0.699-0.105-0.785-0.107BOD5/mg·L-1-0.710-0.139-0.796-0.143TN/mg·L-1-0.508-0.257-0.570-0.263TP/mg·L-1-0.392-0.776-0.440-0.795
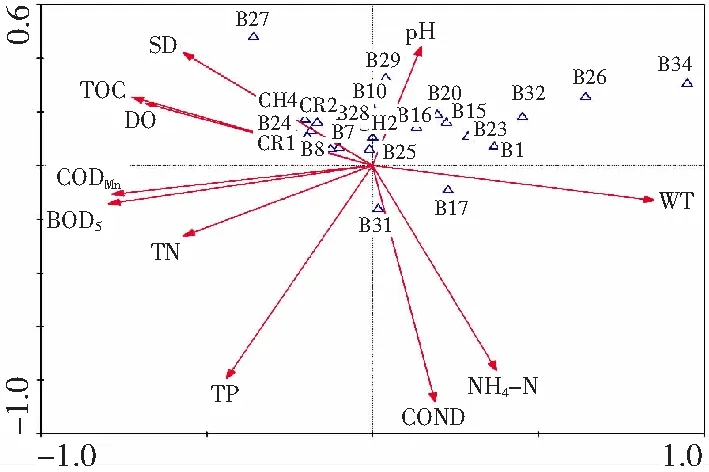
图4 嫩江下游浮游植物与环境因子的CCA三维排序图
群落物种多样性是群落组织独特的生物学特征,它反映了群落特有的物种组成和个体密度特征[25]。一般而言,种类越多或各物种间比例越均匀,群落物种的Shannon-Wiener指数值越大。物种多样性也是反映水体营养状况的重要参数,浮游植物的优势种群及群落结构特征指数的变化可在一定程度上反映环境的变化。嫩江下游浮游植物群落Shannon-Wiener多样性指数的变化在2.00~3.94之间,故整体处于轻-中污染状态,说明水质已经受到一定程度的污染。嫩江下游各采样点浮游植物丰度的空间分布并不是均匀的(图2),这与各采样点的生态及营养条件的差异是分不开的,1#、2#、3#、5#、8#采样点水流较快,含砂量大,两岸多被植被覆盖,水质贫瘠,有机物含量低,因此,浮游植物密度较低;而其他江段尤其是9#采样点的江段,水流较慢,两岸土壤大多裸露,人类活动密集,河水含砂量减少,肥沃度逐渐增加,有机物含量充足,因此这个采样点浮游植物密度丰度要高于其他点位。
通过环境因子对嫩江下游浮游植物种类、密度影响的分析结果表明,水温、电导率、总磷电导率是影响嫩江下游浮游植物密度及种类的重要因素。温度对藻类生命活动的影响主要通过控制光合作用的酶促反应或呼吸作用强度,直接影响藻类的生长,并且通过控制各种理化过程间接影响藻类的生长[26]。硅藻的生长的最适温度为10~25 ℃[27],调查期间嫩江下游的水温在9.38~26.05 ℃之间,平均温度为19.39 ℃,因此,水温是嫩江下游浮游植物春季和夏季硅藻丰度增多的主要原因。嫩江下游有机物质来源主要有上游城市和当地居民的生活污水、农业生产地表径流等,进入水体的有机物经氧化分解,最终变为浮游植物可直接利用的营养盐。已有研究表明,营养盐的增加在一定范围内可以引起藻类密度的增加,是导致藻类繁茂的主要原因[28],这是由于水体中的营养盐作为浮游植物赖以增殖的基础,其数量与分布能影响浮游植物的数量动态,同时由于水体水质的电导率高低与营养盐浓度有关[29]。因此,电导率和总磷浓度与嫩江下游浮游植物密度及属类数呈极显著相关性,与许多国内外研究者[30-32]的调查结果相类似。但是不同区域水体对浮游植物影响的环境因子并不一致,有研究表明[33],透明度、总磷对浮游植物的影响最大;另外除主要的环境因子外,人为干扰以及浮游动物的下行效应[21]等在很大程度上也影响水域内浮游植物的群落结构[34]。
[1] 吴东芳.嫩江干流点污染源入河排污口现状分布研究[D].长春:吉林大学,2010.
[2]卢映东,刘哲人,郑凤,等.嫩江齐齐哈尔江段污染现状分析及管理对策[J].黑龙江环境通报,2007,37(2):52-58.
[3]霍堂斌.嫩江下游水生生物多样性及生态系统健康评价[D].哈尔滨:东北林业大学,2013.
[4]万晔,杨华,刘吉堂,等.连云港田湾核电站邻近海域网采浮游植物群落的变化[J].江西农业学报,2014(5):104-109.
[5]Irigoien X,Harris R P,Verheye H M,etal.Copepod hatching success in marine ecosystems with high diatom concentrations[J].Nature,2002,419(6905):387-389.
[6]Cardinale B J,Palmer M A,Collins S L.Species diversity enhances ecosystem functioning through interspecific facilitation[J].Nature,2002,415(6870):426-429.
[7]Li W.Macroecological patterns of phytoplankton in the northwestern North Atlantic Ocean[J].Nature,2002,419(6903):154-157.
[8]陈立婧,张薇,边佳胤,等.2012年小洋山近岸水域浮游植物群落结构的特征[J].上海海洋大学学报,2014,23(3):395-402.
[9]邓文丽,刘均平,王晓星,等.北京野鸭湖浮游植物群落结构与水质关系研究[J].湿地科学,2013(1):27-34.
[10]陈家长,孟顺龙,尤洋,等.太湖五里湖浮游植物群落结构特征分析[J].生态环境学报,2009(4):1358-1367.
[11]孙军,田伟.2009年春季长江口及其邻近水域浮游植物——物种组成与粒级叶绿素a[J].应用生态学报,2011(1):235-242.
[12]谭香,夏小玲,程晓莉,等.丹江口水库浮游植物群落时空动态及其多样性指数[J].环境科学,2011(10):2875-2882.
[13]胡鸿钧,魏印心.中国淡水藻类-系统、分类及生态[M].北京:科学出版社,2006.
[14]毕列爵,胡征宇.中国淡水藻志(第八卷)绿藻门[M].北京:科学出版社,2004.
[15]孙军,刘东艳.多样性指数在海洋浮游植物研究中的应用[J].海洋学报(中文版),2004(1):62-75.
[16]王珊,于明,刘全儒,等.东江干流浮游植物的物种组成及多样性分析[J].资源科学,2013(3):473-480.
[17]刘海平,叶少文,杨雪峰,等.西藏尼洋河水生生物群落时空动态及与环境因子的关系:1.浮游植物[J].湖泊科学,2013(5):695-706.
[18]刘金殿,顾志敏,杨元杰,等.长诏水库浮游植物群落结构及水质评价[J].生态学杂志,2012(11):2865-2871.
[19]郝媛媛,孙国钧,张立勋,等.黑河流域浮游植物群落特征与环境因子的关系[J].湖泊科学,2014(1):121-130.
[20]Lopes M R M,Bicudo C E M,Ferragut M C.Short term spatial and temporal variation of phytoplankton in a shallow tropical oligotrophic reservoir,southeast Brazil[J].Hydrobiologia,2005,542:235-247.
[21]Flores L N,Barone R.Phytoplankton dynamics in two reservoirs with different trophic state (Lake Rosamarina and Lake Arancio,Sicily,Italy)[J].Hydrobiologia,1998,369/370:163-178.
[22]Ng S L,Sin F S.A diatom model for inferring sea level change in the coastal waters of Hong Kong[J].Journal of Paleolimnology,2003,30:427-440.
[23]Ter Braak CJF.Canonical correspondence analysis:A new eigenvector technique for multivariate direct gradient analysis[J].Ecology,1986,67:1167-1179.
[24]庞清江,李白英.东平湖水体富营养化评价[J].水资源保护,2003,19(5):42-44.
[25]李晶.扎龙湿地浮游植物生态特征及其环境效应研究[D].哈尔滨:哈尔滨工业大学,2012.
[26]Blinn D W.Diatom community structure along physico-chemical gradients in saline lakes[J].Ecology,1993,74:1246-1263.
[27]Cohn S A,Farrell J F,Munro J D,etal.The effect of temperature and mixed species composition on diatom motility and adhesion[J].Diatom Research,2003,18(2):225-243.
[28]Flores L N,Barone R.Phytoplankton dynamics in two reservoirs with diferent trophic state(Lake Rosamarina and Lake Arancio,Sicily,Italy)[J].Hydrobiologia,1998,369/370:163-178.
[29]黄钰铃,陈明曦,刘德富.不同氮磷营养及光温条件对蓝藻水华生消的影响[J].西北农林科技大学学报(自然科学版),2008,36(9):93-100.
[30]Christopher E W,Pan Y D.Using diatom assemblages to as-sess urban stream conditions[J].Hydrobiologia,2006,561:179-189.
[31]Rimet F L,Cauchie H M,Hoffmann L.Regional distribution of diatom assemblages in the headwater streams of Luxem-bourg[J].Hydrobiologia,2004,520:105-117.
[32]江源,王博,杨浩春,等.东江干流浮游植物群落结构特征及与水质的关系[J].生态环境学报,2011,20(11):1700-1705.
[33]Arhonditsis G B,Winder M,Brett MT,etal.Patterns and mechanisms of phytoplankton variability in Lake Washington (USA)[J].Water Research,2004,38:4013-4027.
[34]Maraloni G,Tesolin G,Sacullo F,etal.Factors regulating summer phytoplankton in a highly eutrophic Antarctic lake[J].Hydrobiologia,2000,432:65-72.
CommunityStructureofPhytoplanktonsintheDownstreamofNenjiangRiverandRelatedAffectingFactors
BIAN Shaowei1,YU Hongxian2*,MA Chengxue2,HUO Tangbin3
(1.Tianjin Environmental Monitoring Centre,300191,Tianjin,PRC;2.Northeast Forestry University,150040,Harbin,PRC;2.Chinese Academy of Fishery Sciences.Heilongjiang River Fisheries Research Institute,150070,Harbin,PRC)
An investigation was conducted on the phytoplankton′s community composition,abundance,and their relations with environmental factors in the downstream of Nenjiang River in spring (May) and autumn(July),2011.A total of 101 phytoplankton species were identified,belonging to 7 phyla.Dominant species are completely from Bacillariophyta in spring and autumn.they areFragilariavirescens、Synedraacus、Cyclotellameneghiniana、Fragilariabrevistriata、Synedraulnaand so on.The phytoplankton′s biomass of different sampling sites were from 0.03 mg/L to 3.19 mg/L,and abundance at 0.60×105to 32.40×105ind/L in different seasons.Shannon-Wiener diversity index from 2.00 to 3.94,Pielou′s index from 0.46 to 0.98,and Margalef′s index from 1.72 to 4.89.Canonical correspondence analysis (CCA) showed that water temperature was the most important factor affecting the phytoplankton′s community structure,and total phosphorous concentration also played important role for the community structure.The CCA ordination plots could well display the phytoplankton′s community structure and its relationships with environmental factors.
Nenjiang River;phytoplankton;community structure;environmental factor;canonical correspondence analysis (CCA)
2014-05-21;
2014-08-21
卞少伟(1986-),男,硕士,主要研究方向:水环境生物学。
国家自然科学基金项目(40830535);国家水体污染控制与治理科技重大专项资助(2008ZX07207-010-04)。
10.13990/j.issn1001-3679.2014.05.013
Q949.2
A
1001-3679(2014)05-0630-06
*通讯作者:于洪贤(1962-),女,博士,教授,博士生导师,研究方向:湿地保护与利用、水生生物分类及鉴定、水环境监测等。Email:chinayhx@163.com。
