白腐菌产漆酶的发酵条件研究
2014-09-08赵美丽屈文峰边风根徐晓安
赵美丽,屈文峰,边风根,徐晓安
(1.江西省化学工业学校,330012,南昌;2.江西昌九生化农科化工有限公司,330012,南昌)
白腐菌产漆酶的发酵条件研究
赵美丽1,屈文峰2,边风根1,徐晓安1
(1.江西省化学工业学校,330012,南昌;2.江西昌九生化农科化工有限公司,330012,南昌)
漆酶(E.C.1.10.3.2)是一类含铜的氧化还原酶,其可以催化对苯二酚(也叫氢醌)氧化生成对苯醌,也常被称为对苯二酚氧化酶。漆酶一般存在于真菌和植物中,由于具有较高的稳定性和较好的底物专一性,在印染和环境有机毒性化合物的降解、专用生物传感器的构建、以及造纸领域有机废弃物的生物加工利用等方面具有实际工业应用。考察了白腐菌的培养和产漆酶条件,对白腐菌产漆酶的培养条件和培养基进行了优选。结果显示,以小麦皮为碳源,硫酸铵和尿素为氮源,白腐菌生长产酶的适宜培养温度为28 ℃,pH值为3.5~6.0,培养基的C/N比以20合适。当培养基中添加一定的木质素沉淀物和葡萄糖时对白腐菌液体发酵产漆酶具有明显的促进作用,菌体发酵液中加入10 g/L的葡萄糖、6 g/L木质素时发酵产漆酶的活力达到最大值。
白腐菌;漆酶;C/N比;酶活
0 引言
漆酶(E.C.1.10.3.2)是一类含铜的氧化还原酶,能催化对苯二酚(也叫氢醌)氧化生成对苯醌[1],因此常被称为对苯二酚的氧化酶。漆酶一般存在于真菌和植物中,由于有较高的稳定性和较为广泛的底物专一性,在环境和印染有机有毒化合物的降解、生物传感器的构建、造纸业废液的处理和综合加工利用等领域具有广泛的应用[2]。尤其对于酚类污染物的处理,作为生物催化剂的真菌漆酶应用前景非常好。
目前漆酶生产主要采用微生物发酵法,工艺方法有固体培养和液体发酵2种方式[3-6]。本实验采用液体发酵方式,探讨培养基组成和发酵条件对白腐菌生长和漆酶生产的影响。
1 材料和方法
1.1菌种
白腐菌(whiterotfungNS8),南昌大学生命科学学院保藏。
1.2培养基
1.2.1 CPDA培养基(综合培养基) 马铃薯200 g,葡萄糖20 g,磷酸二氢钾3 g,硫酸镁1.5 g,维生素B 110 mg,琼脂18~20 g,自来水1 000 mL,pH5~6。
1.2.2 发酵培养基(L) 可溶性的淀粉80.0 g,吐温6.0 g,愈创木酚20 mmol,氯化铵20.0 g,KH2PO48.0 g,MgSO4·7H2O 2.0 g,CaCl2·2H2O 4.0 g,VB10.016 g,含微量元素的溶液160 mL,pH为自然。
1.3培养发酵
1.3.1 菌种的培养 在装有50 mL液体种子培养基的250 mL摇瓶中,放入适量直径为5 mm的左右的玻璃珠微粒,灭菌后接入白腐菌斜面菌丝体。在180 r/min,30 ℃,恒温,振荡培养4 d,制成液体种子液。
1.3.2 摇瓶发酵产酶 在250 mL摇瓶中装入液体发酵培养基50 mL,灭菌后接入液体菌种(按体积比为10%),振荡培养7.5 d。发酵液于4 800 r/min下离心25 min,取其中的上层清液即为粗酶液。
1.4漆酶活力的测定
酶活测定方法—分光光度法。目前国际上比较常用的测定漆酶的酶活的方法是以ABTS为底物来测定,主要是基于:1)ABTS容易溶解于水中,稳定性好,可以在常温下放置半年;2)测定的反应过程非常简单,只要ABTS反应后生成阳离子自由基[7],这种阳离子自由基能在水溶液中较稳定地存在几小时甚至几天,并且有明显的绿色便于测定;3)和漆酶共存时,ABTS的绿色溶液的摩尔吸光系数较高,可以保证测定酶活时具有较大的灵敏度; 4)ABTS在使用中没有任何的毒副作用[8]。
采用分光光度法测定酶活时,酶活的单位以3种方式来定义:1)每分钟所氧化的底物为1 mmol[9];2)每分钟所氧化的底物为1 μmol[10];3)每分钟吸光度的值发生0.001的改变[11]。其中2是定义酶活单位中用得最多的方法,本实验采用的是第2种方法。在测定漆酶的活力时,根据每分钟所氧化的底物的1 μmol定义酶活。
计算漆酶的酶活公式为:

式中:B为酶活值;V总,V酶为反应体系中总体积和反应中酶液体积;ε为吸光系数。
漆酶的活力的定义:在一定条件下,每分钟催化1 μmol的产物生成所需要的酶定义为1单位。
选用漆酶底物为ABTS,总反应混合物为6 mL,其中粗漆酶液200 μL,40 μmol/L ABTS及6 mL缓冲液(pH6.5),反应时间为15 min,反应温度30 ℃。取含酶液0.1 mL,加入HAc-NaAc(pH4.6)缓冲液3 mL,混匀,加入ABTS 0.4 mL,放置30 s,每15 s读取1次420 nm下吸光值,共读取6个数值。根据数据判断,如果吸光度的值增长迅速,则将酶液稀释2~5倍再次测定,直至吸光度数值变化不大,并且吸光度的值在0.2~0.8之间。
酶活的计算:吸光度变化的斜率×4 000×稀释倍数。
2 结果与讨论
2.1C/N比对产漆酶的影响
C/N比是产酶过程中培养基的重要影响因素,通过实验寻找最佳的C/N比。本实验以小麦皮做碳源,改变初始培养基中的氮源(尿素和硫酸铵)用量,分析不同C/N比对白腐菌产漆酶的影响,实验结果如表1。
从表1可知,C/N比在逐渐增大的过程中,漆酶的活力表现为先上升后下降。当C/N比为20时,漆酶的活力和产率均达到最高,分别为4 391.9IU/mL和639.5 IU/mL·d。
2.2pH值对产酶的影响
在产酶过程中,pH值的大小可以影响的方面较多,如营养物质的状态、菌体细胞膜的稳定性及细胞膜对所需物质的吸收能力等方面。本实验在pH为2.0~8.0范围内取若干点进行实验。
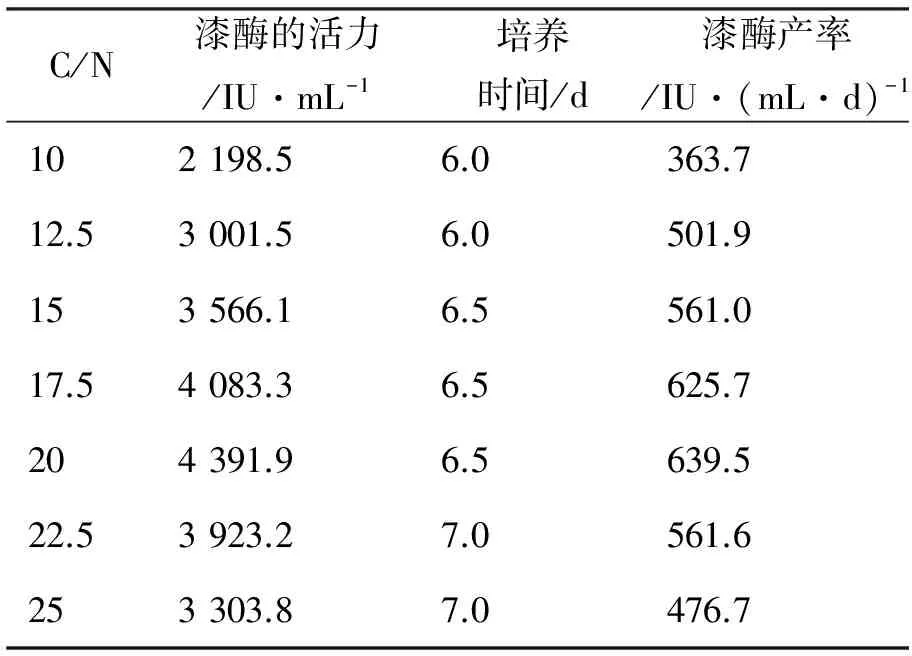
表1 C/N对产漆酶的影响
分别配制pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0的液体产酶培养基。接种后培养,分析结果如图1所示。从图1中可以看出,在pH值大于7时,生产漆酶的活力很低,当培养基的pH值控制在3.5~6.0时,生产漆酶的活力较高。为了操作简便和对细菌污染的抑制,底物溶液以略偏酸为宜,选择初始pH值为4时,漆酶分泌能力较强。
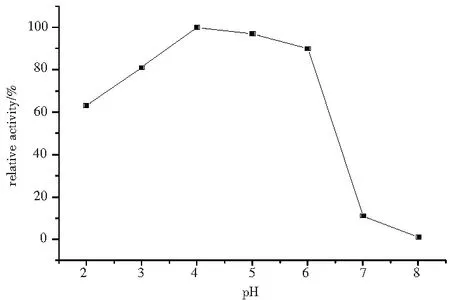
图1 pH值对产酶的影响
2.3培养温度对产酶的影响
环境温度也是影响真菌产酶的因素,如果温度太高或太低,都不利于酶的生产。检测白腐菌产酶最适温度在25~40 ℃温度范围内进行实验,用标准方法测定酶活。实验检测结果如图2所示。从图2看出在不同温度下液体发酵产酶的活力有明显差异。在30 ℃条件下,漆酶的活力在培养第9天时达到4 480.8 IU/mL。当温度控制在28 ℃,在第9天时漆酶的活力达到4 838.3 IU/mL。
从图2中可以看出,最佳的培养温度为28 ℃。温度过高或过低都会影响漆酶的分泌。产酶过程中最高峰出现在第9天,然后下降。这种现象可能因为在培养初期,随着培养时间的延长,菌种的数量不断增多,漆酶产量也跟着不断提高,在第9天时分泌漆酶的量达到最大;但培养时间继续延长时,培养液中营养物质却逐渐缺少,菌种的代谢能力下降,使得漆酶的产出能力下降。
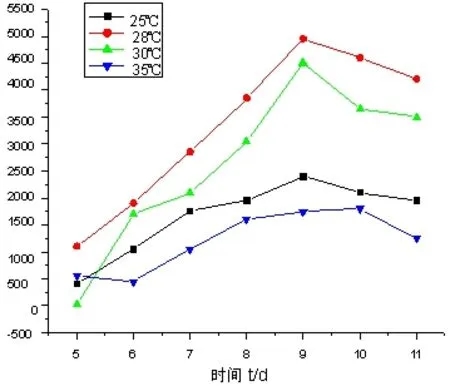
图2 培养温度对白腐菌分泌漆酶的影响
2.4底物对白腐菌产漆酶的影响
2.4.1 木质素沉淀物的用量对白腐菌产漆酶的影响 木质素是一种漆酶的天然底物,利用木质素沉淀物作为底物进行发酵产酶,正好可以废物利用、治理环境污染,而且直接降低漆酶的生产成本。
在摇瓶发酵液中分别添加不同量的木质素沉淀物发酵生产漆酶,7 d后检测酶活力,实验的结果如表2所示,可以看出添加木质素沉淀物对白腐菌产酶有一定的促进作用。在一定的浓度下,漆酶的活力随着木质素沉淀物量的增加逐渐升高。当木质素沉淀物的添加量为6 g/L时,生产漆酶的酶活达7 055.3 IU/mL,比没有添加木质素沉淀物的发酵产酶活力提高5.0倍。再增加木质素沉淀物的量,发酵产酶的酶活的变化不大。
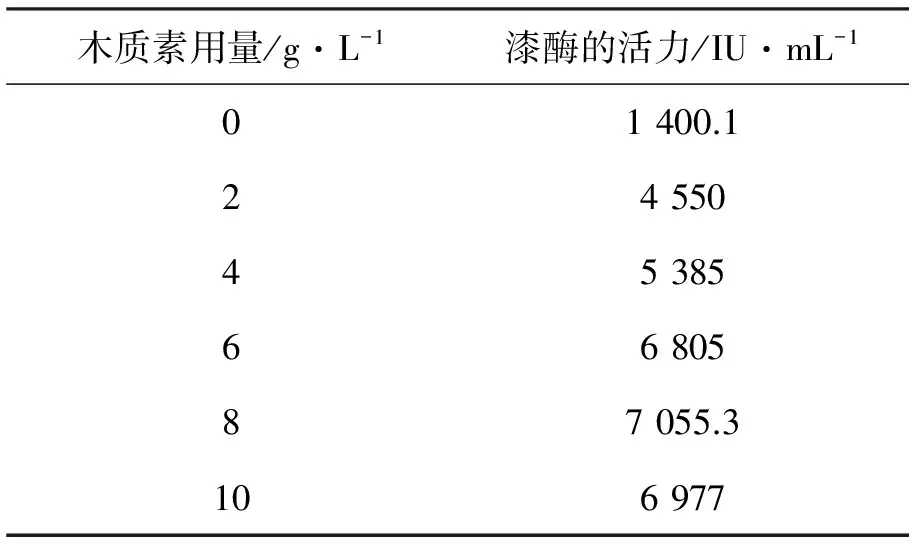
表2 木质素用量对白腐菌产酶的影响
2.4.2 葡萄糖的用量对白腐菌漆酶产量的影响 由于木质素是一种高分子的化合物,一般的微生物是不能直接利用的,所以常常会在培养基中加入适量的葡萄糖,这样能促进早期菌丝体的生长,使得漆酶的产量能在发酵的后期得到明显提高。实验结果如图3所示。从图3中可以看出,当发酵液含有木质素沉淀物的量为6 g/L,葡萄糖的添加量在10 g/L比较适合。如果加入的葡萄糖的量不足时,菌丝体生长缓慢而导致它在后期产出酶的酶活偏低,但加入过量的葡萄糖,会使菌丝体早期过度的生长,对后期漆酶的合成也不利。
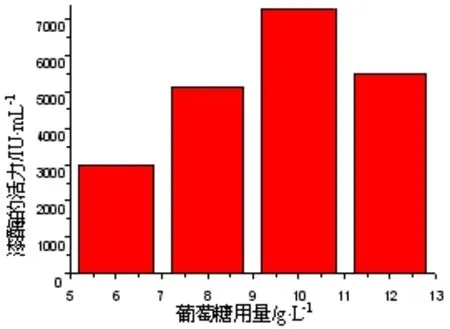
图3 葡萄糖用量对白腐菌产酶的影响
3 结论
以小麦皮为白腐菌产漆酶的碳源,硫酸铵和尿素为氮源,比较合适的C/N比是20。白腐菌发酵生产漆酶的适宜培养温度为28 ℃,pH值为3.5~6.0。发酵液培养基添加木质素沉淀物和葡萄糖对白腐菌发酵产漆酶具有明显的促进作用,当木质素加量为6 g/L,葡萄糖添加量为10 g/L时,白腐菌液体发酵的菌体生长和发酵液中漆酶的产量得到明显提高。
[1]Givaudan A,Effosse A,Faure D,etal.Polyphenol oxidase inAzospirillumlipoferumisolated from rice rhizosphere:evidence for laccase activity in non-motile strains ofAzospirillumlipoferum[J].FEMS Microbiology Letters,1993,108(2):205-210.
[2]Leontievsky A A,Vares T,Lankinen P,etal.Blue and yellow laccases of ligninolytic fungi[J].FEMS Microbiology Letters,1997,156:9-14.
[3]季立才,胡培植.漆酶的结构、功能及其应用[J].氨基酸和生物资源,1996,18(1):25-29.
[4]缪静,姜竹茂.漆酶的最新研究进展[J].烟台师范学院学报(自然科学版),2001,17(2):146-150.
[5]周易勇.漆酶的分布[J].中国生漆,1992,11(3):26-27.
[6]许颖,兰进.真菌漆酶研究进展[J].食用菌学报,2005,2(1):57-64.
[7]张敏,肖亚中,龚为民.真菌漆酶的结构和功能[J].生物学杂志,2003,20(5):6-8.
[8]季立才.漆酶中铜的研究[J].中国生漆,1990,9(4):22-30.
[9]Sebastien M,Sylvie A,Bemard L,etal.Differential regulation by Ambient pH of putative virulence factor secretion by the phytopathogenic fungusBotrytiscinerea[J].FEMS Microbiology Ecology,2003,43:359-366.
[10]Rancano G,Lorenzo M,Molares N,etal.Production of laccase byTrametesversicolorin an airlift fermentor[J].Process Biochemistry,2003,39(4):467-473.
[11]张敏,肖亚中,蒲春雷.白腐真菌AH28-2菌株发酵合成漆酶初步研究[J].微生物学通报,2002,17(3):37-42.
FermantationConditionsofWhiteRotFungiforLaccaseProducing
ZHAO Meili1,QU Wenfeng2,BIAN Fenggen1,XU Xiaoan1
(1.Jiangxi Chemical Industry School,330012,Nanchang,PRC;2.Nine Chang Jiangxi Agricultural Chemical Co.,Ltd.,330012,Nanchang,PRC)
Laccase (E.C.1.10.3.2) is a kind of containing copper oxidoreductase,it could to catalyze hydroquinone oxidation,also be known as hydroquinone oxidase.Laccase exists generally in fungi and plants.Because it has high stability and broad substrate specificity,so be used widely in the toxicant degradation,biosensors, and paper industry.The white rot fungi culture and laccase producing condition had been investigated.The experiment result showed that the wheat skins and ammonium sulfate/urea were the appropriate carbon source and nitrogen source respectively for white rot fungi growth and laccase produced.The optimum conditions were as following:the C/N=20,culture temperature 28 ℃ and pH 3.5~6.Addition of lignin precipitate and glucose has obvious effect on white rot fungi laccase production in liquid fermentation.when the lignin precipitate content reached 6 g/L and glucose 10 g/L in fermentation broth,the laccase activity produced reached maximum.
white rot fungi;laccase;C/N;enzyme activity
2014-06-06;
2014-08-06
赵美丽(1973-),女,江西永修人,硕士,主要从事仪器分析及食品分析工作。
10.13990/j.issn1001-3679.2014.04.025
TQ925
A
1001-3679(2014)04-0527-04
