IGF-1诱导外胚间充质细胞向成骨细胞分化的实验研究
2014-09-08孙吏聪张玉昆
孙吏聪,李 松,张玉昆
IGF-1诱导外胚间充质细胞向成骨细胞分化的实验研究
孙吏聪1,李 松2,张玉昆3
目的探讨胰岛素样生长因子-1(IGF-1)诱导胎鼠颌突外胚间充质细胞向成骨细胞(OB)分化的作用。方法采用消化贴壁法培养SD 胎鼠外胚间充质细胞,建立外胚间充质细胞的体外培养细胞模型。在含有20 ng/mL IGF-1培养基中,连续培养10 d。HE染色,观察细胞形态变化;抗Ι型胶原单抗免疫组化染色鉴定细胞性质;碱性磷酸酶活性检测。结果经IGF-1培养的外胚间充质细胞,10 d 后在倒置显微镜下可见细胞形态发生明显变化;细胞爬片HE染色,可见细胞呈不规则形态,边缘伸出多个突起;抗Ι型胶原单抗免疫组化染色阳性;碱性磷酸酶活性增高。结论外胚间充质细胞经IGF-1的诱导培养,细胞形态出现类成骨样改变,同时细胞分泌碱性磷酸酶和Ι型胶原,出现类似成骨细胞的功能性改变。
外胚间充质细胞;成骨细胞;IGF-1;细胞分化;免疫组化
外胚间充质细胞是在胚胎发育过程中由颅神经嵴向腹外侧迁移到达颌突中胚层后形成的,是一种具有多向分化潜能的干细胞[1],可进一步分化为成牙本质细胞和成骨细胞,并最终参与形成上、下颌骨等[2]。上颌骨骨缝中间充质细胞向成骨细胞转化可以促进上颌骨的发育。间充质细胞向成骨细胞分化受到多种因素的影响,其中与骨缝中细胞因子水平有密切关系。本实验采用胰酶消化法分离间充质细胞,经反复贴壁法取得纯化外胚间充质细胞,进而建立SD 胎鼠颌突外胚间充质细胞模型;经过胰岛素样生长因子-1 (IGF-1)诱导培养,发现其可以向成骨细胞分化。探讨外胚间充质细胞向成骨细胞分化的机制,有助于颅颌面生长发育的研究,对颅颌面畸形的防治均有重要的意义。
1 材料和方法
1.1 组织来源和试剂妊娠10~11 d SD 大鼠(昆明医学院重点实验室),DMEM/F12 (D/F12)培养基(Gibco,美国),胎牛血清(FBS), Hank’s 液(Solarbio科技,北京),2.5 g/L胰酶(Gibco,美国),抗波形丝蛋白单克隆抗体(Vimentin,美国),SABC 免疫组化试剂盒(DAKO,美国),DAB显色剂(武汉博士德), IGF-1(Peprotech,英国),抗Ι型胶原单抗(Santa Cruz,美国),碱性磷酸酶(ALP)检测试剂盒(北京中生公司)。
1.2 主要仪器相差倒置显微镜 (OLYMPUS IMT-2 USA),CO2恒温培养箱 (上海市实验仪器总厂),超净工作台(苏州净化TDGC2J-1型),图像采集系统(德国Leica DM LS2型显微镜及Leica DFC320型CCD)。酶标板自动读数仪(Bioteck BL340,美国)。
1.3 SD胎鼠颌突外胚间充质细胞的分离培养、免疫组化鉴定无菌条件下剖腹取出10~11 d 的SD胎鼠,采用消化贴壁法培养SD 胎鼠外胚间充质细胞。利用上皮细胞和间充质细胞对胰酶的耐受性不同,根据贴壁时间的差异纯化间充质细胞(图1)。做HE染色,光镜观察细胞形态(图2、3)。用SABC法进行抗波形丝蛋白(VIM)免疫组化染色,胞浆呈阳性着色,鉴定为外胚间充质细胞(图4)。
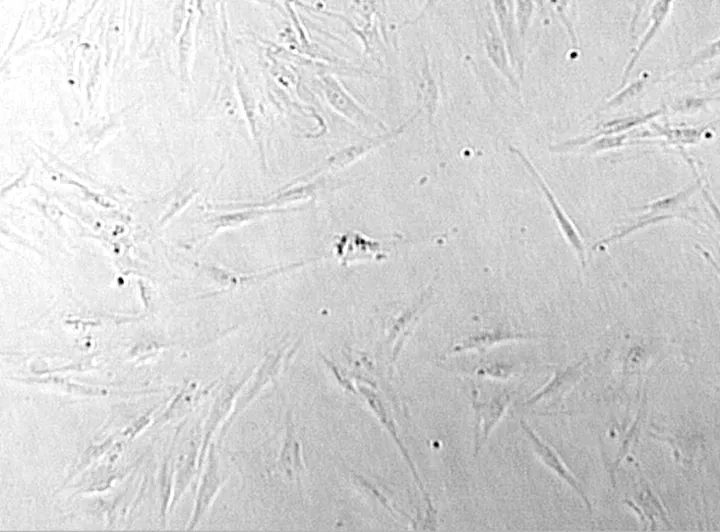
图1 第3代间充质细胞生长情况(×100)
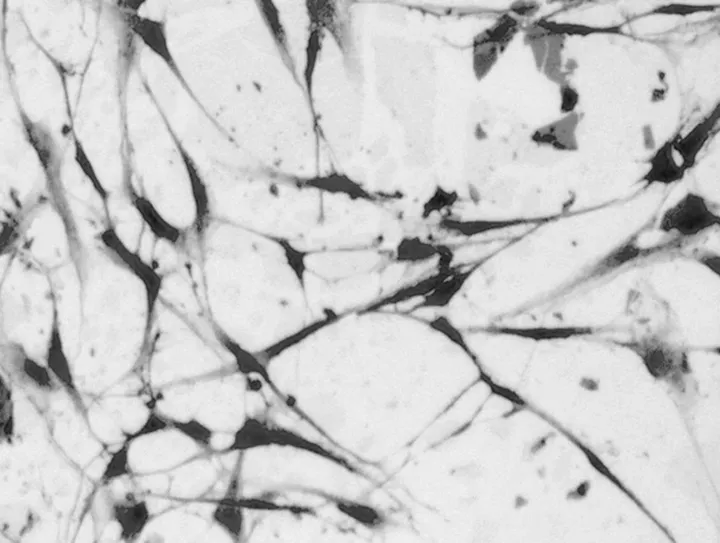
图2 间充质细胞生长情况(HE,×100)
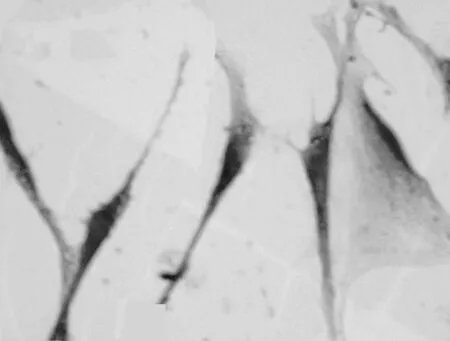
图3 间充质细胞生长情况(HE,×100)
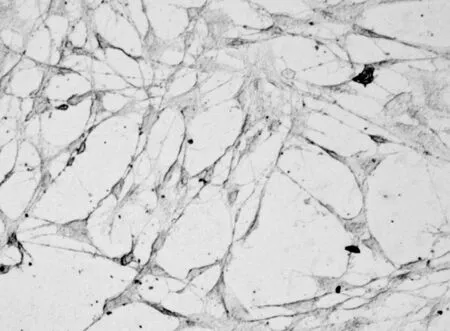
图4 细胞抗波形丝蛋白(VIM)染色 (IHC,×100)
1.4 倒置相差显微镜观察取第3代生长状态良好的外胚间充质细胞培养于含5%胎牛血清的DMEM/F12 培养液中,在培养液中加入20 ng/mL的IGF-1,连续培养10 d,用倒置相差显微镜观察细胞的生长和形态变化。
1.5 抗Ⅰ型胶原单抗免疫组化染色将IGF-1连续培养10 d的细胞制作,做HE染色,高倍镜下观察细胞爬片形态改变;将细胞爬片用SABC 法进行抗Ι型胶原单抗免疫组化染色。

2 结果
2.1 细胞形态学的变化外胚间充质细胞经IGF-1诱导培养10 d后,可见细胞呈梭片形、三角形、多边形。多边形细胞有多个矢状突起,呈立方状,排列紧密(图5)。细胞爬片HE染色,可见细胞排列紧密,似成骨细胞(图6、7)。
2.2 抗Ι型胶原单抗免疫组化染色间充质细胞经IGF-1诱导培养10 d后,抗Ι型胶原单抗免疫组化染色可见实验组细胞呈阳性着色,细胞胞浆及细胞核周围着色(图8)。而对照组未见此类改变。

图6 IGF-1培养10 d细胞生长情况(HE,×100)
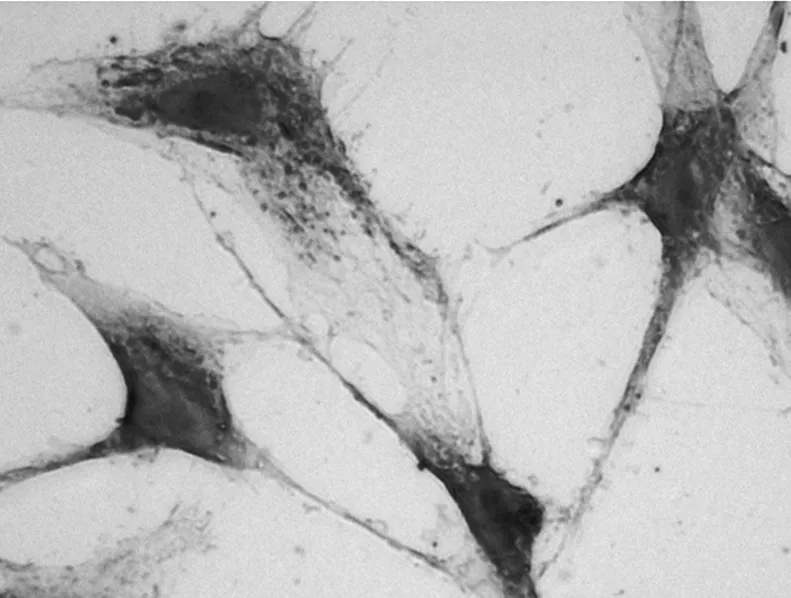
图7 IGF-1培养10 d细胞生长情况(HE,×400)
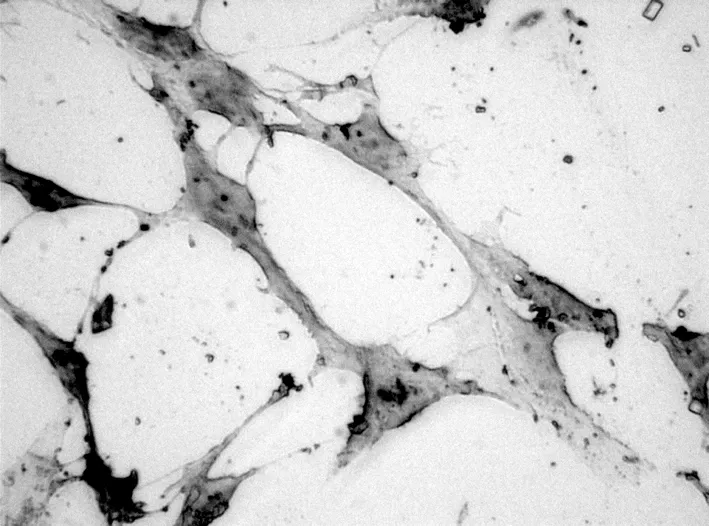
图8 IGF-1诱导10 d Ι型胶原免疫组化染色 (×400)
2.3 碱性磷酸酶活性结果加入IGF-1作用后,各实验组碱性磷酸酶(ALP)活性增高,与对照组相比有显著差异。经方差分析,培养10 d的碱性磷酸酶活性增高,与对照组相比有显著差异(P<0.01) 。见表1、2。

表1 碱性磷酸酶活性比较(A值)
A:410 nm 碱性磷酸酶光度值。

表2 碱性磷酸酶活性比较
与对照组相比,P<0.01。A:410 nm 碱性磷酸酶光度值。
3 讨论
SD胎鼠颌突外胚间充质细胞来源于颅神经嵴,是一种具有多向分化潜能的胚胎干细胞,可以分化为成牙本质细胞和成骨细胞。参与形成颌骨、牙齿等口腔颌面部重要的组织器官[3]。在发育成熟的上颌骨骨缝中含有丰富的间充质细胞,Yano等[4]的研究结果表明胚胎期的间充质细胞和发育成熟的骨缝间充质细胞在形态学和生物学特性方面没有明显差异。Chai等[5]在研究SD胎鼠胚胎发育的过程中发现,颅神经嵴可以向间充质细胞转化。Basch等[6]认为在胚胎第10.5天(E10.5)时,第1对鳃弓已经分化为上颌突和下颌突,神经嵴源性外胚间充质细胞几乎全部到达口腔上皮下。此时SD胎鼠颌突表面被覆一层上皮细胞,皮下是丰富的间充质细胞。因此,通过妊娠第10~11天的SD胎鼠取得外胚间充质细胞,该细胞核大,呈星形、卵圆形且位于中央,生长状况符合纤维样细胞。抗波形丝蛋白(VIM) 染色为阳性,说明细胞来源于外胚间充质。
IGF-1是一个有70个氨基酸的单链碱性蛋白,相对分子质量为7.5 kD。人类IGF-1基因位于12号染色体,是体内重要的细胞因子之一,在人类体内可以由许多组织合成、分泌,主要由成骨细胞产生,它是骨基质中含量最多的细胞因子之一[7]。IGF-1生理作用广泛,几乎参与体内每个器官的生长和功能,尤其具有调节成骨细胞和代谢的重要作用。本实验中外胚间充质细胞用20 ng/mL的IGF-1诱导培养5 d后,可见细胞体积迅速增大,由成纤维样变为多角形,核圆而居中,1~2个核仁,细胞体突起增多,细胞内外可见分泌颗粒或囊泡,说明细胞分泌能力旺盛。继续培养10 d,可见细胞呈多边形,趋于立方状,排列紧密,出现类成骨样改变,表明颌突外胚间充质细胞已经向成骨细胞分化。
分泌Ι型胶原是成骨细胞最具特征的生物学特性之一,与细胞的进一步分化有很大的关系[8]。它可以促进间充质细胞向成骨细胞转化,成骨细胞所合成分泌的Ι型胶原,可以极大地增加细胞的多层,形成其表面的钙盐结晶沉积,又是有机基质演变为骨组织的一个重要步骤。因此Ι型胶原也是体外培养成骨细胞的一个特征性标志物[9]。本实验中,间充质细胞经IGF-1诱导10 d后,抗Ι型胶原染色阳性。说明在IGF-1作用下外胚间充质细胞可向成骨细胞分化,进而促进颌骨发育,表明其在颌面部骨发育过程中起到重要的作用。
碱性磷酸酶(ALP)是在碱性条件下水解多种磷酸酯并具有转磷酸基作用的一组酶,也是成骨细胞的一种细胞外酶,是成骨细胞矿化过程中主要的功能活性酶[10]。ALP是成骨细胞矿化过程中主要的功能活性酶,富含于胞浆中,它可分解有机质中的磷酸,增加局部无机磷酸浓度,促进矿化[11]。ALP是成骨细胞特有的标志性酶,它的活性越高提示细胞的成骨能力就越强,ALP在细胞中表达的量和活性,可以反映出细胞的分化程度和功能状态[12]。本实验中,间充质细胞经IGF-1培养5 d,可见ALP的活性增强,培养10 d可见ALP的活性显著增强。提示细胞的分化特性已明显不同于原来的细胞。从表2可以看出培养10 d的碱性磷酸酶活性增高。与对照组相比有统计学差异(P<0.01)。在IGF-1作用下,间充质细胞向成骨细胞分化,因此认为,IGF-1可以诱导间充质细胞分化为成骨细胞。
随着分子生物学的发展和应用,从各方面对影响和调控骨缝间质变化的认识越来越深入,发现多种细胞因子能诱导上颌骨缝中未分化的间充质细胞不可逆地分化形成软骨和骨,从而导致新骨的形成,促进上颌骨的发育。研究骨缝中间充质细胞成骨能力的调控及影响因素对颅颌面生长发育、颅颌骨畸形的防治均有重要的意义。
[1]Thesleff I,Vaahtokari A,Vainio S,et al.Molecular mechanisms of cell and tissue interactions during early tooth development[J].Anatom Reco,1996,245(2):151-155.
[2]Anderson DJ.Celluar and moleucular biology of neural crest cell lineage determination[J].TIG,1997,13(7):276-280.
[3]Olsen BR,Reginato AM,Wang W.Bone development[J].Annu Rev Cell Dev Biol,2000,16:191-196.
[4]Yano H,Yoshimoto H,Ohtsuru A,et al.Characterization of cultured rat embryonic palatal ectomesenchymal cells[J].Cleft Palate Craniofac J,1996,33(5):3-8.
[5]Chai Y,Jiang X.Fate of mammalian cranial neural crest during tooth and mandibular morphogenesis[J].Development,2000,127(8):1671-1679.
[6]Basch MI,Bronner-Fraser M.Neural crest inducing signals[J].Adv Exp Med Biol,2006,589:24-31.
[7]Canalis E,Penttinen RP,Dayer JM,et al.Effect of platelet-derived growth factor on DNA and protein synthesis in cultured rat calvalriae[J].Metabolism,1981,30(10):970-975.
[8]Sun JS,Wu SY,Lin FH.The role of muscle-derived stem cells in tissue engineering[J].Biomaterials,2005,26(18):3953-3960.
[9]於丽明,王佐林.BMP2诱导骨骼肌成骨的研究进展[J].口腔颌面外科学杂志,2008,18(4):300-303.
[10]Corsi KA,pollett JB,Phillippi JA,et al.Osteogenic potential of postnatal skeletal muscle-derived stem cells is influenced by donor sex[J].J Bone Miner Res,2007,22(10):1592-1602.
[11]Usas A,Huard J.Muscle-derived stem cells for tissue engineering and regenerative therapy [J].Biomaterials,2007,28(36):5401-5406.
[12]Claros S,Alonso M,Becerra J,et al.Selection and induction of rat skeletal muscle-derived cells to the chondro-osteogenic linage[J].Cell Mol Biol,2008,54(1):1-10.
EffectofIGF-1onInducedDifferentiationofEctomesenchymalCellsofSDFetalRatMandibularProcesstoOsteoblastinVitro
SUN Li-cong,LI Song,ZHANG Yu-kun
(Luoyang Third People’s Hospital,Luoyang 471002,China)
ObjectiveTo develop a culturing model for the rat undifferentiated ectomesenchymal cells and to investigate the process of IGF-1 on inducing the ectomesenchymal cells to differentiate to osteoblasts.MethodsThe rat ectomesenchymal cells were separated by trysin.The ectomesenchymal cells of SD fetal rat mandibular were cultured in vitro,therefore the incubated models were established and cultured for 10 days in DMEM/F12 containing 20 ng/mL IGF-1.The morphology was observed by phase-contrast microscopy and HE staining.Immunohistochemistry was used to identify the characteristics of cells.Alkaline phosphatase was tested.ResultsThere were significant changes in the morphology of the cells after 10 days cultured in IGF-1.The cells change from fibroblast-like to multilateral and cuboid.Anti-collogen type I was positive.Alkaline phosphatase activity.ConclusionEctomesenchymal cells can be differentiated to osteoblasts by IGF-1.The cells change from fibroblast-like to multilateral and cuboid.The cells secrete Alkaline phosphatase and collogen type-Ι,There are the features of the osteoblast.
ectomesenchymal cell;osteoblast;IGF-1;cell differentiation;immunohistochemical
2013-01-25
1.洛阳市第三人民医院口腔科,河南洛阳 471001 2.云南省昆明医科大学口腔学院,云南昆明 650051 3.总参军训部洛阳市干休所,河南洛阳 471002
孙吏聪(1976-),男,河南巩义人,主治医师,从事口腔医学临床工作。
R783
A
1672-688X(2014)01-0003-04
