量子点-RGD探针光动力疗法联合吉西他滨治疗胰腺癌荷瘤裸鼠初探*
2014-09-08倪倩雯徐雷鸣
高 双 倪倩雯 周 敏 徐雷鸣#
上海交通大学医学院附属新华医院消化内镜诊治部1(200092) 上海市小儿消化与营养重点实验室2
光动力疗法(photodynamic therapy, PDT)是20世纪80年代发展起来的一种新型抗肿瘤治疗手段,已成为肿瘤防治领域的研究热点。目前,关于PDT在体内靶向治疗胰腺癌的研究甚少。RGD(Arg-Gly-Asp)肽广泛存在于生物体内,通过其RGD序列特异性结合细胞表面的αvβ3整合素受体,介导细胞与细胞外基质以及细胞间的黏附作用[1-2]。αvβ3整合素在成熟的内皮细胞表面低表达,在多种肿瘤细胞和活化的内皮细胞表面高表达[3]。本研究以量子点-RGD(quantum dots-RGD, QDs-RGD)探针作为光敏剂,探讨PDT联合吉西他滨对胰腺癌移植瘤祼鼠的治疗效应,以期为胰腺癌的治疗提供新途径。
材料与方法
一、细胞株、主要试剂和仪器
人胰腺癌细胞株SW1990购自中国科学院细胞库,由新华医院科研中心冻存。5~6周龄SPF级BALB/c裸鼠42只,雌雄各半,体质量17~22 g,购自上海斯莱克实验动物有限责任公司。QDs由上海大学材料科学与工程学院提供(QDs发射光谱为630 nm);RGD购自吉尔生化(上海)有限公司;RPMI 1640培养基、胎牛血清、0.25%胰蛋白酶购自美国Gibco公司;小动物活体成像系统购自美国Xenogen公司;吉西他滨购自美国Lilly公司;半导体激光器(630 nm, 100 mW)购自德国DILAS公司。
二、方法
1. QDs-RGD探针合成:氨基水溶性QDs经偶联剂sulfo-SMCC活化后,过脱盐柱提纯,与RGD偶联反应生成QDs-RGD,过脱盐柱提纯,终产物保存于50 mmol/L 硼酸盐(pH 8.4,含0.05% NaN3)缓冲液中。
2. 胰腺癌移植瘤模型制备:人胰腺癌细胞株SW1990接种于RPMI 1640培养基(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素),于37 ℃、5% CO2培养箱中培养,0.25%胰蛋白酶消化,隔2~3 d 传代。收集对数生长期SW1990细胞,重悬于PBS液中,将0.2 mL细胞悬液(约含105个细胞)接种于裸鼠右侧臀背部皮下。接种2周后以游标卡尺测量肿瘤结节的长径(a)、短径(b)、高度(c),计算肿瘤体积。肿瘤体积(V)=π/6×a×b×c。肿瘤体积达0.4~0.6 cm3判断为造模成功。
3. 小动物活体成像术:随机取2只造模成功的裸鼠,分别经尾静脉注射0.3 nmoL QDs-RGD和QDs探针,采用小动物活体成像系统观察不同时点(1、5、10、24 h)QDs-RGD、QDs在裸鼠体内的分布情况。
4. 模型分组:取40只造模成功的裸鼠,随机分为5组,每组8只:对照组(不给予任何治疗);单纯光照组(激光630 nm,120 J/cm2,持续照射20 min);PDT组(QDs-RGD 0.5 nmol+激光照射);吉西他滨组(吉西他滨50 mg/kg);联合治疗组(QDs-RGD 0.5 nmol+激光照射+吉西他滨50 mg/kg)。PDT组和联合治疗组在激光照射前5 h腹腔注射QDs-RGD 0.5 nmol。联合治疗组在激光照射前1 h和照射后第3、6、9 d腹腔注射吉西他滨,共4次;吉西他滨组的吉西他滨注射剂量、时间与联合治疗组相同。第18 d处死全部裸鼠,取出瘤体,称重并测量体积,计算抑瘤率。抑瘤率=[1-(治疗组平均瘤重/对照组平均瘤重)]×100%。
三、统计学分析
结 果
一、QDs-RGD探针表达情况
小动物活体成像示,QDs-RGD注射1 h后,随着时间的延长,肿瘤显影逐渐清晰,显影范围逐渐扩大,并接近瘤体实际大小,注射5 h后显影达高峰,随后逐渐减弱。QDs注射后5 h内可见一过性显影,且瘤体附近的聚集浓度明显低于QDs-RGD,注射10 h后肿瘤部位已无显影(图1)。
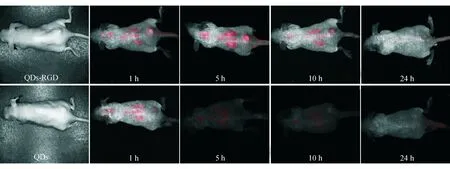
图1 不同时点QDs-RGD、QDs探针在荷瘤祼鼠体内的聚集情况
二、各组瘤重、瘤体积和抑瘤率
PDT组、吉西他滨组和联合治疗组的瘤重、瘤体积均显著低于对照组和单纯光照组(P<0.01),其中联合治疗组又显著低于PDT组和吉西他滨组(P<0.05);对照组与单纯光照组间、PDT组与吉西他滨组间瘤重、瘤体积差异均无统计学意义(P>0.05)。联合治疗组、吉西他滨组、PDT组的抑瘤率分别为70.5%、43.5%、37.1%(表1)。

表1 各组瘤重、瘤体积和抑瘤率比较
讨 论
胰腺癌是一种死亡率较高的恶性肿瘤,其发病隐匿,进展迅速,大多数患者明确诊断时已处于晚期,手术切除率仅10%~15%,根治术后行辅助治疗患者的存活期仅11~23个月,5年生存率仅约20%[4-6]。因此,探讨安全、有效的治疗手段成为胰腺癌研究的重点课题。
PDT是一种发展迅速的新型抗肿瘤方法,具有选择性好、毒性小、起效快、可重复以及与其他传统疗法有协同作用等优点。PDT的主要原理是使光敏剂选择性聚集于肿瘤组织内,在特定波长的光照下通过光化学或生物学反应对肿瘤组织产生杀伤效应[7]。然而,光敏剂在组织、器官中的非特异性摄取和分布使PDT的应用具有一定局限性。因此,光敏剂的选择是PDT治疗效应的决定性因素。
近年来,随着纳米技术的发展,QDs在肿瘤研究中的应用越来越受到国内外学者的关注。 QDs是由Ⅱ-Ⅳ族元素(如Cdse、Cds)或Ⅲ-Ⅴ族元素(如InP、InAs)组成的直径<100 nm的半导体纳米微晶体。用于荧光标记的QDs直径一般<10 nm,激发可发射荧光[8]。与传统有机荧光染料相比,QDs作为生物荧光探针具有生物相容性好、稳定性强、荧光强度高、颜色可控、激发光谱宽、发射光谱窄等优点。基于QDs的诸多特定光学特性可满足光敏剂所需的条件,本研究采用QDs作为光敏剂探讨PDT对胰腺癌的治疗效应。
目前,QDs探针技术已能有效检测肿瘤血管发生和肿瘤生长情况,在肿瘤定位、远处转移灶的定位以及个体化治疗中起重要作用。为进一步增加QDs在体内定位的特异性,将特异性靶向肽段与QDs整合的技术已逐渐得到应用。Akerman等[9]的研究发现,将肺血管内皮细胞、肿瘤血管、肿瘤淋巴管的特异性靶向肽段包被于QDs,注射入小鼠移植瘤模型,可精确地靶向结合于相应组织器官。Cai等[3,10]的研究显示,QDs与靶向αvβ3整合素的肽段RGD偶联后,能有效地将QDs靶向运输至肿瘤组织内。基于上述理论和实验基础,本研究组在前期研究[11]中已成功将QDs与RGD偶联,并在体外实验中证实QDs-RGD在PDT作用下能有效抑制胰腺癌细胞增殖,促进其凋亡。本研究进一步将QDs-RGD探针注射入胰腺癌移植瘤裸鼠模型体内,成功实现了瘤体的活体成像,发现QDs-RGD探针的聚集特异性和聚集时间明显优于单纯QDs探针。由此可见,RGD偶联可使QDs更具有靶向性,能将之精确输送至肿瘤组织内,从而提高PDT的有效性。
吉西他滨是治疗晚期胰腺癌的首选化疗药物。研究[12-13]显示,PDT在体外不仅能促进胰腺癌细胞凋亡,还能减少胰腺癌细胞对吉西他滨的耐药性。Xie等[14]以photosan作为PDT光敏剂联合吉西他滨治疗胰腺癌,结果显示联合用药的疗效较单一用药显著且起效快、维持时间长,能减少肿瘤复发。本研究采用QDs-RGD探针作为光敏剂,探讨PDT联合吉西他滨对裸鼠胰腺癌移植瘤的生长抑制作用,结果发现PDT组、吉西他滨组和联合治疗组的瘤重、瘤体积均显著低于对照组和单纯光照组,其中联合治疗组又显著低于PDT组和吉西他滨组,且联合治疗组的抑瘤率高于PDT组和吉西他滨组,提示以QDs-RGD为光敏剂的PDT联合吉西他滨可显著提高抑瘤效果。
关于PDT抑制胰腺肿瘤细胞的具体机制,本研究组在前期研究[15]中已初步进行探讨,研究以PDT体外作用于胰腺癌细胞,发现肿瘤细胞髓样细胞白血病-1(myeloid cell leukemia-1, Mcl-1)表达减少,肿瘤坏死因子相关凋亡诱导配体(TRAIL)表达增多,该两种基因与细胞凋亡密切相关。经PDT治疗的胰腺癌细胞产生大量活性氧(ROS),而后者是线粒体损伤和凋亡的激活剂,加之胰腺癌细胞清除氧自由基的能力降低,故ROS对肿瘤细胞可产生抑制作用。此外,PDT还能显著改变胰腺癌细胞的氧化还原状态,增强其氧化应激水平[16]。然而,吉西他滨与PDT协同抗肿瘤的作用机制尚未明确,有待后续进一步研究探讨。
综上所述,本研究采用QDs-RGD探针作为光敏剂,在PDT治疗的基础上联合吉西他滨化疗,发现该联合疗法对祼鼠体内胰腺癌移植瘤的生长有明显抑制作用,为临床治疗胰腺癌提供了一条新思路。然而,相关作用机制仍未明确,有待后续研究进行深入探讨和验证。
1 Desgrosellier JS, Cheresh DA. Integrins in cancer: biological implications and therapeutic opportunities[J]. Nat Rev Cancer, 2010, 10 (1): 9-22.
2 Liu S. Radiolabeled multimeric cyclic RGD peptides as integrin alphavbeta3 targeted radiotracers for tumor imaging[J]. Mol Pharm, 2006, 3 (5): 472-487.
3 Cai W, Shin DW, Chen K, et al. Peptide-labeled near-infrared quantum dots for imaging tumor vasculature in living subjects[J]. Nano Lett, 2006, 6 (4): 669-676.
4 Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60 (5): 277-300.
5 Heinemann V. Present and future treatment of pancreatic cancer[J]. Semin Oncol, 2002, 29 (3 Suppl 9): 23-31.
6 Chua YJ, Cunningham D. Adjuvant treatment for resectable pancreatic cancer[J]. J Clin Oncol, 2005, 23 (20): 4532-4537.
7 李践. 光动力学疗法治疗癌症[J]. 中国生物医学工程学报, 2005, 24 (2): 237-239.
8 Jain KK. Nanodiagnostics: application of nanotechnology in molecular diagnostics[J]. Expert Rev Mol Diagn, 2003, 3 (2): 153-161.
9 Akerman ME, Chan WC, Laakkonen P, et al. Nanocrystal targetinginvivo[J]. Proc Natl Acad Sci U S A, 2002, 99 (20): 12617-12621.
10 Cai W, Chen X. Preparation of peptide-conjugated quantum dots for tumor vasculature-targeted imaging[J]. Nat Protoc, 2008, 3 (1): 89-96.
11 Zhou M, Ni QW, Yang SY, et al. Effects of integrin-targeted photodynamic therapy on pancreatic carcinoma cell[J]. World J Gastroenterol, 2013, 19 (39): 6559-6567.
12 Yu Z, Huang KH, Zhong W, et al.Invitrolethal effect of photodynamic therapy on human pancreatic cancer cells and its major influencing factors[J]. Clin Oncol Cancer Res, 2011, 8 (3): 155-162.
13 Celli JP, Solban N, Liang A, et al. Verteporfin-based photodynamic therapy overcomes gemcitabine insensitivity in a panel of pancreatic cancer cell lines[J]. Lasers Surg Med, 2011, 43 (7): 565-574.
14 Xie Q, Jia L, Liu YH, et al. Synergetic anticancer effect of combined gemcitabine and photodynamic therapy on pancreatic cancerinvivo[J]. World J Gastroenterol, 2009, 15 (6): 737-741.
15 Wang L, Yang W, Read P, et al. Tumor cell apoptosis induced by nanoparticle conjugate in combination with radiation therapy[J]. Nanotechnology, 2010, 21 (47): 475103.
16 Luo G, Long J, Zhang B, et al. Quantum dots in cancer therapy[J]. Expert Opin Drug Deliv, 2012, 9 (1): 47-58.
