活性氧在芬维A胺诱导人肝癌细胞凋亡中的 作用及其机制研究*
2014-09-08吴小琴魏宜胜李爱群丁元伟林漫鹏
吴小琴 杨 辉 魏宜胜 李爱群 钟 赟 苏 杭 丁元伟 林漫鹏
广州医科大学附属第二医院消化科1(510260) 胃肠外科2 分子中心4 广州心血管疾病研究所3
肝细胞癌(hepatocellular carcinoma, HCC)是一种严重威胁人类生命的恶性肿瘤,大部分患者发现时已失去手术时机,因此寻找和研发新的抗HCC药物具有重要临床意义。芬维A胺(fenretinide)是人工合成的全反式维甲酸衍生物,可提高细胞内活性氧(reactive oxygen species, ROS)水平,其抗肿瘤活性已在众多体内外实验和临床化学预防试验中得到验证,抗肿瘤作用的发挥可能与诱导肿瘤细胞凋亡有关,ROS为参与介导该凋亡诱导过程的信号之一[1]。本课题组前期研究[2-5]发现芬维A胺能体外诱导某些人HCC细胞凋亡,其机制可能涉及维甲酸受体β(retinoic acid receptor beta, RARβ)激活、ERK1/2失活、核受体Nur77的出核和胞质聚集等,但确切机制不明。本研究以对芬维A胺敏感的人HCC细胞株Huh-7为研究对象,通过观察能清除ROS的抗氧化剂维生素E对芬维A胺效应的影响,对ROS在芬维A胺诱导人HCC细胞凋亡中的作用及其可能机制作一探讨。
材料与方法
一、细胞株和主要试剂
人HCC细胞株Huh-7(中国科学院细胞库)。芬维A胺( Sigma-Aldrich Co. LLC.)溶于DMSO原液并稀释成10 mmol/L的储存液,-20 ℃避光保存备 用。胎牛血清、DMEM培养基(Gibco®Cell Culture, Thermo Fisher Scientific Inc.),Image-iTTMLIVE Green ROS检测试剂盒(InvitrogenTM, Thermo Fisher Scientific Inc.),CellTiter-Glo®发光法细胞活力 检测试剂盒、Caspase-Glo®3/7检测试剂盒(Promega Corporation),山羊血清(Abcam plc.),Nur77兔多克隆抗体、GADD153兔多克隆抗体、GAPDH山羊多克隆抗体(Santa Cruz Biotechnol-ogy, Inc.)。
二、实验方法
1. 细胞培养和处理:Huh-7细胞培养使用含10%胎牛血清以及青霉素G 100 U/mL和链霉素100 μg/mL的DMEM培养基,置于37 ℃、5% CO2培养箱中培养,每2~3 d传代一次。实验设维生素E处理组、芬维A胺处理组、维生素E+芬维A胺处理组和对照组。细胞处理时更换为无血清培养基,分别予维生素E(200 μmol/L)预处理2 h、芬维A胺(10 μmol/L)处理24 h或两者联合,对照组加入等体积DMSO(终浓度0.1%)。
2. 活细胞ROS检测:细胞按组别予相应处理后,细胞内ROS以活细胞ROS荧光标记物羧基-H2DCFDA染色,胞核以核酸染料Hoechst 33342染色,HBSS冲洗3 min,Zeiss LSM 710共聚焦显微镜观察。进一步以流式细胞术定量检测ROS,按试剂盒说明书进行操作,以附CXP软件的Beckman CytomicsTMFC 500 MPL流式细胞仪进行检测、分析。
3. 细胞活力和凋亡检测:细胞以1.5×104/孔接种于96孔板过夜,按组别予相应处理后室温平衡30 min,每孔加入100 μL CellTiter-Glo®试剂或等体积(1∶1)Caspase-Glo®3/7试剂,震荡混匀,室温孵育20~60 min,Promega ModulusTM微孔板光度计(P/N 9300-001)检测。
4. Nur77表达和分布检测:细胞按组别予相应处理后,以新鲜配制的多聚甲醛溶液室温固定15 min,含0.2% Triton X-100的PBS冲洗,置于含0.2% Triton X-100和5%山羊血清的PBS中室温培养30 min,加入Nur77特异性抗体(1∶100)37 ℃ 孵育1 h,含0.2% Triton X-100和1%山羊血清的PBS冲洗,加入FITC标记的二抗(1∶400)4 ℃ 过夜,PBS冲洗,含DAPI封固剂封固,共聚焦显微镜观察。
5. GADD153蛋白表达检测:细胞按组别予相应处理后,以含蛋白酶和磷酸酶抑制剂的NP-40裂解液裂解细胞,取50 μg总蛋白行SDS-PAGE凝胶电泳并转至PVDF膜,膜置于含0.1% Tween 20和5%脱脂奶粉的PBS中室温孵育1 h以阻止非特异性结合,加入一抗(GADD153 1∶1 000,GAPDH 1∶1 000),于含5% PBST的牛奶中4 ℃过夜,1×TBST冲洗3次,将膜置于HRP标记的二抗工作液中室温孵育1 h,ECL发光试剂显影,定影,SIM 凝胶成像分析系统BIO-PRO 200E观察。
三、统计学分析
结 果
一、维生素E阻断芬维A胺诱导的ROS产生
共聚焦显微镜观察显示,芬维A胺处理能显著诱导ROS产生,而维生素E预处理能显著降低芬维A胺诱导的ROS产生(见图1A);进一步的流式细胞术定量检测证实了芬维A胺诱导ROS产生和维生素E对芬维A胺效应的消除作用(见图1B)。上述结果表明维生素E预处理能充分阻断芬维A胺诱导的ROS产生。
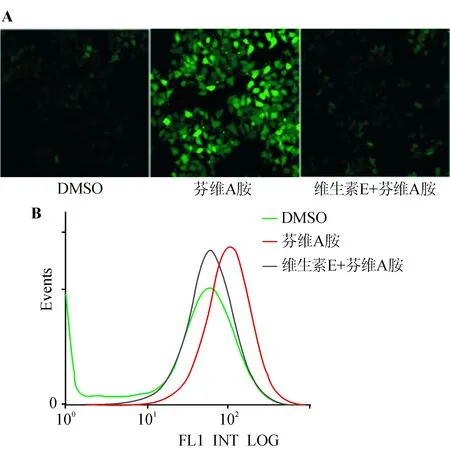
A:共聚焦显微镜观察,绿色荧光部分为ROS;B:流式细胞术定量检测(纵坐标为细胞相对数,横坐标为荧光强度,数据为3次独立实验结果)
图1维生素E预处理对芬维A胺诱导ROS产生的影响
二、维生素E降低芬维A胺的促人HCC细胞凋亡效应
以活细胞内ATP定量为基础的细胞活力检测显示,与对照组相比,单纯维生素E处理对Huh-7细胞生长无明显影响,单纯芬维A胺处理则能显著抑制Huh-7细胞生长(P<0.01);维生素E预处理能显著降低芬维A胺对Huh-7细胞生长的抑制作用(P<0.05),但与对照组相比差异仍有统计学意义(P<0.05)(见图2A)。细胞凋亡检测与细胞活力检测结果一致,与对照组相比,单纯维生素E处理对Huh-7细胞的凋亡蛋白Caspase 3/7活性无明显影响,单纯芬维A胺处理则能显著提高Caspase 3/7活性(约为对照组的4~5倍,P<0.01);维生素E预处理能显著降低芬维A胺对Caspase 3/7活性的影响(P<0.05),但仍约为对照组的3倍(P<0.05)(见图2B)。上述结果证实芬维A胺能诱导人HCC细胞凋亡,而维生素E预处理能有效降低芬维A胺的促凋亡效应。结合维生素E能阻断芬维A胺诱导产生ROS,推测芬维A胺的促凋亡效应至少部分是由ROS所介导。
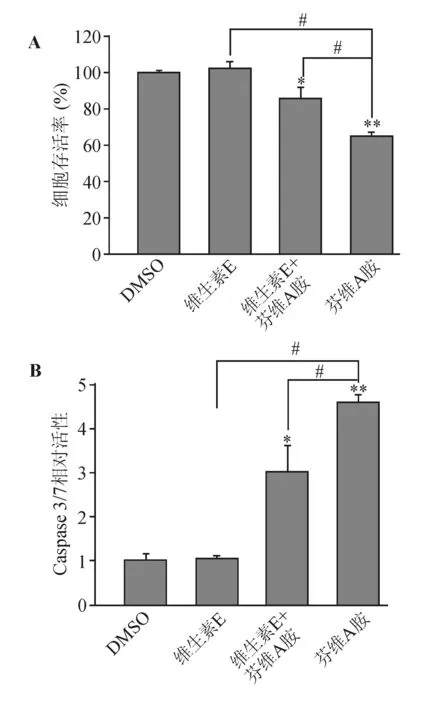
与对照组比较,*P<0.05,**P<0.01;#两组间比较,P<0.05(数据为3次独立实验结果均值)
A:细胞活力检测结果;B:Caspase 3/7活性检测结果
图2维生素E预处理对芬维A胺促人HCC细胞凋亡的影响
三、维生素E降低芬维A胺诱导的GADD153表达
为进一步研究芬维A胺-ROS诱导人HCC细胞凋亡的可能机制,研究检测了维生素E对芬维A胺诱导Nur77、GADD153表达的影响。共聚焦显微镜观察显示,维生素E预处理对芬维A胺诱导的Nur77表达和出核无明显影响(见图3);蛋白质印迹
法检测显示,芬维A胺处理能显著诱导GADD153表达,而维生素E预处理能显著降低芬维A胺诱导的GADD153表达(见图4)。上述结果表明芬维A胺-ROS诱导人HCC细胞凋亡的机制可能与促进GADD153表达有关。

图4维生素E预处理对芬维A胺诱导GADD153表达的影响(蛋白质印迹法)
讨 论
芬维A胺是一种全反式维甲酸衍生物,可作用于肿瘤细胞,通过增加内质网压力、提高细胞内ROS水平而启动一系列信号通路,抑制肿瘤细胞生长、增殖并诱导细胞凋亡。前期研究发现芬维A胺在体外能诱导Huh-7、Hep3B等人HCC细胞凋亡[2-5],其促凋亡途径包括诱导ROS产生、激活RAR以及其他未知途径[1],但芬维A胺抗肿瘤作用的具体机制仍未完全阐明。
ROS是氧的不完全单电子还原形成的分子或离子,对维持体内氧化与抗氧化平衡具有重要意义。在某些因素的作用下,ROS产生增多,引起氧化与抗氧化失衡,导致细胞凋亡[6]。因此,ROS在细胞凋亡的启动和调节中扮演重要角色。其可增加脂质过氧化和线粒体膜通透性,引起促凋亡因子释放,激活凋亡蛋白Caspase-3,诱导细胞凋亡[4]。在不同肿瘤细胞中,芬维A胺可能通过不同途径诱导 线粒体产生ROS,经线粒体途径诱导细胞凋亡[1,7-9]。
本研究观察了抗氧化剂维生素E对芬维A胺在人HCC细胞Huh-7中诱导产生ROS及其促凋亡效应的影响,发现维生素E预处理能充分阻断芬维A胺诱导的ROS产生,并有效降低其促凋亡效应,提示芬维A胺诱导产生的ROS在人HCC细胞凋亡中起一定作用。
Nur77是孤儿核受体超家族的重要成员,可由多种生长因子或凋亡诱导剂诱导表达,进而影响细胞增殖、分化、发育和凋亡。前期研究[3]显示芬维A胺可诱导Nur77表达和出核,此过程在芬维A胺诱导Huh-7细胞凋亡中起重要作用,Nur77的胞内定位决定了人HCC细胞对芬维A胺诱导的细胞凋亡的敏感性。为进一步分析芬维A胺-ROS诱导人HCC细胞凋亡的可能机制,本研究采用免疫荧光染色和共聚焦显微镜观察了维生素E对芬维A胺诱导Nur77表达的影响,结果显示维生素E预处理对芬维A胺诱导的Nur77表达和出核无明显影响,表明芬维A胺-ROS的诱导凋亡作用与Nur77无关。
GADD153(又名CHOP)为一应激诱导转录因子,属于CCAAT/增强子结合蛋白(C/EBP)家族成员,能以不依赖于p53的方式诱导细胞凋亡[10]。研究[11-12]显示GADD153参与了芬维A胺诱导的成神经细胞瘤细胞凋亡。经芬维A胺处理的肿瘤细胞,GADD153 mRNA和蛋白表达均上调;不论有无芬维A胺存在,过表达GADD153均能促进细胞凋亡,抑制GADD153表达则可消除芬维A胺的促凋亡效应;芬维A胺诱导的GADD153表达不能被RARβ、RARγ拮抗剂阻断,但可被抗氧化剂阻断;过表达GADD153可增加肿瘤细胞对芬维A胺的敏感性。上述结果提示芬维A胺可通过RAR依赖性和非依赖性途径诱导细胞凋亡,其中RAR非依赖性途径可能以ROS诱导GADD153表达为特征。本研究亦发现芬维A胺处理能显著诱导GADD153表达,而抗氧化剂维生素E预处理能显著降低芬维A胺诱导的GADD153表达,提示芬维A胺诱导GADD153表达与ROS有关。
综上所述,本研究从体外细胞学角度发现维生素E可通过清除芬维A胺诱导产生的ROS抑制其促Huh-7细胞凋亡的效应,提示ROS参与了芬维A胺诱导的人HCC细胞凋亡,其机制可能与诱导GADD153蛋白表达有关,上述发现为进一步探讨芬维A胺对HCC的治疗机制提供了新的线索。芬维A胺诱导Huh-7细胞产生ROS的机制以及芬维A胺-ROS-GADD153途径诱导人HCC细胞凋亡的下游通路尚不清楚,有待进一步研究。
1 Hail N Jr, Kim HJ, Lotan R. Mechanisms of fenretinide-induced apoptosis[J]. Apoptosis, 2006, 11 (10): 1677-1694.
2 Bu P, Wan YJ. Fenretinide-induced apoptosis of Huh-7 hepatocellular carcinoma is retinoic acid receptor beta dependent[J]. BMC Cancer, 2007, 7: 236.
3 Yang H, Bushue N, Bu P, et al. Induction and intra-cellular localization of Nur77 dictate fenretinide-induced apoptosis of human liver cancer cells[J]. Biochem Pharmacol, 2010, 79 (7): 948-954.
4 Yang H, Nie Y, Li Y, et al. ERK1/2 deactivation enhances cytoplasmic Nur77 expression level and improves the apoptotic effect of fenretinide in human liver cancer cells[J]. Biochem Pharmacol, 2011, 81 (7): 910-916.
5 Yang H, Zhan Q, Wan YJ. Enrichment of Nur77 mediated by retinoic acid receptor β leads to apoptosis of human hepatocellular carcinoma cells induced by fenretinide and histone deacetylase inhibitors[J]. Hepatology, 2011, 53 (3): 865-874.
6 Hail N Jr, Carter BZ, Konopleva M, et al. Apoptosis effector mechanisms: a requiem performed in different keys[J]. Apoptosis, 2006, 11 (6): 889-904.
7 Hail N Jr, Chen P, Kepa JJ. Selective apoptosis induction by the cancer chemopreventive agent N-(4-hydroxyphenyl)retinamide is achieved by modulating mitochondrial bioenergetics in premalignant and malignant human prostate epithelial cells[J]. Apoptosis, 2009, 14 (7): 849-863.
8 Asumendi A, Morales MC, Alvarez A, et al. Implication of mitochondria-derived ROS and cardiolipin peroxidation in N-(4-hydroxyphenyl)retinamide-induced apoptosis[J]. Br J Cancer, 2002, 86 (12): 1951-1956.
9 Cuperus R, Leen R, Tytgat GA, et al. Fenretinide induces mitochondrial ROS and inhibits the mitochondrial respiratory chain in neuroblastoma[J]. Cell Mol Life Sci, 2010, 67 (5): 807-816.
10 Matsumoto M, Minami M, Takeda K, et al. Ectopic expression of CHOP (GADD153) induces apoptosis in M1 myeloblastic leukemia cells[J]. FEBS Lett, 1996, 395 (2-3): 143-147.
11 Lovat PE, Oliverio S, Ranalli M, et al. GADD153 and 12-lipoxygenase mediate fenretinide-induced apoptosis of neuroblastoma[J]. Cancer Res, 2002, 62 (18): 5158-5167.
12 Lovat PE, Oliverio S, Corazzari M, et al. Induction of GADD153 and Bak: novel molecular targets of fenretinide-induced apoptosis of neuroblastoma[J]. Cancer Lett, 2003, 197 (1-2): 157-163.
