EMS诱变番茄自交系TTD302A的突变表型鉴定和分析
2014-09-08杨建华常培培李云洲
杨建华 崔 霞 常培培 李 翠 李云洲 梁 燕
(西北农林科技大学园艺学院,陕西杨凌 712100)
EMS诱变番茄自交系TTD302A的突变表型鉴定和分析
杨建华 崔 霞 常培培 李 翠 李云洲 梁 燕*
(西北农林科技大学园艺学院,陕西杨凌 712100)
为创制用于番茄遗传育种和基因功能研究的新种质,用0.7%的甲基磺酸乙酯(EMS)浸泡处理TTD302A种子 8 h,清水冲洗后催芽育苗,定植于塑料大棚中,单株观察、单株留种。对M2群体进行株系和单株的系统观察,表型表现一致的株系混合留种,有表型变异的单株进行单株留种,获得M3种子。另外选取了15份出现典型变异性状的M2材料进行SSR检测。通过对M2群体表型性状的观察,共发现373个变异性状,297个变异单株,总的单株变异频率为7.1%。叶、花、果实和植株的表型变异频率依次为1.5%、2.8%、1.3%和2.4%。SSR分析结果表明9份材料在 DNA 水平上有变异。
甲基磺酸乙酯(EMS);番茄;自交系;突变体
植物遗传资源是作物新品种选育的重要物质基础(孙传清 等,2001),尤其是亲本资源,在杂交育种过程中比普通种质发挥着更重要的作用。因此,运用理化手段创制番茄新种质,开展种质创新途径的基础工作很有必要。甲基磺酸乙酯(EMS)是作物诱变育种中应用最广泛、效果最好的一种化学诱变剂(李卫华 等,2011),与其他诱变剂相比,EMS诱变产生点突变的频率较高,染色体畸变相对较少,且多为显性突变体,易于筛选(安学丽 等,2003)。
目前,国内外研究者已在拟南芥(Yong et al.,2005;Chiu et al.,2007)、玉米(Till et al.,2004)、大豆(Cooper et al.,2008)、芜菁(Stephenson et al.,2010)等植物中利用EMS诱变技术构建了突变体库。在番茄 (Solanum lycopersicumL.)上,Menda等(2004)利用EMS(0.5%)和快速中子诱变加工番茄品种M82种子得到3 417个突变体,Minoia等(2010)利用两种不同浓度的EMS(0.7%、1%)处理加工番茄品种Red Setter种子构建突变体库,经TILLING技术检测,结果表明0.7%的EMS处理和1%的EMS处理的突变体库的突变密度分别是 1/574 kb 和 1/322 kb。Saito等(2011)利用不同浓度梯度的EMS(0.3%、0.5%、0.7%、1.0%、1.5%)和γ-射线处理Micro-Tom,筛选到1 048个突变单株。目前国内关于EMS诱变番茄种子,构建突变群体作为新种质的研究还未见报道,同时,国外选用的番茄材料基本是红果中果型加工品种(M82),或红果小果型加工品种(Red Setter),或观赏型Micro-Tom。本试验选择配合力高、综合性状好的鲜食粉果大果型番茄自交系TTD302A为材料进行EMS诱变,旨在丰富现有粉果大果型番茄遗传变异类型,创制遗传新种质,为我国番茄育种和基因功能研究提供基础材料。
1 材料与方法
1.1 试验材料
番茄自交系 TTD302A,由西北农林科技大学园艺学院番茄课题组提供。该品系为普通番茄,有限生长型,果实粉色,大小均匀,单果质量为250 g,配合力高,综合性状良好。
1.2 试验方法
1.2.1 种子诱变处理 2012年3月,挑选2 200粒当年采收的TTD302A的饱满种子,室温浸种10 h,滤纸吸干水后浸泡于0.7%的EMS-磷酸缓冲液(pH 7.0)中(崔霞 等,2013),4℃ 静置 2 h,37℃ 130 r·min-1振荡处理 6 h,用流动的自来水冲洗 6 h 后,转至铺有湿润双层滤纸的培养皿中,置于人工培养箱28℃催芽。以磷酸缓冲液处理100粒种子作为对照。
1.2.2 突变群体构建 催芽3 d后将发芽种子播于穴盘育苗,4月中旬,定植于西北农林科技大学南校区新天地塑料大棚内,M1单株留种。2013年1月,每个M2株系选取20粒种子进行浸种催芽,穴盘育苗,3月下旬定植于杨凌农业创新园日光温室内,分别对每个株系和株系内每个单株进行系统观察和性状记载。对表现一致的株系混合留种,对有变异的单株进行单株留种(图1)。
1.2.3 DNA提取 DNA提取方法参照孙亚东(2012)的改良CTAB法。
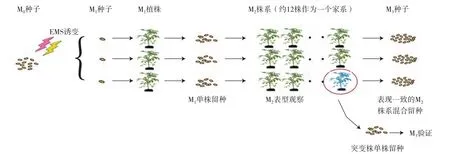
图1 EMS诱变番茄种子构建突变群体流程

表1 用于SSR标记的引物名称
1.2.4 SSR-PCR检测 用于番茄SSR标记的11对引物(表1)参照孙亚东(2012)的文献。PCR反应体系为 20 μL:10μL Mix,正反向 SSR 引物各 1 μL(10 ng·μL-1),2 μL DNA 模板(50 ng·μL-1), 补充ddH2O至20 μL。反应条件:94℃预变性2 min,94℃变性 1 min;50~60℃(根据引物退火温度而定)退火 1 min,72 ℃ 延伸 2 min,共 40 个循环;4℃ 保存。扩增产物用6%变性聚丙烯酰胺凝胶进行电泳检测。
2 结果与分析
2.1 M1群体的表型变异
经0.7%的EMS处理8 h的2 200粒M1种子发芽931粒,出苗656株,成活633株,发芽率、出苗率和成活率分别为42.3%、29.8%和28.8%。通过田间观察,在M1群体中发现182个在茎叶、花器官和果实等部位发生明显变异的单株,最后获得358个M2株系的种子,可育率为56.6%(有种子的植株数/成活的植株总数)。
2.2 M2群体的表型变异
通过对M2群体的358个株系共4 191个单株的系统观察,发现373个在叶形态、叶色、花色、花形态、果形、果大小、株型和育性等方面的变异性状,参照Menda等(2004)、李锡香和杜永臣(2008)对变异性状进行分类(表2)。这373个变异性状出现在297个变异单株上,总的单株变异频率为7.1%(表型变异植株数/群体植株总数),其中在叶、花、果实和植株发生的变异性状数分别为66、126、81和100,依次占总变异性状数的17.69%、33.78%、21.72% 和26.81%。有50个单株同时出现两个或两个以上变异性状(图 2)。
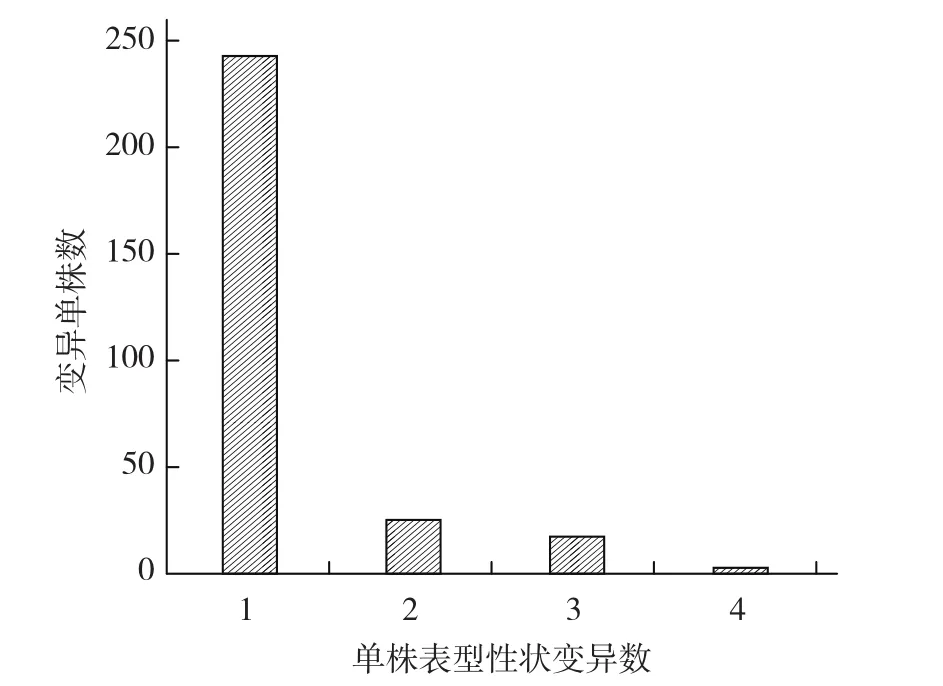
图2 突变单株上的突变性状数分布

表2 EMS诱变TTD302A M2群体突变表型分类
2.2.1 M2群体叶片表型变异 M2群体有63个单株出现叶片表型变异,变异频率为1.5%(突变单株/总单株数)。对照的叶片表现为绿色,二回羽状复叶,叶片平展,裂刻中等(图3-a)。M2群体叶片变异主要发生在叶片颜色和叶片形态上,颜色变异有黄色叶(图3-b)、黄绿色叶、颜色嵌合叶、浅绿色叶(图3-e)、深绿色叶(图3-f)。黄绿色叶变异有两种表现形式,即新生叶黄绿,老叶绿色(图3-c-1)和老叶黄绿,新生叶绿色(图3-c-2)。颜色嵌合叶变异表现两种类型,即白绿嵌合(图3-d-1)和白黄绿嵌合(图3-d-2)。在黄色叶、黄绿色叶和颜色嵌合叶中,除了白绿色嵌合突变株在整个生育期一直稳定表现外,其余的只出现在苗期,变异色会随着生育期的推进逐渐恢复为正常叶色(绿色)。
形态变异有卷叶、细长叶、宽叶、多小叶、少小叶及萎蔫叶。卷叶变异表现叶边缘朝叶面内卷,叶脉弯曲(图3-g)。细长叶变异表现为叶片及小叶变窄变细,裂刻深,个别单株的叶脉延伸出叶尖,长出长须(图3-h)。宽叶变异是由于叶片从普通叶型突变成薯叶型(图3-i)。多小叶变异表现小叶多,比对照正常植株多出30个小叶,整片叶变大(图3-j),无小叶变异表现小叶少,叶边缘平滑,裂刻浅,整片叶变小(图3-k)。萎蔫叶表现呈失水萎蔫状,叶片小且绿(图3-l)。

图3 叶片突变体
2.2.2 M2群体花器官表型变异 M2群体在花器官上发生变异的单株有117个,变异频率为2.8%。花器官变异主要表现在花冠、花柱、花萼和花序等几个方面。对照的花冠有6个花瓣,底部相互粘连,尖部向后弯曲,颜色为黄色。M2群体中花冠主要在颜色和形态上发生变异,颜色变异有浅黄色(图4-a)、橘黄色(图4-b)和白化(图4-c)。花冠白化仅表现在花瓣边缘,后期开的花不表现白化。形态变异有花冠变大(图4-d)、花冠变小(图4-e)、花瓣细长、花瓣卷曲和花瓣畸形。花瓣细长主要表现花瓣之间分离,且变窄变细(图4-f)。花瓣卷曲表现为花瓣向后卷曲将花萼包裹(图4-g)。花瓣畸形表现为花瓣破裂,不完整(图4-h)。
对照的花柱表现为雄蕊包裹柱头,柱头与雄蕊近等长,单圆花柱,颜色为绿色。M2群体中花柱出现的变异有黄柱头(图4-i)、多子房、雄蕊开裂、柱头分裂、长柱头和短柱头等。柱头表现黄色的植株果实转色前颜色均为绿白,同时部分植株叶片颜色为浅绿。多子房的突变体表现为在中央大子房的外围着生一圈小子房,5~6个(图4-j)。雄蕊开裂突变伴随柱头外露(图4-k),不利于受精,最终部分突变体表现不育。柱头分裂出现两个或两个以上柱头(图4-l)。长柱头和短柱头突变表现为柱头长于或短于雄蕊3~4 mm(图4-m,n)。
对照的花萼稍短于花瓣,花萼与花瓣相互分离。M2群体花萼突变有长花萼(图4-o)、短花萼(图4-p)、花萼退化。花萼退化有两种表现形式,一种为花萼与花瓣粘连(图4-q-1),另一种是花萼直接退化消失(图4-q-2)。

图4 花器官突变体
2.2.3 M2群体果实表型变异 M2群体果实变异单株55个,变异频率为1.3%。对照果实转色前为绿色,成熟后果色为粉色,圆形,无果面棱沟,单果质量为 250 g(图 5-a、e)。M2群体果实在转色前的变异有转色前出现绿白(图5-b)、深绿(图5-c)、果面绿条纹(图5-d-1),转色前绿白和深绿的果实成熟后表现正常果色粉色,果面绿条纹在果实成熟后转变成橙黄色条纹,且条纹面积减少(图5-d-2)。成熟果的变异有大果(图5-f)、小果、果顶开裂、高圆(图5-i)等。最大果单果质量为372 g,小果单果质量都在100 g以下,最小果单果质量仅为39 g,小果同时表现为果面棱深,果实扁圆(图5-g),一般难收获到种子。果顶开裂(图5-h),一般开裂得较规则,裂成2~4瓣,成熟后裂口处果肉变软易附生霉菌。
2.2.4 M2群体植株表型变异 M2群体植株变异单株共100个,变异频率为2.4%。植株变异主要表现在育性和植株形态两方面。育性变异有植株不开花(图6-a)和雄性不育(图6-b)两种表现形式,不开花植株同时表现植株叶片卷曲。株型变异有有限变无限 (图6-c)、植株矮小、叶腋分化能力强、多毛体、无头苗、多头苗等。植株矮小表现为叶小,花小,节间短(图6-d)。叶腋分化能力强表现为叶腋处长出巨芽(这种变异现象和番茄的巨芽病很相似,侧芽很大)(图6-e)和花序(图6-f),部分花可结果(图6-g)。多毛突变体表现为茎叶茸毛长密,在植株生长点茸毛最多(图6-h)。无头苗(图6-i)、多头苗(图6-j)仅在苗期出现,后期发育恢复成正常株型。

图5 果实突变体

图6 植株整株突变体
2.3 M2群体典型变异单株的SSR分析

图7 SSR引物扩增产物的聚丙烯酰胺凝胶电泳图
利用11对 SSR引物对在叶、花和果实部位发生典型变异性状的 15份植株 DNA 通过 PCR 扩增和变性聚丙烯酰胺凝胶电泳进行差异条带检测(图7),通过对其中存在的差异条带进行分析,发现9份材料在 DNA 水平上有变异(表3)。
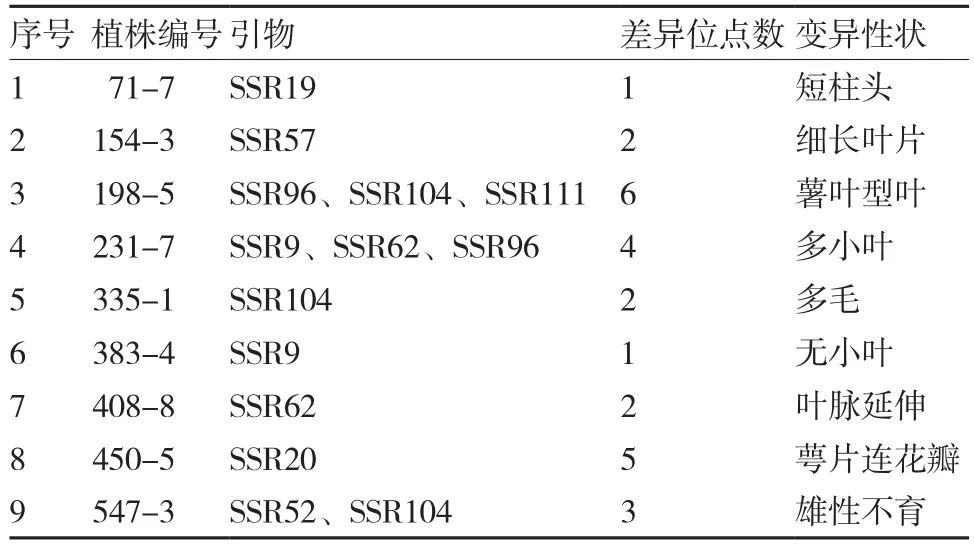
表3 M2表型变异植株的SSR分析结果
3 结论与讨论
EMS浓度是影响突变体有效产生的重要参数,浓度设置要引起一定致死度,在M2得到相对较高的突变率,也要减小M1的不育率,使表型突变体能正常留种。根据崔霞等(2013)的研究结果,0.7%的EMS能减少TTD302A种子30%的相对发芽率,比 0.7%EMS 减少 Red Setter 20% 的相对发芽率要高。M2单株变异频率为7.1%,仅为Micro-Tom的一半,但是M1的可育率为56.6%,远大于Micro-Tom 的 34.5%(Saito et al.,2011)。致死度、可育率以及表型突变率的不同,可能主要是由于材料的遗传背景不同,导致对同浓度的EMS反应不同,Red Setter和Micro-Tom都是栽培种,重组率高,本试验选择的自交系高度纯合,突变位点相对较少,随之发生在生殖代谢过程的点突变也较少,导致突变率低而可育率高。
本试验利用EMS处理番茄种子,出现了很多表型变异体,有许多与前人报道过的形态突变体相似。例如578-5表现叶片卷曲皱缩,墨绿色,且节间缩短,与突变体dump(Koka et al.,2000)相似;300-5叶片边缘向叶面内卷,与突变体flacca(Bowman et al.,1984)相似;298-1、649-5 叶腋分生能力强,叶腋处着生花,且结果,与突变体wiry(Kim,2003)相似。还有很多突变表现可能与某些基因有关,如113株系从有限生长突变成无限生长,可能与基因self-pruning(sp)(Pnueli et al.,1998)突变有关;231-7 整个叶片大,裂刻深,小叶多,叶形复杂,可能与LeT6(Janssen et al.,1998)、PHAN(Kim,2003)、KNOX1(Bharathan et al.,2002)等多个基因的表达有关。EMS引起变异的机理主要是引起G烷基化,从而使烷基化的G取代C与T配对,导致G/C到A/T的替换,容易引起等位基因突变,所以推测以上表型变异出现的原因,可能是某一基因具有多效性,或者是多个基因紧密连锁形成一个单位控制这些复杂性状。
总的来说,化学诱变比自然突变的变异频率要大得多,可有益突变频率 仍然较低。本试验确实获得了一些具有某些优良变异表型的材料,SSR检测结果进一步证明在DNA水平也产生了变异,如雄性不育突变体,为减少番茄杂交种制种工作量提供了宝贵材料。植物育种需要有对作物改良有利的遗传变异性状,EMS诱变能产生大量突变体,对出现的突变体的变异性状进行定向选择,经M3及后代验证为稳定遗传后,可以对具有重要农艺性状的突变体进行鉴定,作为遗传改良和表型标记的全新种质。
本试验利用EMS诱变鲜食粉果大型番茄进行了有益尝试,并取得了较好结果,获得297个M2突变单株,涵盖茎叶、花和果实等植物器官,总的单株变异频率为7.1%。今后,一方面在继续对目前诱变得到的突变体进行分子检测的基础上,对已经检测出能遗传变异且表型稳定的突变体尽快进入应用研究程序;另一方面,可以选用更大的诱变群体,构建鲜食粉果大果型番茄突变体库,为育种和基因功能研究创建基础材料。
安学丽,蔡一林,王久光,王国强,孙海燕.2003.化学诱变及其在农作物育种上应用.核农学报,17(3):239-242.
崔霞,梁燕,王玲慧.2013.不同浓度化学诱变剂甲基磺酸乙酯对番茄种子发芽的影响.北方园艺,(14):28-30.
李卫华,胡志伟,褚洪雷,薛芳,张东海.2011.EMS对小麦产量性状和农艺性状诱变效应的研究.种子,30(1):41-44.
李锡香,杜永臣.2008.番茄种质资源描述规范和数据标准.北京:中国农业科学出版社:11-47.
孙传清,李自超,王象坤.2001.普通野生稻和亚洲栽培稻核心种质遗传多样性的检测研究.作物学报,27(3):313-318.
孙亚东.2012.番茄果实主要品质性状的动态变化及QTL定位 〔博士论文〕.杨凌:西北农林科技大学.
Bharathan G,Goliber T E,Moore C,Kessler S,Pham T,Sinha N R.2002.Homologies in leaf form inferred fromKNOXIgene expression during development.Science,296(5574):1858-1860.
Bowman W,Linforth R,Rossall S,Taylor I.1984.Accumulation of an ABA analogue in the wilty tomato mutant,flacca.Biochemical Genetics,22(3-4):369-378.
Chiu W H,Chandler J,Cnops G,van Lijsebettens M,Werr W.2007. Mutations in theTORNADO2gene affect cellular decisions in the peripheral zone of the shoot apical meristem ofArabidopsis thaliana. Plant Molecule Biology,63(6):731-744.
Cooper J L,Till B J,Laport R G,Darlow M C,Kleffner J M,Jamai A,El-Mellouki T,Liu S,Ritchie R,Nielsen N,Bilyeu K D,Meksem K,Comai L,Henikoff S.2008.TILLING to detect induced mutations in soybean.BMC Plant Biology,8(1):9.
Janssen B-J,Lund L,Sinha N.1998.Overexpression of a homeobox gene,LeT6,reveals indeterminate features in the tomato compound leaf.Plant Physiology,117(3):771-786.
Kim M.2003.Reduced leaf complexity in tomatowirymutants suggests a role forPHANandKNOXgenes in generating compound leaves.Development,130(18):4405-4415.
Koka C V,Cerny R E,Gardner R G,Noguchi T,Fujioka S,Takatsuto S,Yoshida S,Clouse S D.2000.A putative role for the tomato genesDUMPYandCURL-3in brassinosteroid biosynthesis and response. Plant Physiology,122(1):85-98.
Menda N,Semel Y,Peled D,Eshed Y,Zamir D.2004.In silico screening of a saturated mutation library of tomato.The Plant Journal,38(5):861-872.
Minoia S,Petrozza A,D’onofrio O,Piron F,Mosca G,Sozio G,Cellini F,Bendahmane A,Carriero F.2010.A new mutant genetic resource for tomato crop improvement by TILLING technology. BMC Resesrch Notes,3:69.
Pnueli L,Carmel-Goren L,Hareven D,Gutfinger T,Alvarez J,Ganal M,Zamir D,Lifschitz E.1998.TheSELF-PRUNINGgene of tomato regulates vegetative to reproductive switching of sympodial meristems and is the ortholog of CEN and TFL1.Development,125(11):1979-1989.
Saito T,Ariizumi T,Okabe Y,Asamizu E,Hiwasa-Tanase K,Fukuda N,Mizoguchi T,Yamazaki Y,Aoki K,Ezura H.2011. TOMATOMA:a novel tomato mutant database distributing Micro-Tom mutant collections.Plant Cell Physiology,52(2):283-296.
Stephenson P,Baker D,Girin T,Perez A,Amoah S,King G J,Ostergaard L.2010.A rich TILLING resource for studying gene function inBrassica rapa.BMC Plant Biology,10:62.
Till B J,Reynolds S H,Weil C,Springer N,Burtner C,Young K,Bowers E,Codomo C A,Enns L C,Odden A R,Greene E A,Comai L,Henikoff S.2004.Discovery of induced point mutations in maize genes by TILLING.BMC Plant Biology,4:12.
Zhu Y,Zhao H F,Ren G D,Yu X F,Cao S Q,Kuai B K.2005. Characterization of a novel developmentally retarded mutant (drm1)associated with the autonomous flowering pathway inArabidopsis.Cell Research,15(2):133-140.
Identification and Analysis of Mutant Phenotype Tomato Inbred Line TTD302A Induced with EMS
YANG Jian-hua,CUI Xia,CHANG Pei-pei,LI Cui,LI Yun-zhou,LIANG Yan*
(CollegeofHorticulture,NorthwestAgriculture&ForestryUniversity,Yangling712100,Shaanxi,China)
To create new tomato(Solanum lycopersicumL.)germplasm applied both to genetic modified breeding and functional genomics research on tomato,this study treated the seeds of TTD302A with 0.7% EMS for 8 h,then washed them by flowing water. M2seeds were harvested from each plant independently in M1generation. Afterwards,the agronomic traits and biological characters of each plant were both investigated and recorded in M2generation at seedling stage,flowering fruit period and mature period,respectively. The leaves DNA of all mutation plants were extracted,of which 15 materials expressing typical variation characteristics were selected for SSR molecular marker detection. Finally we harvested M3seeds from single plant expressing character mutation separately. Through observation on M2group characters,we found 373 mutant characters and 297 mutant plants in total. The rate of all M2phenotype mutation added up to 7.1%. It could be found that the mutation population contained abundant mutation types appearing in leaf,floral organ,fruit and plant. Their mutation rates were 1.5%,2.8%,1.3%,2.4%,respectively. The results of SSR analysis indicated that 9 materials had mutation in DNA level.
Ethyl methane sulfonate (EMS);Tomato;Inbred line;Mutant
杨建华,硕士研究生,专业方向:番茄诱变育种,E-mail:yangjianhua227@sina.cn
*通讯作者(Corresponding author):梁燕,博士,教授,专业方向:番茄遗传育种与蔬菜种质资源,E-mail:liangyan@nwsuaf.edu.cn
2013-11-21 ;接受日期: 2014-01-15
陕西省科技统筹创新工程计划项目 (2011KTCL02-03)
