应用Ca2+荧光探针fluo-3和fluo-4测定H2O2诱导的A549细胞凋亡过程中的[Ca2+]i变化
2014-09-05张四洋李春艳高建邱雪杉崔泽实
张四洋 李春艳 高建 邱雪杉 崔泽实
Ca2+是非常重要的细胞内第二信使,参与肌细胞收缩、神经递质释放、细胞分化和细胞凋亡等生理、病理过程。细胞内生理Ca2+浓度为10 nM-100 nM,Ca2+超载时浓度为基础浓度的10倍左右,与心脏疾病、神经损伤、肿瘤发生等多种疾病的发生发展密切相关[1]。H2O2是常见的活性氧分子,向细胞外液加入H2O2,可以使细胞处于氧化应激状态,文献[2]报道Ca2+介导了H2O2作用下的大鼠胰腺腺泡AR42J细胞的凋亡。肺癌是世界范围内常见的恶性肿瘤,研究[3-5]表明,引起胞浆Ca2+浓度升高的刺激通过依赖线粒体途径的caspases通路或内质网应激途径,诱导肺癌细胞发生凋亡。实时监测肺癌细胞内Ca2+浓度和胞浆内Ca2+水平,有助于深入研究Ca2+介导肺癌细胞凋亡的分子机制,以寻找促进肺癌细胞凋亡的有效方法。
自1989年开始,应用荧光染料fluo-3对细胞内Ca2+成像,揭示了很多涉及Ca2+信号时空变化的细胞生物学功能。Fluo-3也结合流式细胞仪用于检测Ca2+作为第二信使参与信号转导和细胞药理学筛选等实验研究。Fluo-3用于监测活细胞内[Ca2+]i变化,其最主要的优势在于利用488 nm的氩离子激光源,可以在激光扫描共聚焦显微镜下观察, fl uo-3与Ca2+结合后其荧光强度迅速增强。Fluo-4是 fl uo-3的衍生物,用F取代了 fl uo-3分子中的2个Cl。其激发波长较fluo-3更接近488 nm,产生更强、更稳定的荧光信号,适合于多数配置氩离子激光器的激光扫描共聚焦显微镜观察[6],也可以用于流式细胞仪检测,以及利用多功能酶标仪读取荧光信号[7]。
本研究采用目前实验室常用的Ca2+荧光探针fluo-3和fluo-4负载人肺癌A549细胞,观察H2O2处理的A549细胞中[Ca2+]i变化,对fluo-3和fluo-4的荧光强度和[Ca2+]i测定值进行比较和分析,并探讨在H2O2作用下细胞凋亡情况。
1 材料与方法
1.1 主要试剂与仪器 Fluo-3 AM(Biotium公司,纯度95%)和fluo-4 AM(DOJINDO公司,纯度98%),均用DMSO溶解,0.22 μm滤膜过滤除菌,贮存液浓度为1 mM,-20oC避光保存。RPMI-1640培养基和胎牛血清为Hyclone公司产品,激光共聚焦显微镜专用培养皿(35 mm)购自NEST公司,Ionomycin和细胞固定液均为碧云天公司产品,DAPI细胞凋亡染色试剂盒购自凯基公司,H2O2为国产分析纯。
1.2 细胞培养 采用含10%胎牛血清的RPMI-1640培养基,于37oC、5%CO2培养箱中培养肺癌细胞A549,0.25%胰酶-EDTA消化传代,所有实验均采用对数生长期细胞。
1.3 探针负载细胞并观察[Ca2+]i变化 荧光探针f l uo-3 AM和fluo-4 AM负载细胞时用无Ca2+细胞外液(135 mM NaCl、2 mM KCl、2 mM MgCl2、10 mM HEPES、4 g/L葡萄糖)稀释成工作浓度5 μM。细胞传代24 h后,弃去培养基,用PBS漂洗3次,向细胞中加入fluo-3(5 μM)或fluo-4(5 μM)工作液,避光37oC孵育40 min。弃去荧光探针,更换新的无Ca2+细胞外液,避光37oC继续孵育20 min,保证AM在细胞内被充分水解。在FV1000型激光共聚焦显微镜(Olympus, Japan)下观察选择贴壁良好、形态伸展、荧光强度较亮的细胞,设置扫描条件为488 nm波长激发、39%激光强度、PMT(790)、Pinhole(310 μm)、同时采集DIC图像,每5 s采集一幅,共采集40 min左右。首先扫描10幅待荧光强度曲线稳定后,向细胞中加入不同浓度的H2O2(5 mM、10 mM或50 mM);曲线稳定后,向细胞中加入EGTA(4 mM)+ Ionomycin(5 μM);曲线再一次稳定后,向细胞中加入CaCl2(10 mM),曲线稳定后中止实验。钙离子浓度计算公式为Kd(FFmin)/(Fmax-F)[8],其中f l uo-3探针Kd=400 nM,f l uo-4探针Kd=360 nM。
1.4 DAPI染色检测细胞凋亡 细胞经H2O2处理30 min后,用细胞固定液4%多聚甲醛室温固定10 min,加入DAPI染色液避光孵育20 min,在倒置荧光显微镜下观察,随机选取5个200×镜下视野,计算凋亡细胞百分比。
1.5 统计学分析 采用SPSS13.0统计学软件,进行数据分析及处理。应用t检验比较fluo-3和fluo-4平均荧光强度的差异,应用χ2检验比较凋亡细胞百分比,P<0.05为差异有统计学意义。

图1 H2O2刺激前,负载fluo-3或fluo-4的细胞荧光强度比较。66 mm×58 mm(300×300 DPI)。Fig1 The comparison of fluorescence intensity in cells loaded with fluo-3 or fluo-4 before H2O2 stimulation. 66 mm×58 mm (300×300 DPI).
2 结果
2.1 未经H2O2刺激前细胞中fluo-3和fluo-4染色结果比较在相同的细胞负载和图像采集条件下,未加H2O2处理时,fluo-3染色后的细胞在488 nm激发光激发下发出较弱的绿色荧光(图1)。Fluo-4染色后的细胞在488 nm激发光激发下发出较强的绿色荧光(图1)。
2.2 H2O2处理的细胞[Ca2+]i变化 在5 mM或10 mM H2O2作用下,fluo-3和fluo-4荧光强度均无明显变化(结果未显示)。加入50 mM H2O2后,细胞荧光强度逐渐增强(图2),观察至40 min左右时,荧光强度曲线稳定不再变化(图3)。在实时观察[Ca2+]i变化过程中,荧光探针fluo-3和fluo-4均未出现光漂白现象。观察结束时,fluo-3荧光强度增加至3.0倍,fluo-4荧光强度增加至2.6倍。H2O2刺激前,fluo-4荧光强度约是fluo-3荧光强度的2.0倍,而H2O2刺激后fluo-4荧光强度约是fluo-3荧光强度的1.8倍(表1)。通过公式计算发现采用fluo-3探针负载的选定细胞中[Ca2+]i变化范围是112.2 nM-1,069.6 nM,采用fluo-4探针负载的选定细胞中[Ca2+]i变化范围是7.6 nM-505.4 nM。
2.3 H2O2诱导细胞凋亡 细胞经H2O2刺激后固定,DAPI染色后发现,凋亡细胞呈现核固缩且染色加深,核染色质聚集于核膜一边,或核碎裂成大小不等的圆形小体(图4B),而对照组细胞核形态规则、染色均匀,呈蓝白色荧光(图4A)。结果显示与对照组细胞相比,H2O2处理的细胞凋亡率明显增加(12.2%±2.3% vs 33.4%±3.2%),有统计学意义(P<0.001)。

图2 H2O2刺激后,实时观察细胞中fluo-3和fluo-4荧光强度变化。141 mm×305 mm(300×300 DPI)。Fig2 The real-time observation of the fluorescence intensity in selected cells loaded with fluo-3 or fluo-4 after H2O2 stimulation. 141 mm×305 mm (300×300 DPI).
3 讨论

图3 H2O2刺激后,选定细胞的fluo-3或fluo-4荧光强度变化曲线。145 mm×50 mm(300×300 DPI)。Fig3 The fluorescence intensity curve of selected cells loaded with fluo-3 or fluo-4 after H2O2 stimulation. 145 mm×50 mm (300×300 DPI).
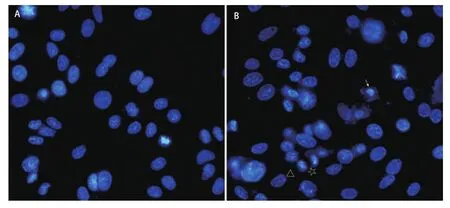
图4 H2O2促进A549细胞凋亡。A: 未经H2O2处理的细胞;B: H2O2处理的细胞,可见核固缩(→)、染色质边集(△)以及核碎裂(☆)。65 mm×32 mm(300×300 DPI)。Fig 4 H2O2 promoted the apoptosis of A549 cells. H2O2: cells without H2O2 treatment; B: karyopyknosis (→), chromatic condensation (△) and nuclear fragmentation (☆) were observed in H2O2 treated cells. 65 mm×32 mm (300×300 DPI).
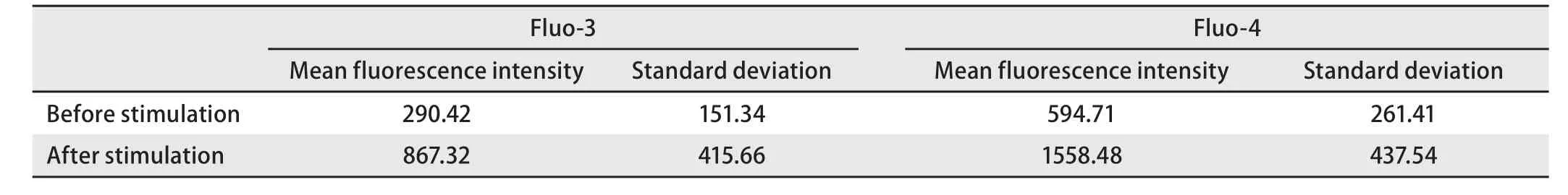
表 1 H2O2刺激前后,选定细胞中fluo-3和fluo-4的平均荧光强度值Table 1 The mean value of fluorescence intensity in selected cells loaded with fluo-3 or fluo-4 before and after H2O2 treatment
本研究在对Ca2+信号实时观察的过程中发现,较高浓度的H2O2(50 mM)诱导细胞内[Ca2+]i迅速升高。由于细胞外液不含有Ca2+,因此[Ca2+]i升高可能是由于细胞的氧化应激反应,导致细胞内钙库(如内质网)释放造成的。有研究[9]表明,H2O2诱导细胞凋亡与钙超载密切相关,氧化应激诱导细胞凋亡的分子机制非常复杂,涉及很多信号转导通路,包括经典的线粒体途径[10]和死亡受体途径[11],以及机制仍不太明确的内质网途径[12]。近年来,对内质网凋亡途径的研究发现,内质网应激导致的非折叠蛋白反应(unfolded protein response, UPR)扮演着重要角色。研究[13]显示,细胞的氧化应激损伤,导致内质网释放大量Ca2+,同时伴有内质网应激,引发UPR,用于ER正常功能的重建。如果细胞内Ca2+浓度持续升高,内质网应激持续时间较长或非常严重,将激活依赖Ca2+的激酶和磷酸酶[14],如calpain、caspase-12和caspase-3级联反应,最终导致细胞凋亡[15]。本研究发现,肺癌细胞A549在较高浓度的H2O2作用下,细胞内Ca2+浓度明显升高,同时发现细胞短时间内即发生凋亡,推测可能与内质网应激有关,calpains或caspases信号通路是否被Ca2+激活导致细胞凋亡,还有待于进一步深入研究。本研究中,可能由于肿瘤细胞的生理Ca2+含量较低,或实时观察时间有限,预实验时使用较低浓度的H2O2时(5 mM, 10 mM)时,没有观察到明显的[Ca2+]i变化,因此我们采用较高浓度的H2O2刺激细胞,低浓度H2O2对A549细胞其他生物学行为的影响还有待于进一步研究。
Fluo-3和fluo-4是目前实验室中常用的Ca2+荧光染料,与Ca2+特异性结合后荧光强度明显增加。本研究对fluo-3和fluo-4在H2O2诱导的A549细胞凋亡过程中监测[Ca2+]i变化的应用情况进行了比较。结果发现,在相同的负载浓度、孵育时间、细胞密度、刺激因素和图像采集条件下,fluo-4的荧光强度更强,大约是fluo-3的2倍左右,这提示我们当细胞内Ca2+信号较强时,用fluo-3或fluo-4都可以观察到明显的荧光强度的变化,但如果细胞内Ca2+信号较弱时,使用 fluo-4探针可能更具优势。细胞经H2O2处理后,fluo-3荧光强度的变化范围大于fluo-4,可能由于荧光探针的Kd值不同,具有较大Kd值的f l uo-3与Ca2+的亲和力较低,适合于检测较宽范围的[Ca2+]i变化。我们还发现,采用荧光探针f l uo-3或f l uo-4,通过公式计算测定的细胞内[Ca2+]i变化范围不是很一致,可能与选择的细胞有关,不同的细胞对H2O2刺激的反应不同,再多重复几次实验,可能会得到比较一致的结果。
Fluo-3和fluo-4进入细胞的方式均为酯负载法。Fluo-3和fluo-4与具有细胞膜通透性的乙酰甲酯(AM)相连形成Fluo-3 AM和fluo-4 AM复合物,穿过细胞膜后在细胞内被非特异性酯酶水解生成相应的Ca2+荧光探针,与Ca2+结合检测细胞内[Ca2+]i变化。我们在实验过程中发现,含血清的培养基会影响f l uo-3和f l uo-4的负载,在激光共聚焦显微镜下观察荧光非常微弱,采集不到良好的荧光信号,这可能是由于含血清的培养基能阻止荧光染料进入细胞。使用标准的无钙细胞外液,由于没有血清和培养液的营养支持,对细胞状态和活性的影响较大,细胞可能在观察过程中逐渐皱缩、脱壁或凋亡,不能对细胞进行长时间检测。
近几年还出现了荧光强度更强、检测范围更宽、更灵敏的Ca2+荧光染料,如fluo-5F、fluo-5N、fluo-4FF,均为fluo-4的类似物,但与Ca2+结合的亲和力较低,更适合于检测1 μM-1 mM范围内的Ca2+水平变化。Fluo-3和fluo-4测定的Ca2+饱和浓度为≥5 μM,当[Ca2+]i升高超过5 μM时,即使有更多的Ca2+出现在细胞中,fluo-3和fluo-4也检测不到,而fluo-5F、fluo-5N、fluo-4FF测定的Ca2+饱和浓度为≥1 mM,这些新的Ca2+探针可以检测到更多的Ca2+,在检测高水平的Ca2+信号时更具优势。Fluo-5F、fluo-4FF的Kd值分别为2.3 μM和9.7 μM,而fluo-5N的Kd值高达90 μM,适合检测更高浓度的Ca2+变化[16]。研究表明应根据细胞内[Ca2+]i的变化水平选择合适的Ca2+荧光探针,当待测Ca2+浓度在荧光染料Kd值的0.1倍-10倍范围之内时其荧光强度与[Ca2+]i呈良好的线性关系,检测结果最准确。
Fluo-3和fluo-4及其类似物均为化学合成的Ca2+荧光染料,与Ca2+有较高的亲和力,通过负载方式很容易进入细胞,但不能在亚细胞水平精确定位,而且可能出现光漂白现象,长时间观察时对细胞活性有影响。除了Ca2+荧光染料,近年来还出现了水母发光蛋白和Cameleon等[17]基于生物发光的Ca2+荧光蛋白探针,需要通过基因转染方式进入细胞,与细胞器特异性基因连接表达重组蛋白,可实现精确的亚细胞定位,长时间观察其荧光强度稳定不会淬灭。目前我们已应用Ca2+荧光蛋白Cameleon YC3.6对H2O2刺激后A549细胞中[Ca2+]i进行了测定[18],但在比较化学合成的Ca2+荧光探针或Ca2+荧光蛋白这两种不同的检测方法方面,还有待于进一步研究。我们应根据实验目的、细胞种类、刺激因素以及检测条件选择合适的Ca2+荧光探针,以帮助我们深入研究不同刺激条件下肿瘤细胞内[Ca2+]i变化,Ca2+信号转导的相关分子机制,以及对肿瘤细胞生物学行为的影响。
