阿托伐他汀对实验性肾间质纤维化大鼠细胞间黏附分子1、核因子-κB表达的影响
2014-09-04张丽敏林海英刘占全王咏梅毕朝煜河北大学附属医院肾内科河北保定07000河北医科大学第三医院肾内科河北石家庄05005
张丽敏,林海英,刘占全,高 燕,王咏梅,毕朝煜(.河北大学附属医院肾内科, 河北 保定 07000;2.河北医科大学第三医院肾内科,河北 石家庄 05005)
·论著·
阿托伐他汀对实验性肾间质纤维化大鼠细胞间黏附分子1、核因子-κB表达的影响
张丽敏1,林海英2*,刘占全1,高 燕1,王咏梅1,毕朝煜1
(1.河北大学附属医院肾内科, 河北 保定 071000;2.河北医科大学第三医院肾内科,河北 石家庄 050051)
目的研究阿托伐他汀对肾间质纤维化大鼠的肾脏保护机制。方法54只Wistar大鼠随机分为假手术组(A组,n=18)、单侧输尿管结扎(unilateral ureteral obstruction,UUO)模型组(B组,n=18)、阿托伐他汀治疗组(C组,n=18)。C组于术前3天开始灌胃(阿托伐他汀10mg·kg-1·d-1,制成混悬液),A组及B组给予等量生理盐水灌胃,分别于术后第3、7、14天处死。光镜观察肾脏病理改变,并采用免疫组织化学染色测定肾小管间质中细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)、核因子-κB(nuclear factor-κB,NF-κB)的表达。结果B组ICAM-1、NF-кB的表达随梗阻时间延长明显增加, C组术后第3、7、14天ICAM-1、NF-кB的表达均显著低于同期B组(P<0.05)。相关分析结果显示,第3、7、14天NF-кB的表达与同期、同组ICAM-1的表达呈正相关(P<0.05)。结论阿托伐他汀能下调肾小管间质中ICAM-1、NF-кB的表达,抑制和延缓肾间质纤维化的进展。阿托伐他汀对ICAM-1的下调作用至少部分是通过抑制NF-кB的表达而实现的。
肾病;阿托伐他汀;胞间黏附分子1;NK-κB
10.3969/j.issn.1007-3205.2014.08.004
肾间质纤维化是各种慢性肾脏疾病进展至终末期的直接原因,肾小管间质损害的严重程度与肾脏疾病的预后密切相关。细胞间黏附分子1(intercellularadhesionmolecule1,ICAM-1)是黏附分子家族中的重要成员,可在肾间质迅速增加,与肾小管间质炎细胞浸润及病变程度密切相关。核因子-кB(nuclearfactor-кB,NF-кB)是普遍存在于细胞质中以p50/p65异二聚体为存在形式的一种快反应转录因子,主要参与免疫炎症反应和某些细胞(如T细胞、系膜细胞等)的生长及抗凋亡作用[1]。ICAM-1的表达受NF-кB的调控,NF-кB的活化可上调其表达。因此,从NF-кB这一环节抑制ICAM-1的作用,可能是一种有效防治肾间质纤维化的方法。近年发现,他汀类药物除调脂作用外,还具有非依赖降脂的肾保护作用。他汀类药物可抑制NF-кB的活性。本实验通过单侧输尿管结扎(unilateralureteralobstruction,UUO)建立肾间质纤维化动物模型,并进行药物干预,通过免疫组织化学、病理组织学检查等方法检查ICAM-1、NF-кB等在肾小管间质的表达情况及用药后的变化,旨在进一步探讨他汀类药物的肾保护作用机制。
1 材料与方法
1.1 实验动物来源及分组:清洁级健康雄性Wistar大鼠54只(购自河北省实验动物中心),随机分为假手术组(A组)、模型组(B组)、阿托伐他汀治疗组(C组),每组各18只。每组在术后第3、7、14天分批处死,每时点各6只。B、C组行左侧输尿管结扎并剪断,A组只游离输尿管,不结扎。于术前3d开始灌胃。C组给予阿托伐他汀(立普妥10mg·kg-1·d-1,溶于生理盐水,制成混悬液),A、B组给予等量生理盐水灌胃。分别于术后第3、7、14天断头处死。留取血标本2mL,检测血清总胆固醇(totalcholesterol,TC),并留取肾脏标本置于10%中性甲醛中固定,制备石蜡切片,用于苏木精-伊红(hematoxylin-eosin,HE)染色、Masson染色及免疫组织化学染色。
1.2 药品试剂:阿托伐他汀钙片(商品名立普妥)辉瑞制药有限公司分装。兔抗大鼠ICAM-1多克隆抗体,兔抗大鼠NF-кB多克隆抗体,免疫组织化学试剂盒,均购自北京中山生物技术有限公司。
1.3 肾脏组织病理:HE染色、Masson染色后,光镜下观察肾小管间质病变程度,Masson染色绿色为胶原纤维,在高倍镜(×200)下随即选择15个不含肾小球及血管的肾皮质视野,以肾间质面积占一个视野场面积的百分比作为相对间质容积值。
1.4 免疫组织化学检测:石蜡切片常规脱蜡至水(同HE染色),3%H2O2消除内源性过氧化物酶活性。用1%小牛血清白蛋白(bovineserumalbumin,BSA)封闭,室温孵育10~15min(封闭组织内电荷)。滴加1/50稀释的一抗,4℃过夜。滴加生物素标记的二抗,37℃孵育60min。滴加链霉菌抗生物素蛋白-过氧化物连接法(streptavidin-perosidase,SP)复合物,37℃孵育30~40min。磷酸盐缓冲液(phosphatebufferedsaline,PBS)4mL、二氨基联苯胺(3-3-diaminobenzidine,DAB)5g、H2O25μL,显色5min左右(以镜下适度为好)。苏木精复染1min,1%盐酸酒精分化,脱水、透明、封片。采用1%BSA代替一抗的组织切片作为阴性对照,已知阳性标本作为阳性对照。光镜下阳性反应部位为棕黄色。应用真彩色医学图像分析系统通过光学显微镜摄入图像,放大200倍,每例切片随机选取15个不含肾小球和小血管的肾皮质视野,测定阳性着色部位的总积分光密度值,并取其平均值为肾小管间质ICAM-1、NF-кB的阳性面积与着色强度综合评价指标。

2 结 果
2.1 血清TC的测定:A、B、C3组TC在3、7、14d相同时点差异均无统计学意义(P>0.05);A、B、C3组TC在3、7、14d不同时点之间差异也无统计学意义(P>0.05)。见表1。
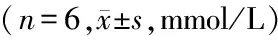

GroupsTC3d7d14dFPA2.15±0.412.04±0.282.22±0.460.3240.729B2.24±0.402.17±0.542.13±0.300.1030.903C2.36±0.272.08±0.432.27±0.570.6310.546F0.0020.1440.145P0.9980.8670.867
TC:total cholesterol
2.2 肾脏病理改变:大体观察,A组肾脏组织红润,无肿大,B、C组梗阻侧肾脏体积明显增大,颜色变白。纵向剖开后,可见肾内积水,积液清亮透明,肾盂肾盏高度扩张,肾皮质明显萎缩变薄。HE染色A组未见异常。B组第3天可见肾小管轻微扩张,上皮细胞空泡变性,肾间质开始增宽,间质中少量单核细胞与淋巴细胞浸润。B组第7天可见肾小管扩张,部分小管萎缩、闭塞或坏死,肾间质面积增宽,间质中单核细胞与淋巴细胞浸润明显。B组第14天肾小管扩张、坏死明显,小管基底膜不同程度断裂,间质中大量单核细胞与淋巴细胞浸润。Masson染色可见A组大鼠肾脏胶原染色主要位于肾小球基底膜、Bowman囊、系膜区和肾小管间的毛细血管周围,而小管周围间质部分比较狭窄。A组在第3、7、14天肾间质纤维化半定量指标无明显变化(P>0.05),B组在第3、7、14天肾间质纤维化纤维化半定量指标均较A组有明显升高(P<0.01),并且随时间延长,逐渐升高(P<0.01);C组虽然也有随时间延长逐渐增高趋势,但是已经较B组明显降低,差异有统计学意义(P<0.01)。见表2。


GroupsRenalinterstitialvolume3d7d14dFPA0.039±0.0060.040±0.0050.037±0.0020.6460.538B0.103±0.018∗0.250±0.025∗△0.361±0.035∗△☆138.6760.000C0.061±0.006∗#0.156±0.023∗#△0.211±0.024∗#△☆90.8410.000F48.061168.936262.192P0.0000.0000.000
*P<0.01vsA group #P<0.01vsB group △P<0.01vs3d ☆P<0.01vs7d byqtest
2.3 免疫组织化学染色结果
2.3.1 ICAM-1染色:ICAM-1在A组微量表达于肾小管上皮细胞、 肾血管内皮细胞和肾小球系膜细胞(图1)。A组在第3、7、14天ICAM-1表达无明显变化(P>0.05),B组在第3、7、14天ICAM-1表达均较A组有明显升高(P<0.01),并且随时间延长,ICAM-1表达逐渐升高(P<0.01);C组ICAM-1表达虽然也有随时间延长逐渐增高趋势,但是已经较B组明显降低,差异有统计学意义(P<0.01)。见表3。
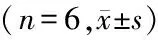

GroupsICAM⁃13d7d14dFPA93.56±17.5591.35±16.2892.02±17.460.0260.974B358.17±38.93∗956.83±56.59∗△2199.20±403.20∗△☆94.8890.000C182.09±20.52∗#716.10±46.93∗#△1602.02±89.01∗#△☆877.9090.000F146.203633.514124.304P0.0000.0000.000
*P<0.01vsA group #P<0.01vsB group △P<0.01vs3d ☆P<0.01vs7d byqtest
ICAM-1:intercellular adhesion molecule 1
2.3.2 NF-кB染色:NF-кB在A组各时间点仅见少部分的肾小管上皮细胞和肾间质细胞胞浆呈微弱表达(图2)。A组在第3、7、14天NF-кB表达无明显变化(P>0.05),B组在第3、7、14天NF-кB表达均较A组有明显升高(P<0.01),并且随时间延长,NF-кB表达逐渐升高(P<0.01);C组NF-кB表达虽然也有随时间延长逐渐增高趋势,但已经较B组明显降低,差异有统计学意义(P<0.01)。见表4。
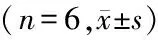
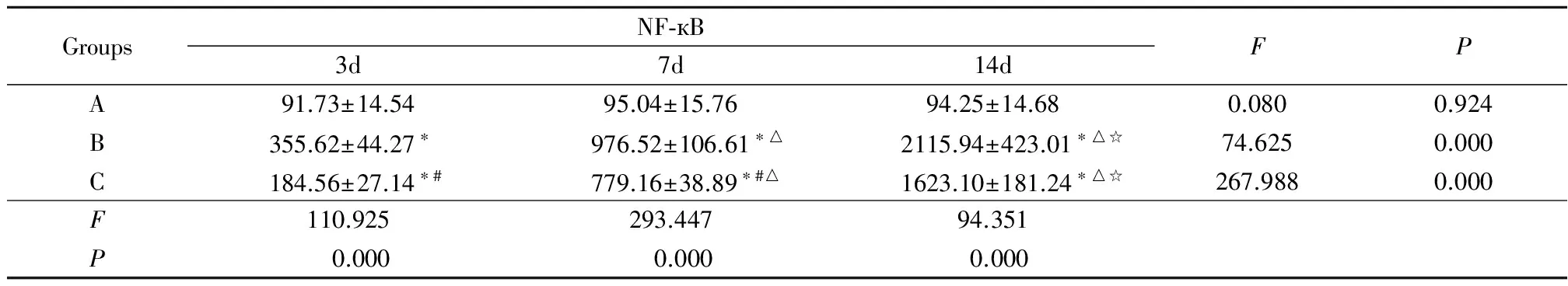
GroupsNF⁃кB3d7d14dFPA91.73±14.5495.04±15.7694.25±14.680.0800.924B355.62±44.27∗976.52±106.61∗△2115.94±423.01∗△☆74.6250.000C184.56±27.14∗#779.16±38.89∗#△1623.10±181.24∗△☆267.9880.000F110.925293.44794.351P0.0000.0000.000
*P<0.01vsA group #P<0.01vsB group △P<0.01vs3d ☆P<0.01vs7d byqtest
NF-кB:nuclear factor-кB
2.4 相关性分析:NF-кB与ICAM-1显著正相关(P<0.05)。见表5。

表5 NF-кB与ICAM-1的表达相关性Table 5 The correlationship of NF-кB and ICAM-1 (r)
*P<0.05
ICAM-1:intercellular adhesion molecule 1;NF-кB:nuclear factor-кB
3 讨 论
肾间质纤维化是各种原因引起的肾脏疾病进展至终末期肾衰竭的共同病理特征。研究[2]表明,肾间质纤维化的程度与肾功能的相关性比肾小球硬化与肾功能的相关性更为密切,是判断慢性肾脏病预后的最重要指标之一。肾间质炎细胞尤其是巨噬细胞的急性浸润是肾小管间质炎症病变及早期损伤的主要原因,后者又是导致随后肾间质纤维化形成过程的病理基础,而黏附分子介导的细胞黏附机制是炎细胞浸润及小管间质损伤的分子基础。ICAM-1作为一种主要的黏附分子在肾间质纤维化的病理发展过程中起到了重要作用,它的过度表达导致炎性细胞在肾组织的大量聚积,引起细胞外基质沉积,肾小球和肾小管-间质纤维化[3]。Kriegsman等[4]在大鼠UUO模型中发现ICAM-1/淋巴细胞功能相关抗原的表达与肾间质纤维化的进展呈正相关。Arrizabalaga等[5]也提出,ICAM-1在肾小管间质的表达可作为IgA肾病小管间质损伤的标志。NF-кB是1986年首先由Sen和Baltimore从B淋巴细胞核提取物中发现的一种能与免疫球蛋白к轻链基因的增强子B序列特异性结合,并能调节其转录活性的蛋白质因子[6]。NF-кB作为具有多向性调节作用的核转录因子,参与了多种炎性反应性细胞因子、趋化因子和促纤维因子的合成,以及细胞增殖、细胞外基质交联及成纤维细胞的分化过程。包括白细胞介素1、白细胞介素2、白细胞介素6、白细胞介素8、单核细胞趋化蛋白、干扰素、血管细胞黏附分子、ICAM-1、P-选择素等[7]。活化的NF-кB在肾脏疾病的发生发展过程中的作用主要有以下3个方面:①参与肾组织产生化学趋化因子和细胞黏附因子,致单核巨噬细胞浸润,引起组织炎症纤维化;②促进成纤维细胞增殖、分化;③与成纤维细胞及肾固有细胞产生前纤维化因子(如转化生长因子β等)有关。本实验制备大鼠UUO模型,观察ICAM-1、NF-кB的表达情况,结果显示,随梗阻时间延长,模型组ICAM-1、NF-кB表达逐渐增强,表明ICAM-1、NF-кB在肾间质纤维化的发生、发展中起着重要的作用,是导致肾间质纤维化的重要因素;且NF-кB与ICAM-1的表达呈正相关,提示了NF-кB对ICAM-1的调节作用。
他汀类药物能有效降低胆固醇的合成而广泛应用于高胆固醇血症的治疗,可降低心血管事件的发病率和病死率。他汀类药物除调脂作用外,还具有非依赖降脂的直接肾保护作用。目前发现他汀类药物非依赖降脂的肾保护作用机制主要包括以下几个方面:①抗细胞增殖作用。他汀类药物能够影响细胞的增殖与死亡之间的平衡,阻止细胞的增殖,促进凋亡,从而减轻肾损伤。有体外研究[8]显示,他汀类药物能通过增加细胞周期蛋白依赖性激酶(cyclin-dependent protein kinases,CDK)抑制剂P27Kipl、P21蛋白表达,降低CDK4和CDK2激酶活性,调节细胞周期,抑制系膜细胞增殖,并诱导其凋亡。②减少细胞外基质。他汀类药物可减少细胞外基质合成,促进其降解,减轻肾脏疾病肾组织中细胞外基质的堆积[9]。③抗炎症作用。Diomede等[10]在急性炎症动物模型(Air-Pouch小鼠)研究中发现,经短期的洛伐他汀、普伐他汀、辛伐他汀治疗后,没有影响血清TC水平,但可通过下调单核细胞趋化蛋白1、白细胞介素6的表达抑制了急性炎症白细胞的补充和迁移。
本实验应用阿托伐他汀对大鼠UUO模型进行干预后,发现治疗组ICAM-1、NF-кB表达明显减弱,说明在UUO状态下,阿托伐他汀能明显减轻大鼠肾间质炎症反应,有效减轻肾间质纤维化程度,其肾保护作用与降低ICAM-1、NF-кB的表达有关。阿托伐他汀对ICAM-1的抑制作用,至少部分是通过下调NF-кB的表达实现的,可能也包括直接的抑制作用,其具体机制尚待进一步研究。且实验表明血脂水平没有受到影响,说明阿托伐他汀这一作用是独立于降脂之外的。(本文图见封二)
[1] 刘淑霞,张玉军,刘汝俊,等.NF-кB、COX-2在高糖培养的肾小管上皮细胞中的表达及意义[J].河北医科大学学报,2008,29(3):321-323.
[2] 刘东芹,林海英,崔丹.肾炎四味片对单侧输尿管梗阻大鼠肾间质NF-кB、TGF-β1表达的影响[J].河北医科大学学报,2009,30(11):1181-1183.
[3] WANG L,ZHANG L,YU Y,et al.The protective effects of taurine against early renal injury in STZ-induced diabetic rats,correlated with inhibition of renal LOX-1-mediated ICAM-1 expression[J].Ren Fail,2008,30(8):763-771.
[4] KRIEGSMAN J,MÜLLER H,SOMMER M,et al.Expression of LFA-1(CD11a/CD18) and ICAM-1(CD54) in an animal model of renal interstitial fibrosis induced by unilateral ureteral obstruction[J].Exp Toxicol Pathol,2000,52(3):185-191.
[5] ARRIZABALAGA P,SOLÉ M,ABELLANA R,et al.Tubular and interstitial expression of ICAM-1 as a marker of renal injury in IgA nephropathy[J].Am J Nephrol,2003,23(3):121-128.
[6] TOZAWA K,YASUI T,OKADA A,et al.NF-kappaB activation in renal tubular epithelial cells by oxalate stimulation[J].Int J Urol,2008,15(10):924-928.
[7] PANZER U,STEINMETZ OM,TURNER JE,et al.Resolution of renal inflammation:a new role for NF-kappaB1(p50)in inflammatory kidney diseases[J].Am J Physiol Renal Physiol,2009,297(2):F429-439.
[8] DANESH FR,SADEGHI MM,AMRO N,et al.3-Hydroxy-3-methylglutaryl CoA reductase inhibitors prevent high glucose- induced proliferation of mesangial cells via modulation of Rho GTPase/P21 signaling pathway:implications for diabetic nephropathy [J].Proc Natl Acad Sci USA,2002,99(12):8301-8305.
[9] 任韫卓,刘巍,曹延萍,等.辛伐他汀对UUO大鼠肾组织p-Smad2/3表达影响的研究[J].河北医科大学学报,2008,29(4):487-490,封2,封3.
[10] DIOMEDE L,ALBANI D,SOTTOCORNO M,et al.In vivo anti-inflammatory effect of statins is mediated by nonsterol mevalonate products[J].Arterioscler Thromb Vasc Biol,2001,21(8):1327-1332.
(本文编辑:许卓文)
EFFECTSOFARTORVASTATINONINTERCELLULARADHESIONMOLECULE-1ANDNUCLEARFACTOR-кBINRATSWITHRENALINTERSTITIALFIBROSIS
ZHANGLimin1,LINHaiying2*,LIUZhanquan1,GAOYan1,WANGYongmei1,BIZhaoyu1
(1.DepartmentofNephrology,theAffiliatedHospitalofHebeiUniversity,HebeiProvince,Baoding071000,China;2.DepartmentofNephrology,theThirdHospitalofHebeiMedicalUniversity,Shijiazhuang050051,China)
ObjectiveToobservetheprotectiveroleofartorvastatinforkidneyinratswithrenalinterstitialfibrosis.MethodsFifty-fourmaleWistarratswererandomlydividedintothreegroupssham-operatedgroup(groupA,n=18),unilateralureteralobstruction(UUO)group(groupB,n=18),UUOwithartorvastatintreatedgroup(groupC,n=18).Artorvastatinputtouse3daysbeforesurgery.UUOandshamrats
equalvolumephysiologicalsalifbydailygastricgavage.Ratswerekilledafter3,7,14daysofthesurgery.Thekidneypathologicalchangeswereobservedundermicroscope.Theexpressionsofintercellularadhesionmolecule-1 (ICAM-1)andnuclearfactor-кB(NF-кB)wereanalyzedbyroutineimmunohistochemicalmethod.ResultsThelevelsofICAM-1andNF-кBingroupBwerevariousandsignificantlyhigherwiththeextensionofobstructiontime.ThelevelsofICAM-1andNF-кBingroupCweresignificantlylowerthanthoseofgroupBatthesameperiod(P<0.05).ThelevelofNF-кBwassignificantlyassociatedwithICAM-1 (P<0.05).ConclusionArtorvastatinreducesICAM-1andNF-кBexpression,resultingindecreasedtubulardamageandinterstitialfibrosis.TheeffectofartorvastatininreducingICAM-1perhapsimplementsthroughtheinhibitionofNF-кBpartly.
nephrosis;artorvastatin;intercellularadhesionmolecule-1;NF-kappaB
2013-11-18;
2014-02-12
张丽敏(1978-),女, 河北唐县人,河北大学附属医院主治医师,医学硕士,从事肾内科疾病诊治研究。
*通讯作者。E-mail: linhaiying@medmail.com.cn
R256.59
A
1007-3205(2014)08-0877-05
