丹参酮ⅡA保护脑梗死大鼠血脑屏障的机制研究
2014-09-04祝春华王力娜河北医科大学第二医院神经内科河北石家庄050000
温 雅,祝春华,王力娜,季 辉,刘 莹(河北医科大学第二医院神经内科,河北 石家庄 050000)
·论著·
丹参酮ⅡA保护脑梗死大鼠血脑屏障的机制研究
温 雅,祝春华,王力娜,季 辉,刘 莹
(河北医科大学第二医院神经内科,河北 石家庄 050000)
目的探讨丹参酮ⅡA对大鼠脑梗死后血脑屏障的保护作用及其机制。方法线栓法建立大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠模型。实验采用随机分组(n=168),分为假手术组、MCAO组、丹参酮ⅡA大剂量组、丹参酮ⅡA小剂量组。丹参酮ⅡA于术后立即腹腔注射,大鼠24h处死。采用Western Blot和反转录-聚合酶链反应测定claudin-5蛋白和IgG变化,激光共聚焦显微镜观察双重荧光标记的claudin-5和IgG在脑组织的分布,并观察神经功能、脑梗死体积和脑水肿。结果与假手术组比较,MCAO组claudin-5表达明显减少;大剂量丹参酮ⅡA能够显著上调claudin-5,明显改善神经功能,减轻脑水肿,减小梗死体积,减少IgG渗出,保护血脑屏障。结论大剂量丹参酮ⅡA通过上调claudin-5表达,维持血管内皮细胞紧密连接的完整性,对血脑屏障发挥保护作用,是丹参酮ⅡA治疗脑梗死的重要机制
脑梗死;血脑屏障;丹参酮
10.3969/j.issn.1007-3205.2014.08.001
血脑屏障破坏是脑梗死后脑水肿形成的主要原因,是导致继发性脑损伤的重要机制之一[1],而决定血脑屏障完整性的最主要结构是紧密连接蛋白。Claudin-5是紧密连接蛋白的代表成分,其水平代表了血脑屏障的完整性。增加claudin-5表达的药物能够有效保护血脑屏障完整性,减轻脑水肿[1-2]。丹参酮ⅡA是中药丹参的有效活性成分[3],能够抑制炎症反应和细胞凋亡,广泛用于治疗心脑血管病等[4]。而丹参酮Ⅱ能否保护血脑屏障以及详细机制有待明确。本研究建立大鼠永久性大脑中动脉闭塞(middlecerebralarteryocclusion,MCAO)模型,观察丹参酮ⅡA对脑梗死后脑水肿和claudin-5表达的影响,探讨其对血脑屏障的保护作用及机制。
1 材料与方法
1.1 动物与试剂
1.1.1 实验动物:成年雄性健康清洁级SD大鼠168只,体质量250~280g,由河北省实验动物中心提供。
1.1.2 试剂和仪器:兔抗claudin-5多克隆抗体(美国SantaCraz);DYY-12型电泳仪(北京六一仪器厂);Synergy-HT多功能酶标仪(美国Bio-Tek);聚合酶链反应扩增仪(德国Eppendorf);荧光定量聚合酶链反应仪7500(美国ABI);OLYMPUSFV10-ASW激光扫描共聚焦显微镜(日本OLYMPUS)。
1.1.3 引物设计与合成:上海生物工程公司合成,引物序列如下。Claudin-5,上游5′-CACAGAGAGG-GGTCGTTGAT-3′,下游5′-ACTGTTAGCGGCAGTTT-GGT-3′;β-actin,上游5'-GCCATGTACGTAGCCAT-CCA-3′,下游5′-GACTCATCGTACTCCTGCTTGCTG-3′。
1.2 实验方法
1.2.1 动物分组和模型:线栓法建立持续性大鼠右侧MCAO模型。随机将168只SD大鼠分为假手术组、MCAO组、丹参酮ⅡA大剂量(丹参酮ⅡA-H)组、丹参酮ⅡA小剂量(丹参酮ⅡA-L)组,每组42只。假手术组血管分离后不插线栓。丹参酮ⅡA组分别以20mg/kg和10mg/kg于MCAO手术后立即腹腔注射。
1.2.2 神经功能缺失评分:处死之前,单盲采用改良的Longa分级法进行行为学评分。0分,无缺陷;1分,不能伸展对侧前肢;2分,对侧前肢屈曲;3分,轻度向对侧转圈;4分,严重向对侧转圈;5分,向对侧跌倒(n=10)。
1.2.3 脑组织含水量测定:大鼠在手术后24h断头,迅速取脑。冠状切开去除额极,双侧取约2mm厚的脑组织,采用干湿法测定脑组织含水量,脑组织含水平=(脑组织湿质量-脑组织干质量)/湿质量×100%(n=8)。
1.2.4 脑梗死体积测定;各组大鼠在相应时间断头取脑,均匀切成5片冠状切片,浸入2% 2,3,5-氯化三苯基四氮唑溶液,37℃染色30min后4%多聚甲醛中固定24h。梗死体积百分比=(矫正梗死体积/非缺血侧半球体积)×100%(n=6)。
1.2.5Claudin-5表达和IgG荧光渗出:采用WesternBlot检测claudin-5蛋白表达(n=6),采用反转录-聚合酶链反应检测claudin-5mRNA表达,以β-actin作为内参基因(n=6)。激光扫描共聚焦显微镜观察冰冻脑组织片内claudin-5及IgG的共表达并同时测定渗出IgG的强度(n=6)。

2 结 果
2.1 丹参酮ⅡA改善大鼠MCAO后的神经功能:MCAO组、丹参酮ⅡA-H组、丹参酮ⅡA-L组与假手术组比较,均有明显的神经功能障碍。与MCAO组相比,TanⅡA-H组的神经功能在24h得到明显改善(P<0.05)。TanⅡA-L组的神经功能评分虽然低于MCAO组,但差异无统计学意义(P>0.05)。见图1。

图1 各实验组术后24h神经功能评分(n=10)
*P<0.05与其他组比较(单因素方差分析)
Figure1Theneurologicaldeficitsat24hafteroperation(n=10)
*P<0.05vsothergroupsbyANOVA
2.2TanⅡA显著减轻患侧脑水肿:术后24h,与假手术组比较,其余3组患侧脑组织有明显的水肿(P<0.05);与MCAO组相比,TanⅡA-H组患侧脑水肿得到明显改善(P<0.05),TanⅡA-L组患侧脑水肿改善差异无统计学意义(P>0.05)。见表1。


GroupsWatercontentofipsilateralhemisphereSham⁃operated77.87±0.17MCAO83.21±0.12∗TanⅡA⁃L81.75±0.06∗TanⅡA⁃H78.60±0.05∗# F1.012 P<0.05
*P< 0.05vssham-operated group #P<0.05vsMCAO group byqtest
2.3 TanⅡA显著减小脑梗死体积:假手术组未见缺血病灶,MCAO组、TanⅡA-L组和TanⅡA-H组均有大小不等的缺血性病灶。TanⅡA-H组与MCAO组比较,缺血性病灶体积明显减小(P<0.05)。见表2。

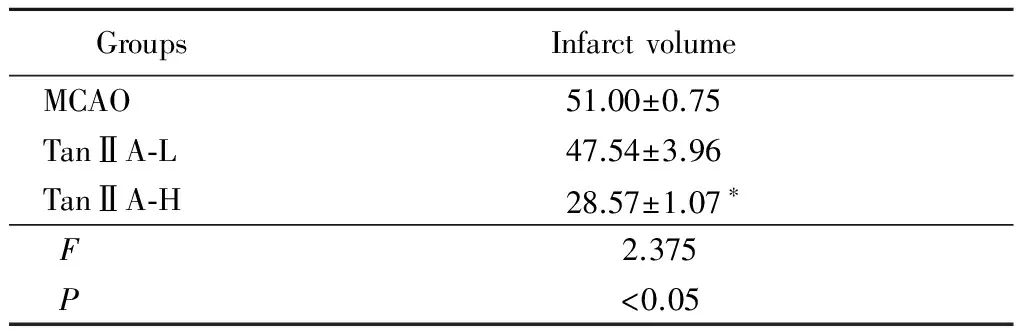
GroupsInfarctvolumeMCAO51.00±0.75TanⅡA⁃L47.54±3.96TanⅡA⁃H28.57±1.07∗ F2.375 P<0.05
*P<0.05vsMCAO group byqtest
2.4 TanⅡA上调claudin-5表达:与假手术组比较,MCAO组脑缺血后24h时claudin-5蛋白表达水平明显下降;与MCAO组比较,TanⅡA-L和TanⅡA-H均能够显著上调claudin-5表达(P<0.05)。见表3。

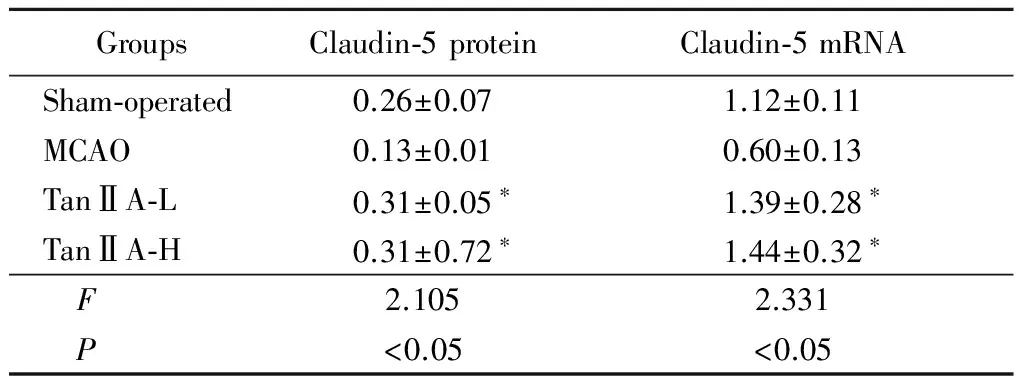
GroupsClaudin⁃5proteinClaudin⁃5mRNASham⁃operated0.26±0.071.12±0.11MCAO0.13±0.010.60±0.13TanⅡA⁃L0.31±0.05∗1.39±0.28∗TanⅡA⁃H0.31±0.72∗1.44±0.32∗ F2.1052.331 P<0.05<0.05
*P< 0.05vsMCAO group byqtest
2.5 TanⅡA减少IgG荧光渗出:与MCAO组比较,TanⅡA-H能够显著减少IgG的渗出,而TanⅡA-L作用不明显。见表4。
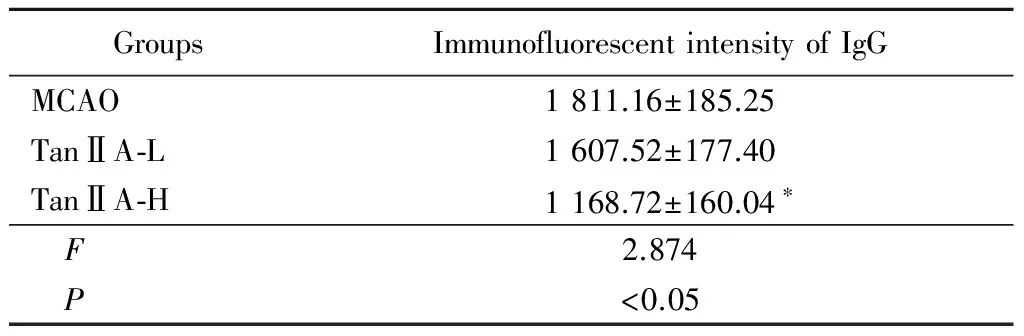
GroupsImmunofluorescentintensityofIgGMCAO1811.16±185.25TanⅡA⁃L1607.52±177.40TanⅡA⁃H1168.72±160.04∗ F2.874 P<0.05
*P<0.05vsMCAO group byqtest
3 讨 论
血脑屏障结构包括血管内皮细胞和紧密连接蛋白、基底膜以及血管周围的星形胶质细胞的终足。紧密连接蛋白的作用是连接血管内皮细胞,是决定血脑屏障的完整性的关键性结构[1-3]。其中,claudin-5是最重要的贯穿紧密连接蛋白中的特殊蛋白,大量分布于脑血管内皮细胞[3-4]。
血脑屏障的完整性是保证脑组织内环境稳定的重要基础[5]。研究[4,6]证明,脑梗死后早期就引起血脑屏障结构破坏,使其通透性增加,是各种炎症介质、抗体、补体以及血浆蛋白等进入脑实质,引起脑水肿等一系列病理反应的基础。本研究结果显示,大鼠脑梗死后24h时,出现显著的神经功能障碍和脑水肿,血脑屏障完整性破坏,claudin-5表达明显减少。有研究[1]证明,claudin-5基因敲除后,相对分子质量小于800 000的物质能够顺利通过血脑屏障进入脑组织。而促进claudin-5表达的药物能够有效降低血脑屏障通透性[7-8]。
丹参酮ⅡA是从唇形科植物丹参的根中提取分离的二萜醌类化合物,为丹参中的有效成分。近年来研究发现丹参酮ⅡA不仅具有较强的抗菌、抗炎、抗肿瘤活性,还具有抗血小板聚集、抗血栓作用[9]。在脑梗死方面,研究证明丹参酮ⅡA分别通过抑制脑梗死后炎症反应和细胞凋亡等途径,能够有效减小脑梗死体积,减轻脑水肿,具有神经保护作用[10-12]。本研究结果发现,大剂量丹参酮ⅡA(20mg/kg)能够显著上调claudin-5蛋白和基因表达,减少大分子物质IgG渗出,减小脑梗死体积,减轻脑水肿,改善神经功能。
综上所述,丹参酮ⅡA通过上调claudin-5水平,维持血管内皮细胞紧密连接蛋白的完整性,降低血脑屏障的通透性,减轻脑水肿,是其治疗脑梗死的部分作用机制。但是,丹参酮ⅡA治疗脑梗死以及保护血脑屏障的详细机制仍需深入研究。
[1] GIBSON CL,SRIVASTAVA K,SPRIGG N,et al.Inhibition of Rho-kinase protects cerebral barrier from ischaemia-evoked injury through modulations of endothelial cell oxidative stress and tight junctions[J].J Neurochem,2014,129(5):816-826.
[2] JIA W,LU R,MARTIN TA,et al.The role of claudin-5 in blood-brain barrier (BBB) and brain metastases (review)[J].Mol Med Rep,2014,9(3):779-785.
[3] NITTA T,HATA M,GOTOH S,et al.Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice[J].J Cell Biol,2003,161(3):653-660.
[4] JIAO H,WANG Z,LIU Y,et al.Specific role of tight junction proteins claudin-5,occludin,and ZO-1 of the blood-brain barrier in a focal cerebral ischemic insult[J].J Mol Neurosci,2011,44(2):130-139.
[5] JIANG SI,JEONG SI,KIM KJ,et al.Tanshinone ⅡA from Salvia miltiorrhiza inhibits inducible nitric oxide synthase expression and production of TNF-alpha,IL-1beta and IL-6 in activated RAW 264.7cells[J].Planta Med,2003,69(11):1057-1059.
[6] YANG Y,ROSENBERG GA.Blood-brain barrier breakdown in acute chronic cerebrovascular disease[J].Stroke,2011,42(11):3323-3328.
[7] MORITA K,SASAKI H,FURUSE M,et al.Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells[J].J Cell Biol,1999,147(1):185-194.
[8] CHEN Y,WU X,YU S,et al.Neuroprotective capabilities of Tanshinone ⅡA against cerebral ischemia/reperfusion injury via anti-apoptotic pathway in rats[J].Biol Pharm Bull,2012,35(2):164-170.
[9] ZHOU L,ZUO Z,CHOW MS.Danshen: an overview of its chemistry,pharmacology,pharmacokinetics,and clinical use[J].J Clin Pharmacol,2005,45(12):1345-1359.
[10] HONDA M,NAKAGAMA S,HAYASHI K,et al.Adrenomedullin improves the blood-brain barrier function through the expression of claudin-5[J].Cell Mol Neurobiol,2006,26(2):109-118.
[11] CHEN Y,WU X,YU S,et al.Neuroprotection of tanshinone ⅡA against cerebral ischemia/reperfusion injury through inhibition of macrophage migration inhibitory factor in rats[J].PLoS One,2012,7(6):e40165.
[12] GIDDY JM,GASCHE YG,COPIN JC,et al.Leukocyte-derived matrix metalloproteinase-9 mediates blood-brain barrier breakdown and is proinflammatory after transient focal cerebral ischemia[J].Am J Physiol Heart Circ Physiol,2005,289(2):H558-568.
(本文编辑:刘斯静)
MECHANISMOFTANSHINONEⅡAPROTECTINGBLOOD-BRAINBARRIERINFOCALCEREBRALISCHEMIAOFRATS
WENYa,ZHUChunhua,WANGLina,JIHui,LIUYing
(DepartmentofNeurology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
ObjectiveThisstudyistoexploretheprotectiveroleandmechanismoftanshinoneⅡA(TanⅡA)fortheblood-brainbarrierinfocalcerebralischemiaofrats.MethodsMaleSprague-Dawleyratsweresubjectedtopermanentmiddlecerebralarteryocclusion(MCAO).Sprague-Dawleyrats(n=168)wererandomlydividedintosham-operatedgroup,MCAOgroup,TanⅡAhigherdosegroup(TanⅡA-H)andTanⅡAlowerdosegroup(TanⅡA-L).TanⅡAwasadministeredwithintraperitomealinjectionimmediatelyafteroperation,ratswereexecutedat24h.WesternBlot,RT-PCRandconfocalmicroscopewereusedtomeasureclaudin-5proteinandIgGexpressioninischemicbrain.Andtheneurologicaldeficits,brainwatercontentandinfarctvolumewereexplored.ResultsAt24hafterfocalcerebralischemia,claudin-5expressioninMCAOgroupdecreased.Claudin-5inTanⅡA-Hgroupsignificantlyup-regulated,andalsoitsneurologicdeficit,infarctvolumeandbrainwatercontentwerealleviatedcomparedwithMCAOgroup(P<0.05).ConclusionTanⅡA-Hprotectedblood-brainbarrierpermeabilitybyincreasingclaudin-5,whichmightbethemechanismoftreatingfocalcerebralischemia.
braininfarction;blood-brainbarrier;tanshinone
2014-04-02;
2014-07-07
温雅(1981-),女,河北石家庄人,河北医科大学第二医院主治医师,医学硕士,从事脑血管疾病诊治研究。
R743.33
A
1007-3205(2014)08-0869-04
