1株阿魏酸降解菌的筛选与降解特征研究
2014-09-04马忠友孔维芳李孝良汪建飞肖新马万征邹海明
谢 越,马忠友,孔维芳,李孝良,汪建飞,肖新,马万征,邹海明
(1.安徽科技学院 a.城建与环境学院;b.生命科学学院,安徽 凤阳 233100;2.昆山蓝德环保科技有限公司,江苏 昆山215331)
1株阿魏酸降解菌的筛选与降解特征研究
谢 越1a,马忠友1b,孔维芳2,李孝良1a,汪建飞1a,肖新1a,马万征1a,邹海明1a
(1.安徽科技学院 a.城建与环境学院;b.生命科学学院,安徽 凤阳 233100;2.昆山蓝德环保科技有限公司,江苏 昆山215331)
阿魏酸是导致很多作物产生连作障碍的自毒物质。筛选出1株高效降解阿魏酸的细菌,初步鉴定为葡萄球菌属,命名为AWS4B,研究了AWS4B对阿魏酸的降解特征,探讨了其降解途径。结果表明,当无机盐培养基中阿魏酸的浓度为100 mg/L时,菌株AWS4B 72 h可降解99.97%。降解过程符合一级动力学模型,反应的活化能Ea为19.88 kJ/mol,降解方程常数k0为3.26×10-4,得出了菌株AWS4B降解阿魏酸的预测模型方程。AWS4B降解阿魏酸的底物来源比较广泛。菌株AWS4B对阿魏酸降解的可能途径是非氧化脱羧形成香草醛,再氧化形成香草酸,脱甲基后形成原儿茶酸,最后原儿茶酸苯环裂解后分解为水和二氧化碳,最终实现阿魏酸的降解。
阿魏酸;自毒物质;生物降解;降解特征;途径
阿魏酸是植物的一种化感物质,是造成作物连作障碍的重要因素之一。有研究发现阿魏酸能够强烈抑制幼苗根长度,可溶性糖、可溶性蛋白、叶绿素含量以及植株体内保护酶活性急剧下降,根系中丙二醛含量增加,造成膜的伤害,从而对作物产生自毒作用[1]。正因为土壤环境中的阿魏酸具有的生态毒害作用,关于阿魏酸的研究已经成为农业环境的研究热点之一。对于阿魏酸降解菌的筛选,已有很多学者做了出色的研究工作。王晓辉等[2]筛选出了降解阿魏酸的3株放线菌,用于降解西瓜根系分泌的阿魏酸,甚至发现这些放线菌同时具有拮抗西甜瓜枯萎病的双重功能。陈红歌等[3]发现黄孢原毛平革菌对阿魏酸也有很好的降解作用,该菌与300 mg/L的阿魏酸共培养2 d后,降解率可达99.09%。徐淑霞等[4]的研究结果与之相似,发现将黄孢原毛平革菌施入到连续种植7 a黄瓜的大棚土壤中,阿魏酸在内的其他酚酸的降解率达到54.46%,连作土壤施入阿魏酸降解菌对黄瓜连作障碍的解除具有一定的促进作用。
尽管前人对阿魏酸降解菌进行了深入地研究,然而,关于阿魏酸微生物降解特征尚未明了,尤其是关于阿魏酸降解菌底物广谱性、共代谢特征和降解动力学,以及降解途径等的研究结果鲜见报道。笔者从作物多年连作土壤中,筛选出1株高效降解阿魏酸的菌株,研究其对阿魏酸的降解特征和降解途径,进而揭示该菌株的降解机理,为阿魏酸污染的土壤修复提供环境材料和理论支持。
1 材料与方法
1.1 试验材料
1.1.1 试剂与仪器 Waters 600-2487高效液相色谱仪(美国Waters公司),可变波长紫外检测器。水相针式过滤器,超纯水电阻率为18.2 MΩ·cm-2。Hitachi S-3000N扫描电镜(日立公司),1750型紫外-可见分光光度计。酚酸标准样品:香草酸、香草醛、阿魏酸、原儿茶酸均为分析纯试剂(购自Sigma公司)。甲醇、乙腈为色谱纯(德国Fisher公司),其余试剂均为国产分析纯。
1.1.2 培养基 无机盐培养基:(NH4)2SO42 g/L,KH2PO42 g/L,Na2HPO41.3 g/L,FeCl30.5 mg/L,MgSO47H2O 0.5 g/L,pH7.5,121 ℃蒸汽灭菌30 min,即将冷却时加入阿魏酸100 mg/L,液体培养基不加琼脂。固体培养基:蛋白胨10 g/L,酵母膏 5 g/L,NaCl 10 g/L,pH 7.0,琼脂粉20 g/L,阿魏酸100 mg/L。富集培养基采用无机盐培养基中加入蛋白胨2 g/L,用于菌剂的平板培养和斜面保存。
1.2 试验方法
1.2.1 阿魏酸降解菌筛选 采集连作土壤,采用一次性投加高浓度化合物的驯化方法[5],从中分离出阿魏酸降解菌,然后逐步减少外加碳源浓度进行驯化,得到能够以阿魏酸为唯一碳源和能源生长的菌液。经过反复平板涂布,待菌落长好,选取不同形态的单菌落,重新转至含有100 mg/L阿魏酸的MSM液体培养基中,30 ℃、150 r/min摇床中振荡培养,选择培养液变浑浊的三角瓶,纯化培养3次,低温冷藏备用。
1.2.2 菌株生理生化特性及其鉴定 菌株接种到无机盐培养基上,30 ℃、150 r/min振荡培养72 h,高速离心后,弃上清液后加入超纯水振荡混匀,再次离心,重复3次,收集菌体,冷藏备用。生理生化指标检测与鉴定参照《伯杰细菌鉴定手册》[6]、《常见细菌系统鉴定手册》[7]和《微生物实验手册》[8]中方法。采用平板稀释涂布法测定培养液中活细菌的数量,每个样品设置3个重复。
阿魏酸降解菌的鉴定采用革兰氏染色、形态学观察和16S rDNA序列分析等方法。采用16S rDNA-F(5′-AGAGTTTGATCCTGGCTCAG-3′)和16S rDNA-R(5′-ACGGCTACCTTGTTACGACTT-3′)扩增筛选的16S rDNA片段。PCR反应条件如下:95 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,共30个循环,最后4 ℃保存。PCR产物纯化测序由金斯瑞生物科技有限公司完成。测序结果利用Genbank上的Blast软件进行同源性比较,再用Mega软件构建系统进化树。
1.2.3 阿魏酸降解效能的测定 加入菌株悬液至100 mL无机盐液体培养基中(下同),使得250 mL三角瓶中细胞初始浓度为1.4×107CFU/mL(下同)。加入阿魏酸溶液,浓度为100 mg/L,30℃、150 r/min摇床中振荡培养,1、6、12、18、24、36、48、60、72 h测定培养基中阿魏酸浓度和细胞数量。
1.2.4 降解动力学研究 在无机盐培养基中添加阿魏酸,浓度为100 mg/L,调节三角瓶溶液中pH为7.0、35 ℃、150 r/min摇床中振荡培养,分别在1、3、6、9、12、24 h后取样,测定其中阿魏酸的残留率,然后按照一级动力学模型拟合。设置20、30、40 ℃ 3个不同试验温度,接菌后1 h后取样测定培养基中阿魏酸的浓度,计算残留率。
1.2.5 底物广谱性试验 在无机盐培养基中分别单独添加葡萄糖、乙酸、香草酸、香草醛、原儿茶酸、苯甲酸、水杨酸和甲苯,每种成分在培养基中的浓度处理分别为25、50、100、200 mg/L 4个浓度梯度,再添加菌株AWS4B,30℃振荡培养72 h,测定OD600值。
1.2.6 共代谢底物试验 在含有100 mg/L阿魏酸的无机盐培养基中分别单独添加葡萄糖、香草酸、香草醛、原儿茶酸、苯甲酸和水杨酸,每种共代谢底物的浓度均为50 mg/L,再接种菌株AWS4B,分别在1、3、6、9、12、18、24 h后测定其中阿魏酸的残留率。
1.2.7 阿魏酸残留率的计算 文中阿魏酸残留率的计算公式为
残留率=C/C0×100%
(1)
式中:C为t时刻阿魏酸的浓度,mg/L;C0为初始阿魏酸的浓度,mg/L。
1.2.8 阿魏酸及降解中间产物的测定 培养液经10 000 rpm离心后,上清液微孔滤膜过滤后,采用高效液相色谱法测定,色谱条件参照谢越等人的分析方法[9],即色谱柱为Symmetry C184.6×250 mm,填料直径为5 μm,柱温25 ℃,检测波长280 nm,流速为1.0 mL/min,进样量20 μL,A、B双泵系统,A 为乙腈,B为0.02 mol/L 磷酸盐缓冲溶液(通过冰醋酸调至pH 2.8)。梯度洗脱条件:0~10 min,5% A;10~25 min,15% A;25~35 min,40% A;35~40 min,35% A;40~45 min,5% A。
2 结果与分析
2.1 阿魏酸高效降解菌鉴定
将降解菌驯化、分离纯化后,得到1株能降解阿魏酸的细菌,命名为AWS4B。通过平板观察,该细菌生长相对缓慢,菌落呈金黄色,圆形,直径2~3 mm,外形光滑湿润,隆起,边缘不整齐,易用接种环挑起。经戊二醛固定、干燥、离子溅射金后,在扫描电子显微镜下观察,发现菌株为无芽孢杆菌,大小为(0.5~1.0)μm×(1.5~2.0)μm,无鞭毛。革兰氏染色阳性,化能异养菌,好氧或兼性厌氧,其余生理生化性能见表1。
根据该菌株的形态和生理生化反应特征,对照《伯杰细菌鉴定手册》(第九版)[6],初步鉴定AWS4B为葡萄球菌属(Staphylococcussp.)。系统进化树结果(图1)表明,AWS4B与Staphylococcussapro-phyticus(NR-041324)具有99%的同源性,结合形态学和生理生化结果,将AWS4B鉴定为葡萄球菌属细菌。

表1 菌株AWS4B的生理生化指标检测
注:+为阳性反应;-为阴性反应。
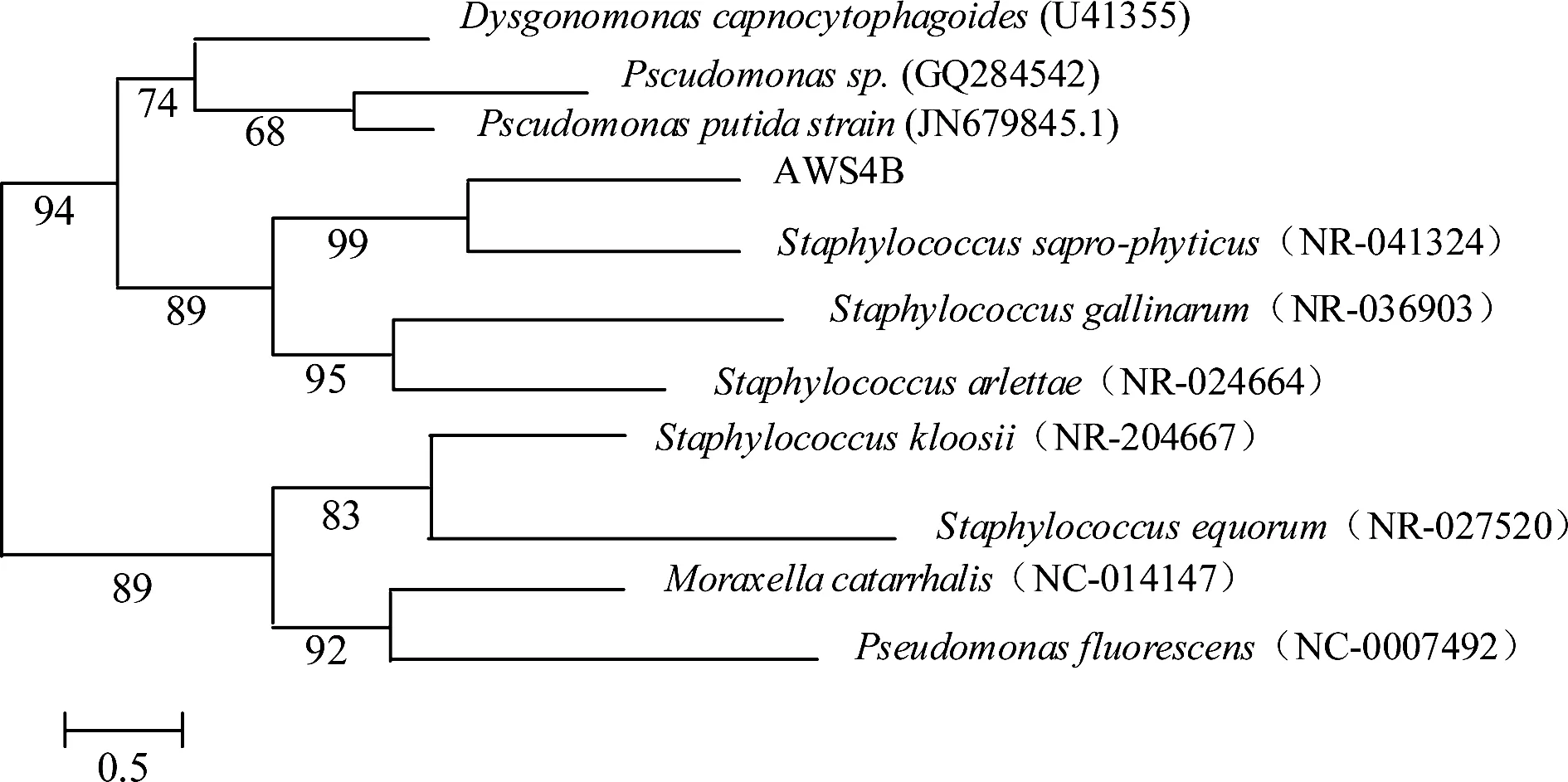
图1 菌株AWS4B基于16S rDNA系统发育分析
2.2 菌株AWS4B对阿魏酸的降解效能
菌株AWS4B可以利用阿魏酸为唯一碳源和能源生长,其对阿魏酸的降解效能见图2,从图中可以发现,在阿魏酸初始浓度为100 mg/L条件下,菌株AWS4B在12 h时,降解了14.86%,然后降解速率迅速增加,24 h时已降解77.32%, 此后降解速率缓慢下降,至48 h时,残留率已达98.91%,至72 h时,已达99.97%,由此可见,菌株AWS4B在48 h之内基本上可以将阿魏酸降解完毕。与之相呼应,菌株AWS4B的密度也随着阿魏酸的残留率的降低而呈现相反的变化趋势,在试验开始的前6 h内,菌体密度基本维持在107CFU/mL范围内,随着阿魏酸残留率的减少,菌株AWS4B菌体密度急剧增加,36 h后菌体密度已超过108CFU/mL,72 h时已接近109CFU/mL。阿魏酸残留率的迅速降低伴随着菌体密度的同步增加,这说明AWS4B菌株对阿魏酸具有高效降解能力。
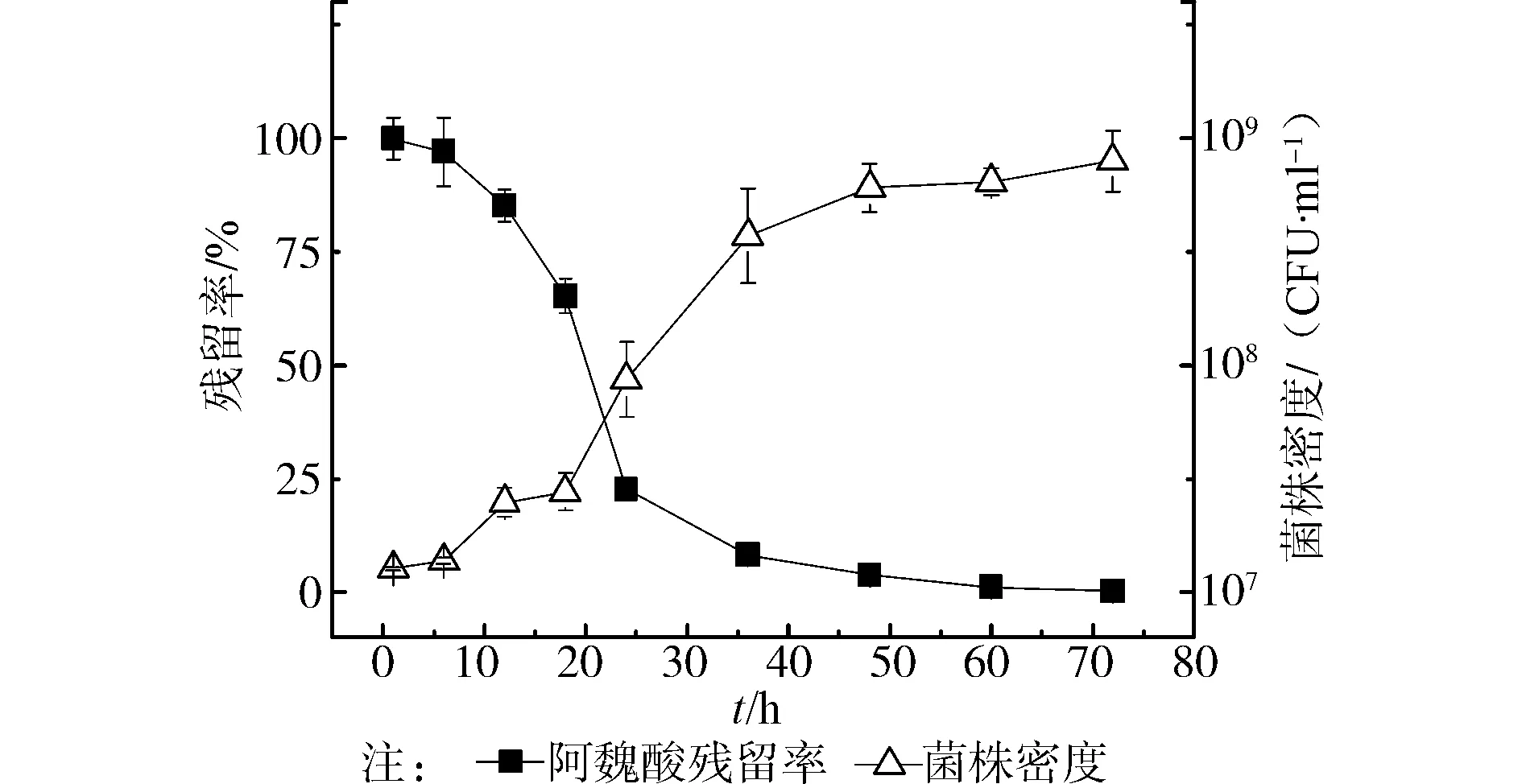
图2 以阿魏酸为唯一碳源菌株AWS4B的生长和阿魏酸降解曲线
2.3 菌株AWS4B对阿魏酸降解动力学
以接菌后1 h为起始值,以阿魏酸残留率对数的负值-ln(C/C0)(C0为初始阿魏酸的浓度,C为t时刻阿魏酸浓度)对培养时间t作图(见图3)。分别进行线性回归,得到回归方程及相关系数。研究结果发现在3个不同温度下降解动力学方程具有良好相关性,其拟合相关系数R2分别为0.990 4、0.995 1和0.990 8,因此,可以判断菌株AWS4B对阿魏酸降解过程符合动力学模型中的指数模型,属于一级反应,按照一级动力学方程[10]
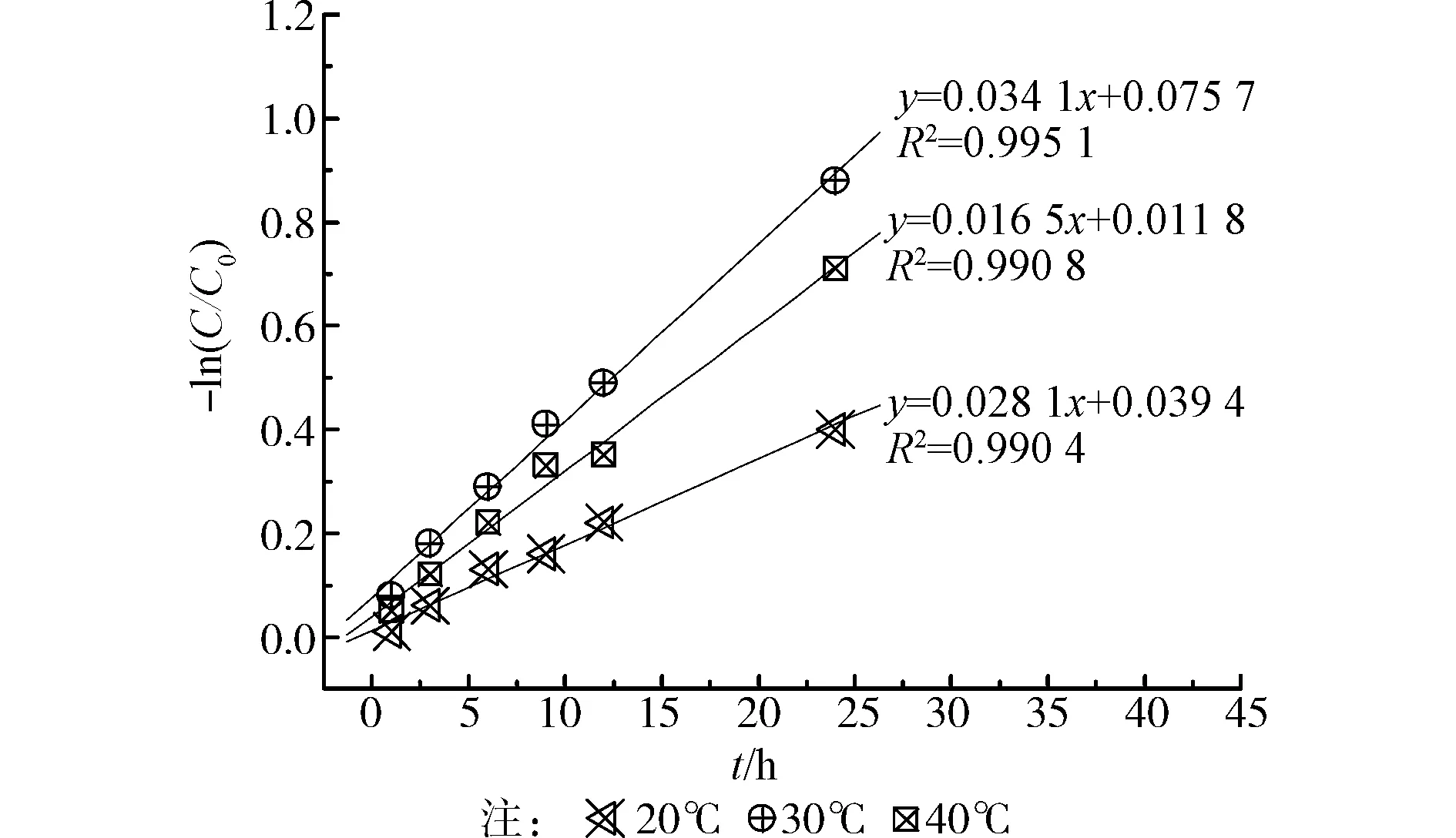
图3 菌株AWS4B对阿魏酸的降解动力学
-d[Q]/dt=k[Q]n
(2)
ln[Q]=-kt+ln[Q0]
(3)
式中:[Q0]为阿魏酸的初始浓度。
阿仑乌斯(Arrheius)认为反应的速率常数k与反应温度T之间存在以下关系:
k=k0×exp(-Ea/RT)
(4)
式中:k0为方程常数;Ea为反应活化能,kJ/mol;R为气体常数,8.314 J/(mol·K);T为绝对温度,K。
根据式(2)和(4)推导并积分可得到
[Q]=k0×exp(-Ea/RT)×t
(5)
由式(2)可以得到不同温度下的降解反应常数k,然后,再根据不同温度下的k值,用lnk对1/T作线性回归,通过式(4)得到直线的斜率为-Ea/R,截距为lnk0,再由直线的斜率就可以求出活化能Ea,具体动力学参数见表2。

表2 菌株AWS4B降解阿魏酸动力学参数
将式(5)变形为
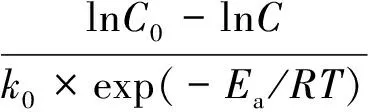
(6)
将活化能Ea=19.88 kJ/mol,常数k0=3.26×10-4和R=8.314 J/(mol·K)代入式(6)得到
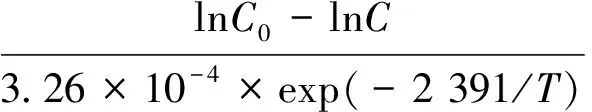
(7)
式(7)即为菌株AWS4B降解阿魏酸的预测模型。
2.4 菌株AWS4B底物广谱性试验
在无机盐培养基中分别单独添加不同的有机物作为菌株AWS4B的唯一碳源,振荡培养72 h,菌株AWS4B在不同底物OD600值见表3。从表中可以发现,在选用的各种底物中,菌株AWS4B除了不能在甲苯和乙酸中生长外,均能利用其余6种底物作为唯一碳源和能源。其中在葡萄糖、香草酸、香草醛、原儿茶酸和苯甲酸这些底物培养中,在4个浓度梯度中能够良好生长,各浓度之间没有明显区别。菌株AWS4B在利用水杨酸这种底物时,在200 mg/L处理浓度条件下菌液OD600值明显比25 mg/L下降较多,这可能是由于菌株AWS4B不能适应这种底物的高浓度条件,生长状况下降导致的。而菌株AWS4B在苯甲酸在4个浓度梯度中,似乎适应较好,甚至在200 mg/L的高浓度时,OD600值明显上升。菌株AWS4B能够分别以葡萄糖、香草酸、香草醛、原儿茶酸和苯甲酸这6种底物作为唯一碳源和能源,这说明AWS4B底物的来源具有一定的广谱性。
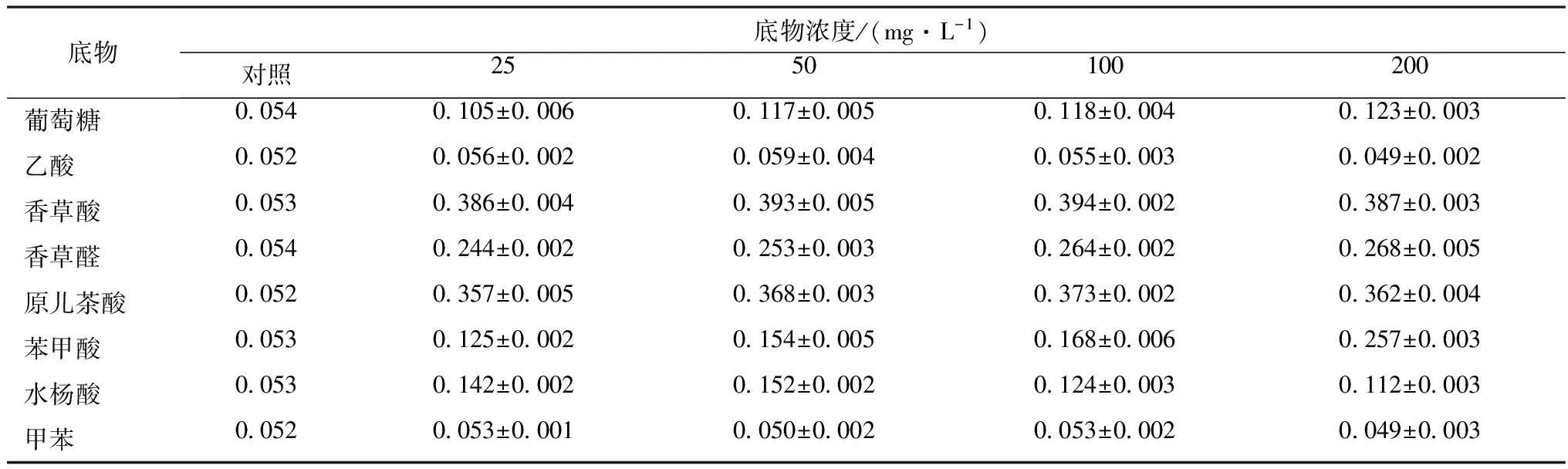
表3 菌株AWS4B在不同底物处理中的OD600值
2.5 不同共代谢底物对降解效果的影响
如图4所示,研究发现分别单独加入葡萄糖、苯甲酸、水杨酸3种底物后,对菌株AWS4B降解阿魏酸几乎没有任何明显影响,和对照组相似,基本上都能够在25 min内完成阿魏酸的降解,这说明菌株AWS4B在降解阿魏酸的同时,可以分别共代谢葡萄糖、苯甲酸、水杨酸3种底物。然而,在单独加入香草醛、香草酸和原儿茶酸3种底物后,在相同的时间内,阿魏酸的残留率均明显高于对照以及单独添加葡萄糖、苯甲酸和水杨酸3种底物的处理,这说明分别单独添加香草醛、香草酸和原儿茶酸3种底物,在一定程度抑制了菌株AWS4B对阿魏酸的降解。
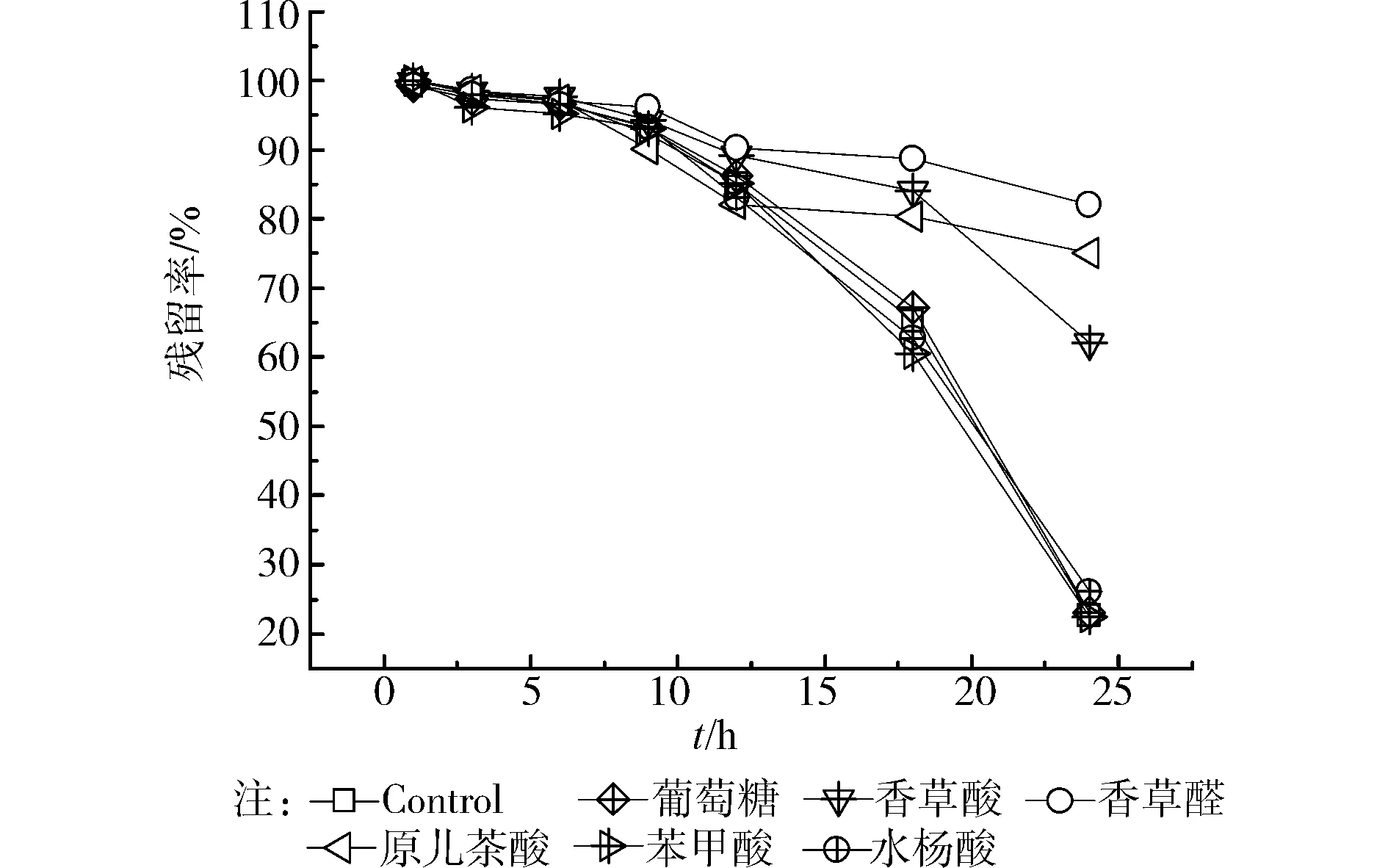
图4 不同共代谢底物对阿魏酸降解的影响
2.6 菌株AWS4B对阿魏酸的降解途径
前面的试验结果显示,菌株AWS4B既能够利用香草醛、香草酸和原儿茶酸作为唯一碳源和能源,但在共代谢过程中又会对阿魏酸的降解产生抑制作用。众所周知,当往化学反应中添加反应产物时,会产生抑制该反应的正向进行,因此,有理由推测共代谢中抑制阿魏酸降解的原因,有一种可能是由于在菌株AWS4B降解阿魏酸的过程中,产生了香草醛、香草酸和原儿茶酸这3种中间代谢产物。为了验证这个假设,试验分析了培养12 h后的样品中的成分,并与标准样品对照,通过保留时间进行定性分析,结果见图5,发现培养12 h后的样品中除了尚未降解的阿魏酸之外,还存在香草醛、香草酸和原儿茶酸这3种物质,而对照样品中只发现阿魏酸的存在,这说明上述3种物质的确是阿魏酸在被菌株AWS4B降解过程中产生的中间代谢物质。
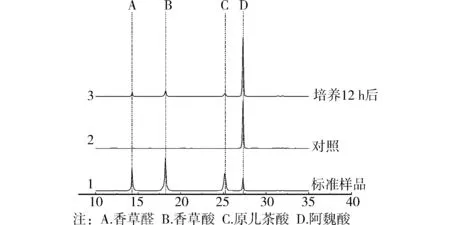
图5 菌株AWS4B降解阿魏酸中间产物的高效液相色谱分析
文献报道微生物降解阿魏酸有7类途径[11],其中之一是阿魏酸可以非氧化脱羧形成4-乙烯基愈创木酚,然后可形成香草醛,氧化后形成香草酸。茄病链孢[12]、宛氏拟青霉[13]和凝结芽孢杆菌[14]就是通过这条路径降解阿魏酸的。产生的香草酸会继续降解,其降解途径又可分为4类,其中一类降解方式是香草酸脱甲基后形成原儿茶酸,然后原儿茶酸通过苯环裂解最终分解为水和二氧化碳。假单胞菌菌株HR199[15]、恶臭假单胞菌[16]和一些放线菌[17]就能通过该途径降解香草酸。综上所述,综合各种降解阿魏酸的路径,再结合试验结果,推断菌株AWS4B是通过非氧化脱羧形成香草醛,再氧化形成香草酸,脱甲基后形成原儿茶酸,最后原儿茶酸苯环裂解后分解为水和二氧化碳,最终实现阿魏酸的降解。
3 结论
1)从连作土壤中分离得到1株高效降解阿魏酸的细菌,命名为AWS4B,鉴定为葡萄球菌属细菌。该菌可以利用阿魏酸作为唯一碳源和能源,摇瓶培养72 h,99.97%的阿魏酸可被降解。
2)菌株AWS4B对阿魏酸的降解符合一级动力学模型,反应的活化能Ea为19.88 kJ/mol,降解方程常数k0为3.26×10-4。
3)菌株AWS4B能够利用葡萄糖、香草酸、香草醛、原儿茶酸、苯甲酸和水杨酸在内的6种底物作为唯一碳源,底物来源具有一定程度的广谱性。在100 mg/L阿魏酸存在的情况下,香草醛、香草酸和原儿茶酸3种共代谢底物对菌株AWS4B有抑制作用。
4)菌株AWS4B对阿魏酸可能的降解途径是通过非氧化脱羧形成香草醛,再氧化形成香草酸,脱甲基后形成原儿茶酸,最后原儿茶酸苯环裂解后分解为水和二氧化碳,最终实现阿魏酸的降解。
[1] 谢越,肖新,周毅,等.5种酚酸物质对滁菊扦插幼苗生长及酶活性的影响[J].南京农业大学学报,2012,35(6):19-24.
Xie Y,Xiao X,Zhou Y,et al.Effects of five phenolic allelochemicals on growth and enzymes activity of Chuzhou chrysanthemum cutting seedling [J].Journal of Nanjing Agricultural University,2012,35(6):19-24.
[2] 王晓辉,薛泉宏.阿魏酸降解放线菌的筛选及其降解与拮抗效果研究[J].西北农林科技大学学报:自然科学版,2011,39(12):153-158.
Wang X H,Xue Q H.Screening of ferulic acid degrading actinomycetes and their degradation and inhaibiting effect [J].Journal of Northwest A & F University:Natural Science Edition,2011,39(12):153-158.
[3] 陈红歌,杜国营,胡元森,等.黄孢原毛平革菌(Phanerochaetechrysosporium)对3种酚酸物质的降解作用[J].安全与环境学报,2006,6(5):8-10.
Chen H G,Du G Y,Hu Y S,et al.On degradation of three phenolic acids byPhanerochaetechrysosporium[J].Journal of Safety and Environment,2006,6(5):8-10.
[4] 徐淑霞,张世敏,尤晓颜,等.黄孢原毛平革菌对黄瓜连作土壤酚酸物质的降解[J].应用生态学报,2008,19(11):2480-2484.
Xu S X,Zhang S M,You X Y,et al.Degradation of soil phenolic acids byPhanerochaetechrysosporiumunder continuous cropping of cucumber [J].Chinese Journal of Applied Ecology,2008,19(11):2480-2484.
[5] 徐志伟,陈红.驯化的西湖底泥还原腐殖质影响因素研究[J].浙江大学学报:工学版,2010,44(2):349-352.
Xu Z W,Chen H.Influence factors of humus reduction by acclimated sediments of West Lake [J].Journal of Zhejiang University:Engineering Science,2010,44(2):349-352.
[6] Buchanan R E,Gibbons N E.Bergey’s manual of determinative bacteriology [M]. 9th edition.Williams & Wilkins,1994.
[7] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[8] 周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986.
[9] 谢越,俞浩,汪建飞,等.高效液相色谱法同时测定滁菊样品中的9种酚酸[J].分析化学,2013,41(3):383-388.
Xie Y,Yu H,Wang J F,et al.Simultaneous determination of nine phenolic acids in dendranthema morifolium(ramat)tzvel.cv.chuju samples by high performance liquid chromatography [J].Chinese Journal of Analytical Chemistry,2013,41(3):383-388.
[10] 王志龙,刘书亮,姚开,等.一株氯氰菊酯降解真菌的筛选鉴定及其降解特性研究[J].环境科学学报,2013,33(6):1561-1569.
Wang Z L,Liu S L,Yao K,et al.Isolation and identification of a cypermethrin degrading fungus and its degradation characteristics [J].Acta Scientiae Circumstantiae,2013,33(6):1561-1569.
[11] 李永红,郑璞,孙志浩.生物技术方法生产香草醛研究进展[J].工业微生物,2004,34(4):46-57.
Li Y H,Zheng P,Sun Z H.Recent advances in biotechnological production of vanillin [J].Industrial Microbiology,2004,34(4):46-57.
[12] Nazareth S,Mavinkurve S.Degradation of ferulic acid via 4-vinylguaiacol byFusariumsolani(Mart.)Sacc [J].Canadian Journal of Microbiology,2011,32(6):494-497.
[13] Mohammed R,Françoise S M,Régine S,et al.Metabolism of ferulic acid byPaecilomycesvariotiiandpestalotiapalmarum[J].Applied and Environmental Microbiology,2011,55(9):2391-2398.
[14] Karmakar B,Vohra R M,Nandanwar H,et al.Rapid degradation of ferulic acid via 4-vinylguaiacol and vanillin by a newly isolated strain of bacillus coagulans [J].Journal of Biotechnology,2000,80(3):195-202.
[15] Priefert H,Rabenhorst J,Steinbüchel A.Molecular characterization of genes ofPseudomonassp.strain HR199 involved in bioconversion of vanillin to protocatechuate [J].Journal of Bacteriology,2011,179(8):2595-2607.
[16] Venturi V,Zennaro F,Degrassi G,et al.Genetics of ferulic acid bioconversion to protocatechuic acid in plant-growth-promotingPseudomonasputidaWCS358 [J].Microbiology,1998,144(4):965-973.
[17] Crawford R L,Mccoy E,Harkin J M,et al.Degradation of methoxylated benzoic acids by aNocardiafrom a lignin-rich environment:significance to lignin degradation and effect of chloro substituents [J].Applied Microbiology,1973,26(2):176-184.
(编辑 王秀玲)
FerulicAcidDegradationBacteriumAWS4BScreeningandItsDegradationCharacteristics
XieYue1a,MaZhongyou1b,KongWeifang2,LiXiaoliang1a,WangJianfei1a,XiaoXin1a,MaWanzheng1a,ZouHaiming1a
(1a. College of Urban Construction and Environment; 1b. College of Life Sciences, Anhui Science and Technology University,Fengyang 233100, Anhui, P. R. China; 2. Kunshan Land Environment Protection Technology, Kunshan 215331, Jiangsu, P. R. China)
Ferulic acid(FA)was one of important auto-toxic chemicals leading to continuous cropping obstacle for many crops. A bacterium strain AWS4B was screened out and identified preliminarily as Staphylococcus sp.,named as AWS4B. The degradation characteristics was studied and the pathway of the degradation was discussed. The results showed that the degradation rate reached 99.97% in 72 h when the initial FA concentration in the inorganic salt urbane liquor was 100 mg/L. The degradation of FA followed first-order reaction kinetics model and the thermal degradation activation energy was 19.88 kJ/molThe rate constant(k0)was 3.26×10-4and equation for strain AWS4B prediction model was proposed in this paper. Many compounds provide strain AWS4B with carbon and enery. The influence of different nutrient substrates added in the degradation experiments was also investigated. Degradation pathway was likely to be that FA was degraded into Vanillin, Vanillic acid and protocatechuic acid through non-oxidative decarboxylation, oxidation and demethylation.The protocatechuic acid was depredated through benzene ring cleavage and water and carbon dioxide were produced finally and FA was degraded by strain AWS4B.
Ferulic acid; auto-toxic chemical; biodegradation; degradation characteristics; pathway
10.11835/j.issn.1674-4764.2014.06.018
2014-05-20
国家自然科学基金(31101598);安徽科技学院引进人才项目(ZRC2012320);安徽省高校省级自然科学研究重点项目(KJ2012A067、KJ2012Z068);安徽省高校自然基金(KJ2013Z056)
谢 越(1980-),男,博士,主要从事农业环境生态研究,(E-mail)xiey@ahstu.edu.cn。
X172
A
1674-4764(2014)06-0106-06
