新加达原散体外延缓铜绿假单胞菌耐药的实验研究*
2014-09-04畅李宛珊孙路路潘健蓝海涛
刘 畅李宛珊孙路路潘 健蓝海涛
赵 昕1付 征1远 庚1何 龙1齐文升1△
(1.中国中医科学院广安门医院,北京 100053;2.安徽省蚌埠市第一人民医院,安徽 蚌埠 001001)
·研究报告·
新加达原散体外延缓铜绿假单胞菌耐药的实验研究*
刘 畅1李宛珊1孙路路2潘 健1蓝海涛1
赵 昕1付 征1远 庚1何 龙1齐文升1△
(1.中国中医科学院广安门医院,北京 100053;2.安徽省蚌埠市第一人民医院,安徽 蚌埠 001001)
目的 探讨新加达原散体外延缓铜绿假单胞菌耐药的作用。方法 应用血清药理学方法制备新加达原散含药血清,模拟中药口服吸收后的实际成分。采用含药血清混合肉汤培养基培养铜绿假单胞菌ATCC27853,同时以低浓度左氧氟沙星诱导铜绿假单胞菌耐药,对照组采用空白大鼠血清处理,同时设立不含血清的单纯抗生素诱导组以除外血清本身的作用。即分为含药血清组、空白血清组和空白对照组。随后进行传代培养,观察每一代细菌生长及出现耐药的情况,直至某一组产生细菌耐药现象,纸片法测定3组细菌耐药情况的差异,并测量每组的MIC值。结果 在体外诱导耐药的过程中,诱导至第6代,空白血清组和空白对照组产生耐药,诱导至第10代,含药血清组产生耐药。结论 新加达原散含药血清体外可以延缓铜绿假单胞菌对左氧氟沙星耐药性的产生。
新加达原散 铜绿假单胞菌 细菌耐药
随着临床上广谱抗生素的广泛使用,细菌耐药现象日益严重。铜绿假单胞菌感染的发病率、病死率处于较高水平,并且对超广谱抗生素的敏感性不断在下降[1]。多药耐药成了铜绿假单胞菌感染的一个严重问题,近年来更是出现了对除了多粘菌素外的所有抗假单胞菌的抗生素同时耐药的菌株,即泛耐药铜绿假单胞菌。除多粘菌素外目前市面上有售的抗生素对其完全无效,患者一旦感染,往往使临床医师束手无策,病死率极高,造成极其严重的后果[2-3]。中药在抑制细菌耐药方面取得了不少成果,主要是在单味药和中药单体的研究上较多。笔者临床应用新加达原散联合抗生素治疗耐药菌感染取得良好效果。本实验以基于伏邪理论的清透法为处方原理,以新加达原散制成含药血清,进行含药血清对铜绿假单胞菌耐药的体外实验研究,现报告如下。
1 实验材料
1.1 动物 SD大鼠100只,清洁级,体质量(200±20)g,雌雄各半,购于中国食品药品检定研究院,合格证号:SCXK(京)2009-0017,在中国中医科学院广安门医院动物房喂养。正常光照条件下,食、水自由摄取,室温控制在18~22℃。
1.2 菌株 铜绿假单胞菌标准菌株ATCC27853(中国中医科学院广安门医院检验科微生物室保存)。
1.3 药物 新加达原散(青黛、草果、黄芩、蝉衣、柴胡等),由中国中医科学院广安门医院药剂科提供,配制成含生药2 g/mL的煎剂,放置于4℃冰箱保存备用。为保证不同批次中药汤剂有效成分的一致性,由笔者所在医院药剂科对每批煎剂样本进行指纹图谱分析比照,保证中药煎剂的一致性。盐酸左氧氟沙星氯化钠注射液(扬子江药业集团有限公司,国药准字H20066291,100 mL,0.3 g)。
1.4 试剂与设备 左旋氧氟沙星药敏纸片(药敏纸片购自Oxoid公司,规格:直径6mm,每片吸水量约20μL,5 μg/片);M-H肉汤;M-H培养皿;营养琼脂沉降菌培养皿(NA)。全自动微生物分析系统;加样器;超净工作台;离心机;水浴锅;温箱;光电比浊仪;标准比浊管;96孔细胞培养板;加样器;吸头;止血钳;手术剪;采血针;采血管;游标卡尺等。
2 方 法
2.1 含药血清制备 将大鼠随机分为2.5倍等效剂量灌胃组、空白对照组两组。适应性喂养3 d后,分别予中药或注射用水灌胃。2.5倍等效剂量组根据标准体质量成人每日用量折算为5 g/d[4],将原液稀释成1.25 g/mL,每日灌胃4 mL,分早晚两次灌入;空白对照组以相同体积注射用水灌胃,共5 d,末次灌胃前12 h禁食,末次灌胃后1 h腹主动脉无菌采血针取血[5]。取血1 h分层后,采血管于4℃恒温冰箱放置1 h,然后离心机中3000 r/min离心15 min,取上层清液,同组血清分别混匀后,分装于1 mL EP管中,置于-80℃冰箱保存备用。
2.2 营养肉汤制备 称取37 g肉汤粉溶于1 L蒸馏水中,加热至煮沸使其完全溶解,再用121℃、15 min高压灭菌,将肉汤分装于试管中,置于4℃冰箱无菌备用。
2.3 菌液制备 将铜绿假单胞菌ATCC27853接种于血培养平皿中,35℃温箱孵育18~24 h,次日以无菌接种环取少量菌落于适量生理盐水中,用比浊仪对照后,调整菌液浓度至1×108CFU/mL(0.5麦氏单位),置于4℃冰箱保存备用。
2.4 盐酸左氧氟沙星对铜绿假单胞菌ATCC27853的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定在无菌条件下,用微量加样器精确移取盐酸左氧氟沙星注射液500 μL与灭菌注射用水671.875 μL混合稀释至1280 μg/mL。在96孔板选取12孔,第1孔中加入上述稀释后的左氧氟沙星溶液20 μL和营养肉汤180 μL,第2到第12孔中每孔加入100 μL营养肉汤。以加样器混匀后由第1孔吸取100 μL混匀液至下一孔,继续混匀进行2倍系列稀释至第10孔,剩余混匀液弃去,使各孔左氧氟沙星最终质量浓度为128、64、 32、16、8、4、2、1、0.5、0.25、0.125、0.0625 μg/mL,前11孔每孔分别加入配制好的菌液10 μL,第11孔作为阳性对照,第12孔作为阴性对照。以上操作后,放入35℃温箱培养18~24 h后取出,以小孔内完全抑制细菌生长的最低药物浓度为该抗菌药物对铜绿假单胞菌的MIC值。测得MIC值后,在MIC浓度上下几个稀释度都取培养液接种到培养基上,隔夜培养18~24 h后观察是否有细菌生长,没有细菌生长的最大药物浓度为盐酸左氧氟沙星对铜绿假单胞菌ATCC27853的MBC值。
2.5 K-B法对左氧氟沙星药敏纸片对铜绿假单胞菌ATCC27853的抑菌环直径的测定 采用纸片扩散法(K-B法),将0.5麦氏单位铜绿假单胞菌ATCC27853菌液密涂于4 mm厚的M-H培养皿上,中间贴左氧氟沙星药敏纸片,35℃温箱培养18~24 h后游标卡尺量取抑菌环直径。
2.6 低浓度盐酸左氧氟沙星体外传代诱导耐药的测定 实验分为以下3组。含药血清组:含药血清+1/2 MIC浓度左氧氟沙星溶液+肉汤培养基+PA ATCC27853菌悬液。空白血清组:空白血清+1/2MIC浓度左氧氟沙星溶液+肉汤培养基+PA ATCC27853菌悬液。空白对照组:1/2MIC浓度左氧氟沙星溶液+肉汤培养基+PA ATCC27853菌悬液。
每组中每孔盐酸左氧氟沙星最终质量浓度为1 μg/mL,血清添加量选择为整个反应体系的20%,分别将0.5麦氏浊度的铜绿假单胞菌ATCC27853菌液10 μL接种于每孔中,培养18~24 h为1代后,分别由各孔中取适量菌液比浊后配制成0.5麦氏单位,分别接种于同组的第2孔中,记为第2代,如此重复传代,并用传代后的细菌做诱导耐药实验及K-B法测左氧氟沙星药敏纸片对上一代细菌的抑菌环直径,用肉汤稀释法测左氧氟沙星对上一代细菌的MIC值,待抑菌直径判断为耐药,且诱导后的MIC值≥4倍诱导前的MIC值,判断诱导耐药成功。将判断为诱导成功的耐药菌株继续传3代,每代均用K-B法检测左氧氟沙星药敏纸片的抑菌环直径,确定耐药菌株的稳定性,比较3组出现耐药的先后顺序及MIC值。
2.7 药物敏感性标准判定 根据2009年临床实验室标准化研究室(CLSI)的执行标准[6]判读:左氧氟沙星MIC≥8 μg/mL为耐药(R),4 μg/mL为中介(I),≤2 μg/mL为敏感(S);药敏纸片含5 μg药物,抑菌直径≤13 mm为耐药(R),14~16 mm为中介(I),≥17 mm为敏感(S)。
3 结 果
3.1 左氧氟沙星对铜绿假单胞菌 ATCC27853的MIC、MBC值和抑菌圈直径 倍比稀释法测得盐酸左氧氟沙星氯化钠注射液对铜绿假单胞菌ATCC27853的MIC值为2 μg/mL,MBC值为4 μg/mL;K-B法测定左氧氟沙星药敏纸片对铜绿假单胞菌ATCC27853的抑菌圈直径为24 mm。
3.2 低浓度盐酸左氧氟沙星体外诱导铜绿假单胞菌ATCC27853耐药的结果 在低浓度盐酸左氧氟沙星体外传代诱导铜绿假单胞菌耐药的过程中,观察每代铜绿假单胞菌菌株的生长状态,含药血清组肉眼可见细菌生长量明显少于空白血清组和空白对照组;诱导至第6代,含药血清组抑菌圈直径(20.08±0.55)mm,空白血清组抑菌圈直径(11.58±0.71)mm,空白对照组抑菌圈直径(11.25±0.79)mm,空白血清组、空白对照组菌株抑菌环直径<13.00 mm,MIC值为16 μg/mL,对左氧氟沙星产生耐药,而含药血清组耐药性弱于空白血清、空白对照两组;诱导至第10代,含药血清组抑菌圈直径(12.07±0.35)mm,MIC值为16 μg/mL,对左氧氟沙星产生耐药。提示新加达原散具有延缓低浓度左氧氟沙星环境下铜绿假单胞菌耐药性产生的作用。见表1,表2。

表1 肉眼观察PA ATCC27853各组传代细菌生长情况结果
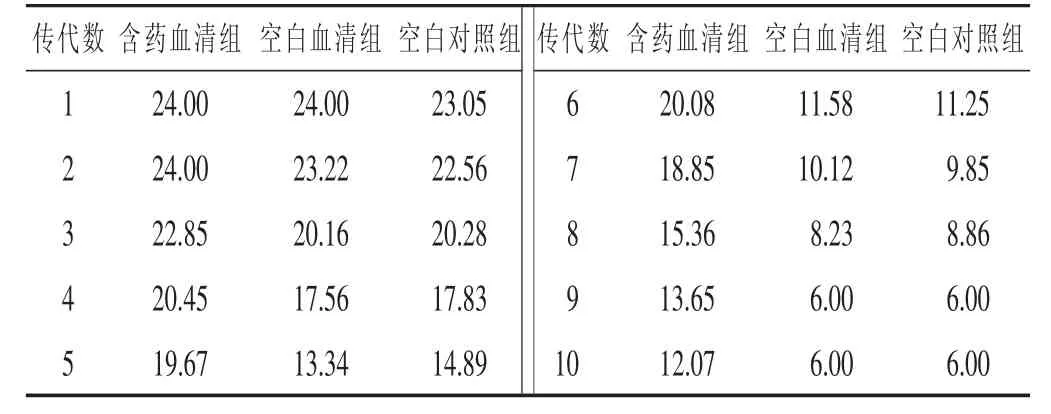
表2 PA ATCC27853传代各组平均抑菌圈直径(mm)
4 讨 论
铜绿假单胞菌是院内获得性感染的重要条件致病菌,可以引起严重的、甚至致死性的感染。随着耐药菌不断出现,对现有抗生素不断耐药,研发新型抗生素不仅需要大量资金投入,同时需要很长的研发时间,而细菌耐药菌株的出现却日新月异,远远超过抗生素研发周期。目前从抗生素的不断升级、种类的更新,到剂量增加、多类联合,仍不能很好地控制耐药菌感染,而对于耐药菌的定植,则无从治疗[7]。铜绿假单胞菌对抗生素的耐药是由多因素造成的。细菌产生灭活酶;细菌改变药物作用的靶位结构;细菌细胞膜的通透性降低;主动外排作用;代谢途径的改变之间可以发生协同作用;生物膜铜绿假单胞菌耐药机制也是近年来的研究重点和热点[8-9]。铜绿假单胞菌对不同抗生素的耐药机制也不完全相同,可能还不断有新的耐药机制出现。因此临床上铜绿假单胞菌出现多重耐药、交叉耐药的现象亟待解决。由抗生素应用引起的耐药性问题,促使国内外医药界把注意力转向具有抗菌活性的中草药,不少研究显示中药不但具有抗菌活性,中药复方的使用能加强抗菌活性甚至具有逆转细菌耐药的作用[10]。
中药在抑制细菌耐药方面有不少实验报道。张淑文等[11-16]总结若干中药对耐药菌干预作用的研究,筛选出多种具有抑制细菌耐药性的中药组成复方清热颗粒,并将其验证于实验及临床,效果颇著。刘清泉等[17-20]也做过类似的研究,其根据中医伏邪理论提出扶正透邪温阳是中医药治疗耐药菌感染的治则,在耐药菌感染治疗上应用抗生素联合扶正透邪方,临床上取得良好的效果,并且在体内体外耐药菌实验及分子生物学实验中证实中药对细菌耐药性的良性干预作用。
笔者在临床观察和治疗耐药菌感染中发现耐药菌感染符合伏邪致病的特点,治疗伏邪温病,不可过用苦寒,当以清透为主,据此建立了以清透法为制方原理的新加达原散,联合抗生素治疗耐药菌感染,在临床治疗中收效颇著。本实验体外诱导耐药模型的方法为低浓度抗生素微量肉汤稀释传代诱导法。实验结果显示含药血清组出现耐药的时间较空白血清组和空白对照组晚,提示在诱导剂左氧氟沙星的作用下,含药血清的加入干预了铜绿假单胞菌的耐药性,在一定程度上延缓铜绿假单胞菌出现耐药的时间。该实验最大限度地模拟了中西药结合治疗细菌感染的体内状态。
耐药菌感染患者多表现正气亏虚,易受外邪侵袭,若治不得法,过用寒凉药物、过早使用下法等,会导致邪气不除,渐行入里,伏藏于内,伏久郁而化热,遇时而发。故邪气潜伏,必须透达。清透法的代表方剂为达原饮,吴又可在解释方名时说“槟榔能消能散,除伏邪,为疏利之药;厚朴破戾气所结,草果辛烈气雄,除伏邪盘踞;三味协力,直达其巢穴,使邪气溃败,速离膜原,是以为达原也”。因此伏邪理论独特的清透法在临床耐药菌感染的治疗中有着不可替代的疗效价值。我科继承蒲辅周、薛伯寿老中医的经验,整合中医治疗伤寒、温病的优势,在薛伯寿老中医的指导下,在达原饮的基础上加减组成新加达原散。该方是由达原饮、升降散、小柴胡汤加减化裁而来,以青黛解毒;乳香散癖结;草果外达潜伏之邪;黄芩、柴胡和解表里;蝉衣、酒军升清降浊、调和紊乱之气血。全方具有清热凉血、解毒透邪之功效。
通过前述实验结果,提示以清透法为制方原理的新加达原散含药血清体外可以延缓铜绿假单胞菌对左氧氟沙星出现耐药的时间,这无疑为中医药解决细菌耐药这一棘手难题提供了思路。
[1] 刘建侠,刘胜林.铜绿假单胞菌的耐药机制及临床对策[J].临床医学,2012,32(5):104-106.
[2] 2006-2011年我院铜绿假单胞菌分布及耐药性分析[J].解放军医学院学报,2013,34(5):486-488.
[3] 刘立凡,陈佰仪.多粘菌素B与美罗培南联合用药对泛耐药铜绿假单胞菌体外抗菌活性的研究[J].中国生化药物杂志,2014,34(2):40-44.
[4] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[5] 李仪奎.中药血清药理学实验方法的若干问题[J].中药新药与临床药理,1999,10(2):95-98.
[6] 临床实验室标准协会.抗微生物药物敏感试验执行标准;第19版信息增刊.CLSI文件M100-S20(ISBN1-56238-7160-2).CLSI,940 West Valley Road,Suite 1400,Wayne,Pennsylvania 19087-1898USA,2009.
[7] 徐泽奇,徐泽宇.抗革兰阴性细菌感染抗生素的研发新进展[J].药学学报,2013,48(7):993-1004.
[8] 吴伟清,李国明.铜绿假单胞菌耐药机制的研究进展[J].医学综述,2012,18(22):3812-3815.
[9] 齐志丽,段美丽,李昂.铜绿假单胞菌耐药机制的研究现状[J].山东医药,2014,54(4):83-86.
[10]丁瑞.中药抗病原微生物作用的现代研究进展[J].现代中西医结合杂志,2013,22(21):2387-2389.
[11]王静,张淑文.复方清热颗粒对耐药大肠杆菌外膜通透性的干预作用[J].中国中医急症,2009,18(11):1845-1848.
[12]于一云,王红.复方清热颗粒剂对MRSA PBP2a表达影响的实验研究[J].中国中医急症,2009,18(9):1483-1486.
[13]杨钧,张淑文.复方清热颗粒剂含药血清对超广谱β-内酰胺酶的抑制作用[J].中国实验方剂学杂志,2007,13(11):40-43.
[14]杨钧,张淑文.复方清热颗粒剂含药血清对低浓度抗生素环境下细菌耐药性的影响[J].中国实验方剂学杂志,2007,13(10):24-28.
[15]杨钧,张淑文.中药复方清热颗粒剂抗急性耐药菌感染的药效作用研究[J].中国实验方剂学杂志,2009,15(10):58-61.
[16]赵勇,王红,张淑文,等.复方清热颗粒治疗急性肺炎疗效观察[J].中国中医急症,2010,19(1):1-3.
[17]高洁,刘清泉,马群,等.从伏邪理论看耐药菌感染[J].中医杂志,2011,52(6):537-538.
[18]孔令博,刘清泉,邱泽计,等.扶正透邪方联合抗生素体外干预多重耐药铜绿假单胞菌研究[J].中国中医急症,2011,20(4):582-584.
[19]刘清泉,孔令博,高洁,等.扶正透邪法干预多重耐药菌株感染的理论及实验研究[J].中国医院用药评价与分析,2011,11(9):773-774.
[20]刘清泉,孙宏源,高洁,等.耐药菌感染中医病机探讨及临床中药疗效观察[J].中国中医药现代远程教育,2010,8(17):213.
Study on Bacteriostasis of Pseudomonas Aeruginosa by Xinjiadayuan Decoction in Vitro
LIU Chang1,LI Wanshan2,SUN Lulu2,et al. 1 Guang′anmen Hospital,China Academy of Chinese Medicine Science,Beijing 100053,China;2 Bengbu First People's Hospital,Anhui Province,Anhui,Bengbu 001001,China
Objective:To study the role of inhibiting antibiotic resistance by Xinjiadayuan Decoction.Methods:Serum pharmacology method was applied to prepare drug serum to simulate the actual compounds after oral medicine absorbed.The pseudomonas aeruginosa ATCC27853 was cultured in broth medium with drug serum. Resistance of PA was induced by low concentration levofloxacin.Control group was treated by blank rat serum.At the same time,a group cultured PA in broth medium with simple antibiotics without serum was set up to remove the interference of serum itself.During subculture,culture of bacteria of each generation was observed until drug resistance occurred.Kirby-Bauer method was used to measure the antibiotic sensitivity and MIC was measured in each group.Results:In the process of induction of resistance in vitro,the blank serum group and blank control group were resistant in the sixth generation.While medicated serum group were resistant in the tenth generation. Conclusion:Serum containing Xinjiadayuan Decoction may delay the resistance of PA to levofloxacin.
Xinjiadayuan Decoction;Pseudomonas Aeruginosa;Bacterial resistance
R285.5
A
1004-745X(2014)11-2017-04
10.3969/j.issn.1004-745X.2014.11.021
2014-07-23)
中国中医科学院广安门医院科研课题项目(2009-S219)
△通信作者
