内镜黏膜下剥离术治疗直肠侧向发育型肿瘤的临床价值(附视频)
2014-09-04张晨徐美东姚礼庆周平红钟芸诗张轶群陈巍峰秦文政胡健卫李全林
张晨 徐美东 姚礼庆 周平红 钟芸诗 张轶群 陈巍峰 秦文政 胡健卫 李全林
随着色素内镜及放大肠镜的发展和临床应用,表浅的结直肠肿瘤的检出率较前大为提高[1-3]。有研究显示,7-36%的结直肠肿瘤为平坦型和凹陷型[2-4],平坦型早癌黏膜下浸润的发生率大于息肉样早癌[2-6]。侧向发育型肿瘤(LST)是指病灶直径大于10 mm,侧向扩展生长,而非向上或向下生长的一类肿瘤,是平坦凹陷型结肠肿瘤的一个重要亚型,其相关研究较其他平坦型肿瘤为少[4]。内镜下黏膜切除术(endoscopic mucosal resection,EMR)是治疗结直肠LST传统方法,但对于直径大于2 cm病变,因不能一次完整切除,容易出现局部病变残留和复发[5]。内镜黏膜下剥离术(endoscopic submucosa dissection,ESD)因可实现对较大(>20 mm)病灶的整块切除,而被认为是LST的最佳治疗手段[6-7]。ESD出血及穿孔等并发症发生率相对较高,技术难度大,在一定程度上限制了其在结直肠病变中的应用。我们对120例直径大于20 mm的直肠LST病变,采用ESD的方法进行治疗,取得了较好的疗效,现总结报道如下。
资料与方法
一、临床资料
2008年4月至2012年1月间,复旦大学附属中山医院内镜中心行ESD治疗的直径大于20mm的直肠LST患者共120例。所有患者术前均被详细告知ESD手术的过程及其潜在并发症发生风险,包括出血、穿孔和术后因并发症或切除标本的病理结果而追加手术的可能等。若术后标本的组织学诊断为癌症,且癌组织浸润黏膜下层或侵犯血管,则需追加外科手术。所有患者于术前均签署知情同意书。该研究病例的排除标准为:(1)黏膜下注射后病灶抬举征阴性[8-9];(2)放大内镜直肠黏膜病灶呈Pit Ⅴ型表现[10-11];(3)无法校正的凝血功能障碍(凝血酶原时间>14s或血小板计数<90×109)[10]。
二、研究器械
ERBE公司(德国)海博刀,VIO 200 D高频电切装置和APC300氩离子凝固器;Olympus公司CF-H260或Q260电子肠镜和H260AZI放大肠镜。NM-4L-1注射针、SD-230U.20圈套器、FD-410LR热活检钳、HX-600-135止血夹、KD-620LR Hook刀及KD-611LIT刀,CO2气泵。进行ESD操作时肠镜前端加装透明帽(D-201-13404)。
三、方法
本中心所有拟行ESD治疗的患者在术前均常规进行染色放大内镜检查,确定病变的同时,摄取多张不同角度的病灶图片。由两名内镜专家根据其内镜下表面形态进行双盲分型,出现分歧讨论获取共识。两大型分型一致系数κ为0.87,四个亚型一致系数κ为0.80。分型标准为:首先根据病变表面形态是否呈颗粒集簇样改变,分为颗粒型(LST-G)和非颗粒型(LST-NG)两大型。再进一步分4个亚型:(1)颗粒均一型:内镜下表面颗粒均一,大小形态基本一致,直径小于3 mm;(2)结节混合型(Nodular-mixed type):表面也呈颗粒状,但颗粒大小不一,病变周边或中央混杂有较大结节样颗粒,最大直径大于3 mm。(3)扁平隆起型:表面呈扁平样改变,无颗粒,周边常呈伪足样向四周突出,其整体外形类似于花瓣状;(4)假凹陷型:表面呈扁平样改变,同时中央部分见轻度凹陷[12]。
内镜下均局部喷洒靛胭脂进行染色,或窄带成像技术(NBI)下确定病变范围。在病变边缘外3~5 mm行氩离子血浆凝固术(APC)标记切除范围。黏膜下注射含有肾上腺素、靛胭脂的生理盐水抬举病变,在操作过程中可根据需要重复行黏膜下注射。用钩刀或海博刀在标记点外侧切开黏膜,以暴露黏膜下层,沿着标记点外侧将一圈黏膜完整切开。然后在直视下采用钩刀或IT刀或海博刀剥离黏膜下层,将病变完整剥离[13-14]。(图1)
四、组织评价
术后将切除病变展平固定于平板上,测量大小后以中性甲醛液固定送病理检查。病理类型根据WHO消化道肿瘤病理分类标准及维也纳标准。其中黏膜高级别上皮内瘤变相当于高度异型增生、原位癌及黏膜内癌;黏膜下癌指肿瘤侵透黏膜肌层达黏膜下层。整块切除是指病变在内镜下整块切除,获得单块标本。完整切除是指整块切除的病变标本病理诊断外侧缘、基底无肿瘤侵犯。完整治愈切除指病理诊断外侧缘、基底无肿瘤侵犯且无淋巴血管侵犯,包括腺瘤、黏膜高度异型增生、原位癌及黏膜内癌,而黏膜下癌均不纳入治愈切除标准[13]。
五、术后处理及随访
术后常规补液使用抗生素和止血药物,观察有无腹痛、腹胀和便血,有无会阴部和颈部皮下气肿,随访腹部体征。必要时摄腹部X线平片,了解腹腔有无游离气体。术后第1 d禁食,第2 d如无出血、腹痛和腹胀,进流质,第3 d进软食、冷食。整块切除后标本病理显示切缘阳性或者病理提示病灶已经侵犯黏膜下层均强烈建议转外科手术治疗。
术后第1年每3个月复查一次肠镜,第2年每6个月复查一次肠镜,之后每年复查1次肠镜。对怀疑复发的病变行靛胭脂染色或NBI下放大内镜检查,并行病理活检。出现以下情况考虑复发:(1)从原创面疤痕再生长的肿瘤性病变。(2)接近原创面瘢痕1~2 mm内的病变并且周围黏膜有纠集。
六、统计学方法
统计分析通过SPSS l4.0版软件进行,LST亚型分析一致性通过κ系数检验。以P<0.05为差异有统计学意义。
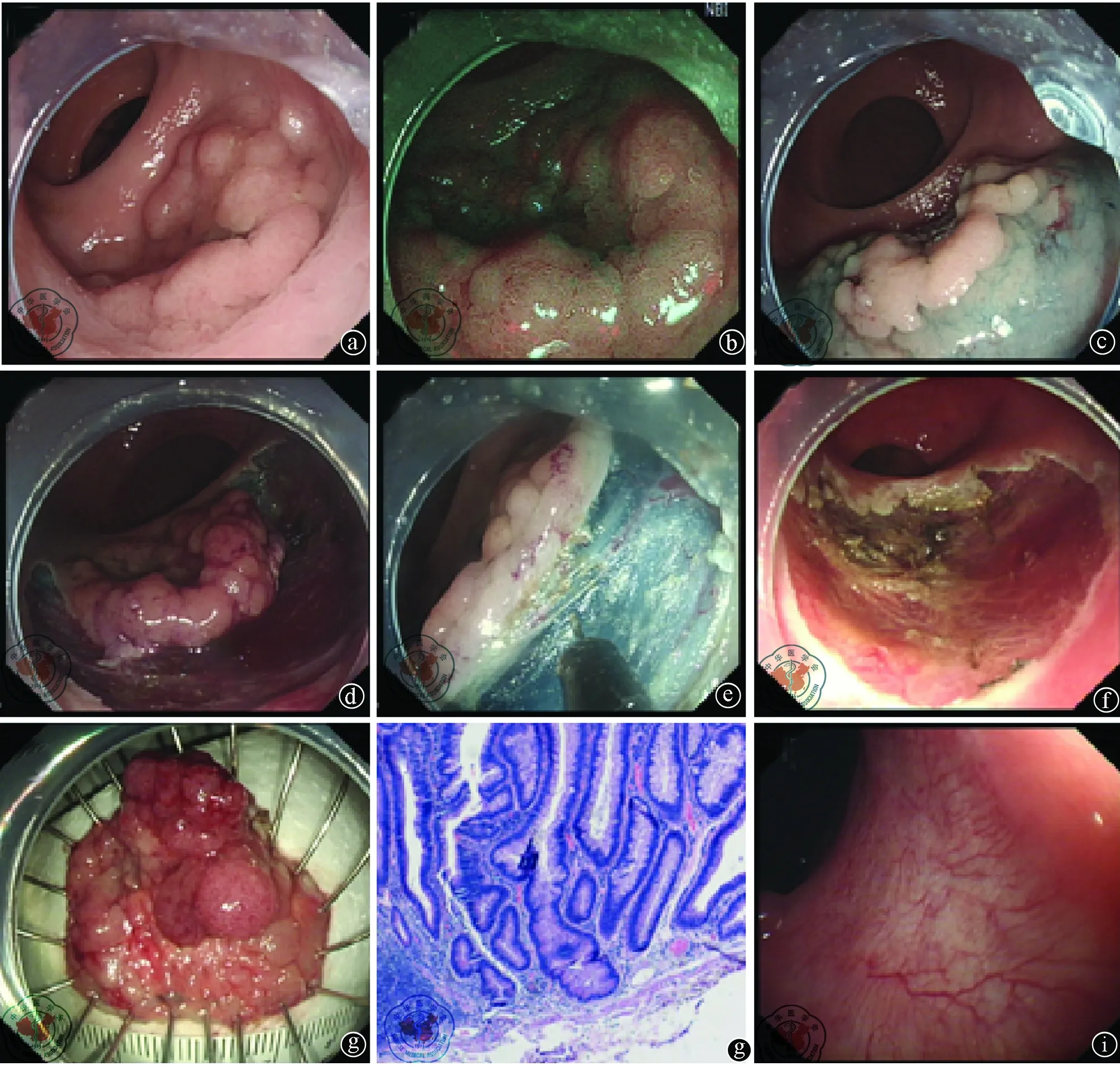
注:a图为直肠LST结节混合型病变,大小约3 cm×4 cm;b图为靛胭脂染色显示病变范围;c图为NBI放大显示病变腺管开口;d图为黏膜下注射后,肿物抬举良好,Hook刀剥离黏膜下层;e图为操作中为预防性出血,用热活检钳电凝处理可见的血管;f图为病变完整剥离后的创面使用氩气刀处理;g图为术后将标本展开固定,测量大小;h图为随访3个月后首次肠镜检查所示创面愈合情况;i图为标本HE染色光镜下图像,提示绒毛状管状腺瘤伴高级别上皮内瘤变(100×)
结 果
一、人口统计学数据
人口统计和临床数据见表1。该研究中患者的平均年龄为64.5岁。女性与男性人数比为1∶1.4。病变平均大小为35 mm(范围 20~70 mm)。男性以距肛缘8 cm,女性距肛缘6 cm处为腹膜返折线[15-16],所有病变中49(40.8%)例位于腹膜返折线以上,71(59.2%)例位于腹膜返折线以下。LST各亚型分布情况为:13(10.8%)例为颗粒均一型,71(59.2%)例为结节混合型,24例(20.0%)为平坦隆起型,12例(10.0%)为假凹陷型。
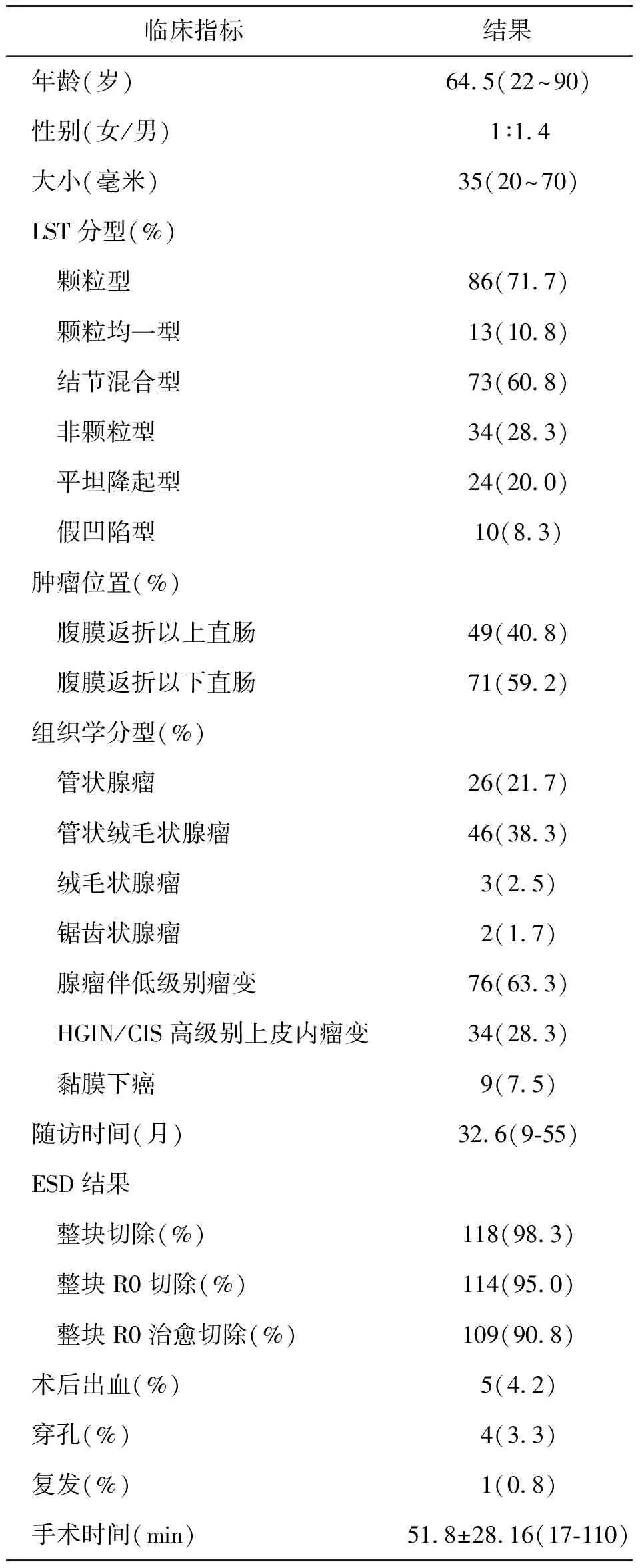
表1 患者临床病理特征及LSTs经ESD治疗结果表
二、组织学诊断结果
病理类型:腺瘤中最常见为管状绒毛状腺瘤46例(38.3%)其次为管状腺瘤26例(21.7%)。较为少见的绒毛状腺瘤3例(2.5%)及锯齿状腺瘤2例(1.7%)。其中腺瘤伴有低级别瘤变76例(63.3%)、高级别上皮内瘤变34例(28.3%)、和黏膜下癌9例(7.5%)(表1)。9例黏膜下癌的患者中,5例病变病理提示基底阳性。9例患者均强烈建议追加外科手术,其中1例患有严重的风湿性心脏病伴重度心功能不全,1例脑梗塞伴肢体瘫痪长期卧床者,未行手术治疗;余7例患者追加了外科手术,有1例术后病理结果发现在病检到的23枚结肠旁淋巴结中有2枚转移。
三、ESD手术评价结果
120例直肠LST均内镜下成功切除。平均ESD手术时间为51.8±28.16(17-110)。ESD治疗120例LSTs,整块切除率为98.3%(118/120),完整切除率为95.0%(114/120),完整治愈切除率为90.8%(109/120)。ESD术后出血发生率为4.2%(5/120),穿孔发生率为3.3%(4/120)。平均随访时间为32.6个月,复发率为0.8%(1/120)。所有病例操作过程中均有少量出血,出血量最大约600 ml,均经电凝或/和止血夹成功止血,未出现无法控制的创面出血,均无需接受输血治疗。5例发生术后迟发性出血,4例发生在术后3天,1例发生在术后1周,均在内镜下止血成功,无1例需手术治疗。ESD术中发生4例穿孔,均位于腹膜返折线以下直肠。4例穿孔均在内镜下即时予金属夹封闭后,应用抗生素成功处理。
四、随访结果
术后除9例黏膜下癌,其余111例患者纳入本研究随访中,失访3人,实际随访108例,随访期9-55月(平均32.6月)。有1例在术后第6个月复查发现复发,再予内镜下切除,至2012年1月已经随访18个月,未见复发。
讨 论
LST最早由日本学者kudo提出,由于其病变形态和发生发展上有一定的特殊性,不同于一般的结直肠黏膜来源的隆起性病变,所以将它作为一类特殊类型的肿瘤进行研究。LST包括LST-G病变及LST-NG两大亚型,前者又分颗粒均一型和结节混合型,后者分为扁平隆起型和假凹陷型[4]。LST病理上表现最多的是绒毛状腺瘤特征,最少见表现为锯齿状腺瘤[17]。各种类型病理结构尚混有不同程度的不典型增生,严重者可出现癌变,甚至呈现浸润癌的特点[18]。本研究显示病理类型以绒毛状管状腺瘤为主(38.3%),其次为高级别上皮内瘤变(29.2%),黏膜下癌有9例(7.5%),只有3例单纯绒毛状腺瘤和2例锯齿状腺瘤。
对于直径小于2 cm的LST,目前均采取内镜下EMR方法进行切除,既简单方便,又安全有效。若LST的直径>2 cm,EMR无法一次整块切除病灶,一般需分片进行黏膜切除,即EPMR。但是EPMR术后复发率较高,有文献报道良性病变复发率在3.1%,有恶性潜能的病变其复发率在33.3%,而病灶大于2 cm的LST,往往存在较高的恶变潜能[19]。同时分片切除后的病灶,组织破碎,无法进行准确的病理组织学评价。
临床实践表明,与EMR相比,对大于2 cm的LST病变,ESD能最大可能实现一次性、完整大块剥离,为术后病理学检查提供一个完整的准确的组织标本,同时又能够显著降低病变局部残留和复发率。Toyonaga等采用ESD方法治疗LST,其病变整块切除率为99.2%和完整切除率为98.1%,完整治愈切除率为89.9%[20]。本组研究120例病变中,整块切除率为98.3%,完整切除率为95.0%,完整治愈切除率为90.8%,与文献报道基本一致。
这些结果表明ESD确是直肠LST病变安全且有效的方法,但是在实际临床工作中要注意ESD切除指征的把握。由于ESD仅能切除病变局部范围内的黏膜层、黏膜肌层及黏膜下全层,无法切除可能存在的脉管浸润和淋巴的转移。因此,ESD治疗直肠癌前病变和早期癌,其先决条件就是判断病变浸润的深度。直肠腺瘤和黏膜高级别上皮内瘤变(相当于高度异型增生、原位癌及黏膜内癌)因不存在脉管浸润和淋巴转移的可能,不论病变大小,均是ESD的指征[20]。但若肿瘤突破黏膜肌层,浸润黏膜下层时,就有脉管浸润和淋巴转移的可能,在目前的医疗环境和医疗条件下,无法准确判断每个个体是否存在淋巴转移,ESD不是首选的治疗方法。对于术后病理确认肿瘤浸润黏膜下层,甚至固有肌层时,应转外科手术治疗。本组9例黏膜下癌,除2例不能耐受外科手术外,余7例均在建议下追加了外科手术,其中1例术后病理发现有结肠旁淋巴结转移。对于LST术前病变深度判断的方法主要为染色放大内镜,若发现结直肠黏膜pit分型为V型(不规则或者无结构),提示黏膜下癌;而黏膜下注射试验也是一种简单实用的方法,可根据黏膜下注射时非抬举征阳性与否来判断肿瘤有无浸润至黏膜下深层或固有肌层[21]。当然,一些高分辨率的超声内镜也可以判断肿瘤是否突破黏膜肌层浸润黏膜下层或肌层,但实用性不大,文献报道其特异性只有14.3%[22]。
出血和穿孔是ESD的主要并发症。术中一旦发生较大量出血,应用冰生理盐水(含去甲肾上腺素)对创面进行冲洗,明确出血点后应用热电凝钳钳夹出血点电凝止血,必要时也可以采用止血夹夹闭出血点。由于止血过程费时费力,而且影响操作视野,易导致穿孔发生,所以在整个ESD过程中要时刻注意采取预防性止血措施,对显露的血管随时应用切开刀或热电凝钳进行电凝处理,预防大出血的发生。术中穿孔多是由于操作视野不清,或切开刀的长度及角度控制不好所致,主要表现为出现气腹,并见肠壁外脂肪,少数直肠病变表现为腹部及颈部皮下气肿。气腹严重时,可以用腹腔穿刺针于右下腹穿刺,持续排气,减轻腹压。术毕,在直视下应用金属夹尽可能将穿孔完整封闭。由于术前进行过肠道准备,ESD并发的穿孔经金属夹处理后,其所致的腹膜炎体征往往较轻,也较局限,术后予禁食、抗炎补液等保守治疗一般均能成功。(本研究方法中的操作过程见名家手术视频)
[1] Tischendorf JJ,Wasmuth HE,Koch A,et al.Value of magnifying chromoendoscopy and narrow band imaging(NBI)in classifying colorectal polyps:a prospective controlled study.Endoscopy,2007,39:1092-1096.
[2] Konishi K,Kaneko K,Kurahashi T,et al.A comparison of magnifying and nonmagnifying colonoscopy for diagnosis of colorectal polyps:a prospective study.Gastrointest Endosc,2003,57:48-53.
[3] Kato S,Fujii T,Koba I,et al.Assessment of colorectal lesions using magnifying colonoscopy and mucosal dye spraying:can significant lesions be distinguished? Endoscopy,2001,33:306-310.
[4] Kudo S.Endoscopic mucosal resection of flat and depressed types of early colorectal cancer.Endoscopy,1993,25:455-461.
[5] Kiesslich R,Neurath MF.Endoscopic mucosal resection:an evolving therapeutic strategy for non-polypoid colorectal neoplasia.Gut,2004,53(9):1222-1224.
[6] Matsuda T,Gotoda T,Saito Y,et al.Our perspective on endoscopic resection for colorectal neoplasms.Gastroenterol Clin Biol,2010,34:367-370.
[7] Tamegai Y,Saito Y,Masaki N,et al.Endoscopic submucosal dissection:a safe technique for colorectal tumors.Endoscopy,2007,39:418-422.
[8] Han KS,Sohn DK,Choi DH,et al.Prolongation of the period between biopsy and EMR can influence the nonlifting sign in endoscopically resectable colorectal cancers.Gastrointest Endosc,2008,67:97-102.
[9] Ishiguro A,Uno Y,Ishiguro Y,et al.Correlation of lifting versus non-lifting and microscopic depth of invasion in early colorectal cancer.Gastrointest Endosc,1999,50:329-333.
[10] Uraoka T,Saito Y,Matsuda T,et al.Endoscopic indications for endoscopic mucosal resection of laterally spreading tumours in the colorectum.Gut,2006,55:1592-1597.
[11] Matsuda T,Fujii T,Saito Y,et al.Efficacy of the invasive/non-invasive pattern by magnifying chromoendoscopy to estimate the depth of invasion of early colorectal neoplasms.Am J Gastroenterol,2008,103:2700-2706.
[12] Kudo S,Lambert R,Allen JI,et al.Nonpolypoid neoplastic lesions of the colorectal mucosa.Gastrointest Endosc,2008,68(4):3-47.
[13] 周平红,徐美东,陈巍峰,等.内镜黏膜下剥离术治疗直肠病变.中华消化内镜杂志,2007,24(1):4-7.
[14] Xu MD,Wang XY,Li QL,et al.Colorectal lateral spreading tumor subtypes:clinicopathology and outcome of endoscopic submucosal dissection.Int J Colorectal Dis,2013,28(1):63-72.
[15] Dujovny N,Quiros RM,Saclarides TJ.Anorectal anatomy and embryology.Surg Oncol Clin N Am,2004,13:277-293.
[16] Beck DE,Wexner SD.Fundamentals of anorectal surgery.McGraw-Hill,New York,1992.
[17] Rozen P,Brazowski E.Flat colorectal neoplasia:identification,pathogenesis and clinical significance.Dig Liver Dis,2003,35(3):135-137.
[18] Kim BC,Chang HJ,Han KS,et al.Clinicopathological differences of laterally spreading tumors of the colorectum according to gross appearance.Endoscopy,2011,43(2):100-107.
[19] Seo GJ,Sohn DK,Han KS,et al.Recurrence after endoscopic piecemeal mucosal resection for large sessile colorectal polyps.World J Gastroenterol,2010,16(22):2806-2811.
[20] Matsuda T,Gotoda T,Saito Y,et al.Conio M.Our perspective on endoscopic resection for colorectal neoplasms.Gastroenterol Clin Biol,2010,34(6-7):367-370.
[21] Tamegai Y,Saito Y,Masaki N,et al.Endoscopic submucosal dissection:a safe technique for colorectal tumors.Endoscopy,2007,39(5):418-422.
[22] Tanabe R,Higaki S,Gondo T,et al.Preoperative evaluation of early colorectal cancer using an ultrasound mini probe.Hepatogastroenterology,2011,14(59):118-119.
