结肠镜筛查203例无症状人群结直肠癌及腺瘤检出率分析
2014-09-04张进文谭少华徐义祥周伟文余汉濠
张进文 谭少华 徐义祥 周伟文 余汉濠
结直肠癌是我国主要的常见恶性肿瘤,高居我国恶性肿瘤发病率前六位。最新出版的澳门癌症登记年报显示,其发病率占当地所有新发恶性肿瘤的12%,居第二位,且在近10年呈上升趋势,其死亡率也占恶性肿瘤死亡率的12%,居癌症死因第三位[1]。结直肠癌的有效防治手段之一是预防和早期诊断。研究表明结肠镜检查并切除癌前病变可以大大减少结直肠癌10年内甚至10年后的复发率和死亡率[2]。结直肠腺瘤是结直肠癌最主要的癌前病变,内镜下发现并切除腺瘤是降低结直肠癌发生率的有效方法[3-4]。美国胃肠病学会及中华医学会消化分会的共识指南都推荐肠镜作为肠癌筛查的主要手段[2,5]。
既往有多项研究分析了1994年至2013年间不同地区无症状人群的肠镜筛查结果[6-12]。其中,美国的肠癌检出率为0.1~1.0%,腺瘤检出率为20.4~36.5%[6-7],韩国的腺瘤检出率为48.7%[10],上海的腺瘤检出率为11.48%[11]。由于结直肠癌及腺瘤的发病与生活方式密切相关,而我国各地生活饮食习惯各异,澳门目前尚未有相应的本地资料,因此有必要对此进行初步探索。
本研究的目的是初步了解澳门无症状人群肠镜筛查的结直肠癌及腺瘤检出率,并分析相应患者的临床特征,以推测其高危因素。
资料与方法
一、临床资料
回顾性分析2012年1月至2012年12月期间,于我院体检中心预约肠镜检查的无症状人群的肠镜检查结果和临床特征。共有203例患者入组。纳入标准:年龄大于18岁,无消化道症状,无结直肠癌病史和无结直肠腺瘤性息肉病史及其家族史,无遗传性结直肠癌病史和无炎症性肠病病史的人群,并且完成全结肠镜检查(插镜至盲肠)。排除标准:有结直肠手术史,有息肉病史或结直肠癌病史,有血便、长期腹泻、消瘦等症状,肠镜检查未完成。
二、方法
采用回顾性分析设计,由本院体检中心电子档案中提取符合条件的患者相关资料,包括性别、年龄、吸烟史、肠癌家族史、肠镜检查结果。肠镜由本院消化科医生完成,肠镜病理标本由本院病理科医师出具病理诊断。肠镜检查结果主要包括息肉的病理类型、大小、部位和数目。所有息肉均予切除或取活检以明确病理诊断。病理类型分为肠癌、腺瘤、非肿瘤性息肉,其中腺瘤分为锯齿状腺瘤、绒毛状腺瘤、管状绒毛状腺瘤、管状腺瘤。同时,按腺瘤进展为恶性肿瘤的危险性,将腺瘤分为2组:高危腺瘤组和低危腺瘤组。符合以下任一条件即为高危腺瘤:腺瘤直径≥10 mm,大于3个腺瘤,具绒毛状结构或重度不典型增生。低危腺瘤的定义为1~2≤直径≤10 mm管状腺瘤[2,5]。有多个病变部位的受检者,按预后最差的病理类型进行分析。病变部位由远程向近端分为直肠、乙状结肠、降结肠、横结肠、升结肠、盲肠共6个节段。
三、统计学方法
用SPSS 20.0软件分析肠癌及腺癌的检出率。各分组间肠癌的检出率差异分析采用Fisher确切概率法,各分组间腺瘤及高危腺瘤的检出率差异分析采用X2检验。以P<0.05认为差异有统计学意义。
结 果
一、受检者基本资料
2012年1月至12月于本院体检中心预约肠镜筛查,并提供家族史及吸烟史的无消化道症状受检者207例,其中1例有肠道手术史,2例放弃肠镜检查,1例肠镜检查终止于肝曲,共4例被排除。203例符合研究标准,平均年龄51.03±9.30岁,其中男性131例,平均年龄50.79±9.48岁,女性72例,平均年龄51.46±9.00岁(表1)。
二、肠癌、腺瘤及非肿瘤性息肉的检出率
共125例受检者发现息肉样病变,按预后最差的病理类型进行分析,各类型检出人数如表2所示。其余78例(38.42%)无息肉病变。3例肠癌患者的病理类型分别为原位癌、微小浸润腺癌、中分化腺癌。70例腺瘤检出者中,64例为单一腺瘤病理类型,6例具有2种腺瘤病理类型。锯齿状腺瘤共5例10个,其中2例同时有管状腺瘤;管状绒毛状腺瘤共12例12个,其中4例同时有管状腺瘤;管状腺瘤共60例103个。总腺瘤数为125个,未检出绒毛状腺瘤。
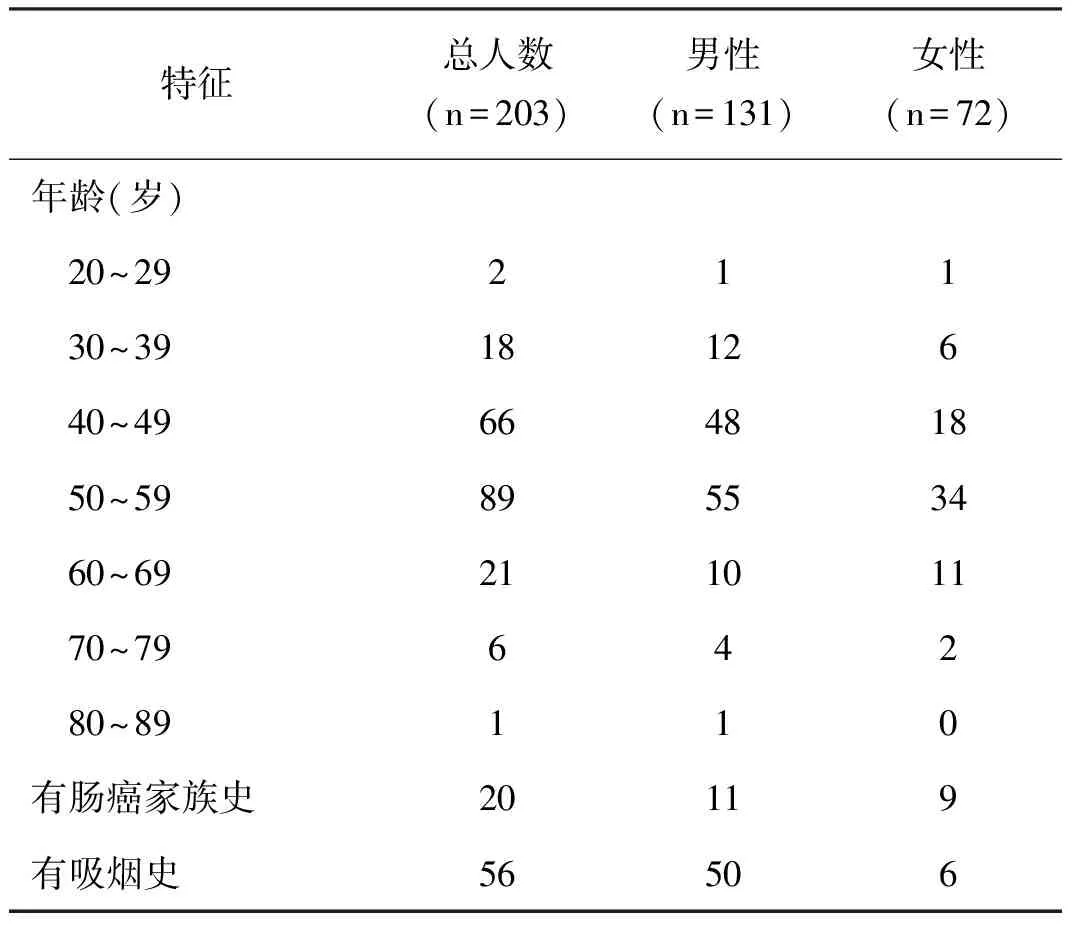
表1 受检者基本特征情况表

表2 受检者肠癌、腺瘤及非肿瘤性息肉检出率表
三、受检者病变部位分布情况
3例肠癌患者中,1例为乙状结肠癌,2例为降结肠癌。70例腺瘤检出者中,47例仅累及一个部位,20例累及2个部位,3例累及3个部位。直肠、乙状结肠及降结肠检出的腺瘤占45.83%,横结肠、升结肠及盲肠检出的腺瘤占54.16%(表3)。
四、受检者性别与肠癌、腺瘤检出率关系
3例肠癌患者中,2例为男性,1例为女性,分别占所在性别的1.53%和1.39%,两组间差异无统计学意义(P=1.000)。131例男性受检者中发现腺瘤者49例(37.40%),72例女性受检者中发现腺瘤者21例(29.17%),男女比例为1.28:1,两组间差异无统计学意义(P=0.237)。其中男性高危腺瘤者22例(16.79%),女性高危腺瘤者8例(11.11%),男女比例为1.51:1,两组间差异无统计学意义(P=0.275)。
五、受检者年龄与肠癌、腺瘤检出率关系
受检者按年龄分为3组:20~49岁组、50~59岁组、60~89岁组。3例肠癌患者均为40~65岁,确切年龄分别为43、59、62岁,分别占所在年龄组的1.16%、1.12%、3.57%。随着年龄的增大,腺瘤、高危腺瘤的检出率逐渐增高,如表4所示。不同年龄层的腺瘤检出率差异有统计学意义。经两两比对分析,60~89岁组腺瘤检出率较20~49岁组高,且差异有统计学意义(P=0.013)。20~49岁与50~59岁两组间差异无统计学意义(P=0.324),50~59岁与60~89岁两组间差异无统计学意义(P=0.077)。不同年龄层的高危腺瘤检出率呈上升趋势,但组间差异无统计学意义。
六、受检者肠癌家族史与肠癌及腺瘤检出率关系
20例有肠癌家族史的受检者中1例(5.00%)检出肠癌,9例(45.00%)检出腺瘤,其中5例(25.00%)为高危腺瘤。183例无家族史的受检者中2例(1.09%)检出肠癌,61例(33.33%)检出腺瘤,其中25例(13.66%)为高危腺瘤。有家族史组的肠癌、腺瘤、高危腺瘤检出率均较无家族史者高,但差异无统计学意义(P=0.269、0.297、0.305)。
七、受检者吸烟史与肠癌、腺瘤检出率关系
有吸烟史的受检者中1例(1.28%)检出肠癌;无吸烟史的受检者中2例(1.36%)检出肠癌,两组间差异无统计学意义(P=1.000)。如表5所示,吸烟组的高危腺瘤检出率较无吸烟组高,且差异有统计学意义。同时,吸烟组的腺瘤检出率也较无吸烟组高,但差异无统计学意义。

表5 受检者中吸烟组与无吸烟组腺瘤检出率比较表
讨 论
本研究中肠癌检出率为1.48%,与既往的部分研究相似[6],而且3例肠癌分期均较早,进一步证实,对无症状人群行肠镜筛查有助于肠癌的早期诊断。肠癌的预后与早期诊断有很大关系,早期结直肠癌的5年生存率可达90%,而晚期只有12%[13]。因此,肠镜筛查是肠癌早诊早治的有效方法,从而达到改善患者的预后的目的。结直肠癌的发生与生活方式有很大相关性,而生活方式具有地域性的特点。因此,不同的地区有不同的发病风险[1,13-15]。
目前在美国,针对平均风险的个体,结直肠癌筛查指南推荐结肠镜筛查起始年龄为50岁[2]。所谓平均风险的人群是指无大肠癌的相关症状或预警症状、无大肠癌病史和无大肠腺瘤性息肉病史及其家族史,无遗传性大肠癌病史和无炎症性肠病病史的人群[16]。而国内主要研究的热点在于对无症状平均风险人群的发病风险进行危险分层,然后针对其中发病风险较高的人群再进行结肠镜筛查,以期提高诊出率并降低医疗支出[17]。
本研究初步探索了澳门地区无症状人群的肠癌及腺瘤检出率及其临床特征,下一步应进一步研究这些因素与疾病的相关性,进一步建立本地区的危险分层因素,合理的给予肠镜检查的建议。本研究中,腺瘤检出率34.48%,其中高危腺瘤检出率14.78%,即约1/3的受检者可通过肠镜筛查早期发现腺瘤这一癌前病变并行内镜下切除。由于腺瘤散布于结肠各节段,因此无症状人群的肠镜筛查应选择全结肠镜,而非乙状结肠镜。这一结论,也曾在其它研究中被证实[7]。
大于60岁的受检者,其腺瘤检出率较年轻者高,提示其肠镜筛查所得的获益最大。同时,即使是小于60岁的年轻受检者,也有近1/3者检出腺瘤,且大于1/10为高危腺瘤,说明对年轻无症状人群也有必要进行肠镜筛查,但从何时开始筛查才合适,需要更大样本量进一步细分年龄段分析以提供数据支持。吸烟者的高危腺瘤检出率高,提示吸烟会增加罹患结肠高危腺瘤的风险。这与既往的研究结果相类似,提示对吸烟者的肠镜筛查应较普通人群积极[18-19]。
本研究中,有肠癌家族史组的肠癌及腺瘤检出率均较无家族史组高,但差异无统计学意义。回顾既往多项研究,有肠癌家族史的受检者,其肠癌及腺瘤的发生率均较无家族史者高。考虑到本研究中有家族史组的人数较少,后续研究中需进一步加大样本量进行分析[20-23]。本研究作为回顾性分析,受限于历史数据的原因,基础特征的记录项目较少,部分基础特征分组人数未能匹配。部分亚组分析,如20~39岁、70~89岁等年龄层的样本量少,需合并多个年龄层进行分析。总体样本量不大,多项基础特征分组,如性别、有无肠癌家族史的分组比较,虽有百分比的差异,但差异无统计学意义,后续研究需加大样本量,以进一步分析。
[1] 澳门癌症登记年报编写小组.澳门癌症登记年报2011.澳门特别行政区政府卫生局,2013:1-19.
[2] Lieberman DA,Rex DK,Winawer SJ,et al.Guidelines for colonoscopy surveillance after screening and polypectomy:a consensus update by the US Multi-Society Task Force on Colorectal Cancer.Gastroenterology,2012,143(3):844-857.
[3] Zauber AG,Winawer SJ,O’Brien MJ,et al.Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths.N Engl J Med,2012,366(8):687-696.
[4] Meagher,AP,M Stuart.Does colonoscopic polypectomy reduce the incidence of colorectal carcinoma? Aust N Z J Surg,1994,64(6):400-404.
[5] 中华医学会消化病学分会.中国结直肠肿瘤筛查、早诊早治和综合预防共识意见(一).中华消化杂志,2012,32:1-10.
[6] Lieberman DA,Weiss DG,Bond JH,et al.Use of colonoscopy to screen asymptomatic adults for colorectal cancer.Veterans Affairs Cooperative Study Group 380.N Engl J Med,2000,343(3):162-168.
[7] Schoenfeld P,Cash B,Flood A,et al.Colonoscopic screening of average-risk women for colorectal neoplasia.N Engl J Med,2005,352(20):2061-2068.
[8] Rundle AG,Lebwohl B,Vogel R,et al.Colonoscopic screening in average-risk individuals ages 40 to 49 vs 50 to 59 years.Gastroenterology,2008,134(5):1311-1315.
[9] Leung WK,Ho KY,Kim WH,et al.Colorectal neoplasia in Asia:a multicenter colonoscopy survey in symptomatic patients.Gastrointest Endosc,2006,64(5):751-759.
[10] Kim YJ,Lee KJ,Park SY,et al.Association between dyslipidemia and the prevalence of colon polyps based on a health evaluation of subjects at a hospital.Korean J Fam Med,2014,35(3):143-151.
[11] 赵子夜,李骏强,单永琪,等.结直肠癌平均风险人群结肠镜检查的息肉与腺瘤检出率及其年龄分布情况.中华消化内镜杂志,2014,31:64-68.
[12] Heitman SJ,Ronksley PE,Hilsden RJ,et al.Prevalence of adenomas and colorectal cancer in average risk individuals:a systematic review and meta-analysis.Clin Gastroenterol Hepatol,2009,7(12):1272-1278.
[13] Siegel R,D.Naishadham,A Jemal.Cancer statistics,2012.CA Cancer J Clin,2012,62(1):10-29.
[14] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡.中国肿瘤,2014:23.
[15] Hong Kong Cancer Registry,HA.Leading Cancer Sites in Hong Kong in 2011.http://www3.ha.org.hk/cancereg/rank_2011.pdf.2013-10-08/2014-12-10.
[16] Eddy D.ACS report on the cancer-related health checkup.CA Cancer J Clin,1980,30(4):193-240.
[17] 许岸高,余志金,钟旭辉,等.大肠癌高危人群筛查研究.中华医学杂志,2010,90:116-118.
[18] Rueda M,Robertson Y,Acott A,et al.Association of tobacco and alcohol use with earlier development of colorectal pathology:should screening guidelines be modified to include these risk factors? Am J Surg,2012,204(6):963-967.
[19] Fu Z,Shrubsole MJ,Li G,et al.Interaction of cigarette smoking and carcinogen-metabolizing polymorphisms in the risk of colorectal polyps.Carcinogenesis,2013,34(4):779-786.
[20] Mesher D,Dove-Edwin I,Sasieni P,et al.A pooled analysis of the outcome of prospective colonoscopic surveillance for familial colorectal cancer.Int J Cancer,2014,134(4):939-947.
[21] Menges M,Fischinger J,Gartner B,et al.Screening colonoscopy in 40-to 50-year-old first-degree relatives of patients with colorectal cancer is efficient:a controlled multicentre study.Int J Colorectal Dis,2006,21(4):301-307.
[22] Guillem JG,Forde KA,Treat MR,et al.Colonoscopic screening for neoplasms in asymptomatic first-degree relatives of colon cancer patients.A controlled,prospective study.Dis Colon Rectum,1992,35(6):523-529.
[23] Cottet V,Pariente A,Nalet B,et al.Colonoscopic screening of first-degree relatives of patients with large adenomas:increased risk of colorectal tumors.Gastroenterology,2007,133(4):1086-1092.
