C57BL/6小鼠PD-1基因敲除后心房肌细胞氧化应激水平和心房结构重构研究
2014-09-01付国强曹义战何乾锋田小溪王伯良
付国强 曹义战 何乾锋 田小溪 王伯良
·论著·
C57BL/6小鼠PD-1基因敲除后心房肌细胞氧化应激水平和心房结构重构研究
付国强 曹义战 何乾锋 田小溪 王伯良
目的PD-1基因敲除后会激活T细胞并提高机体炎症水平并可能影响机体氧化应激水平,本研究旨在观察C57BL/6小鼠在PD-1基因敲除后心房细胞氧化应激水平变化及其对小鼠心房结构重构的影响。方法我们同时对两组动物进行了观察:C57BL/6小鼠和C57BL/6-PD-1-/-小鼠。对比观察两组心房肌细胞氧化应激水平和心房肌心肌纤维化水平。结果和对照组相比较,C57BL/6-PD-1-/-小鼠心房肌细胞细胞内活性氧水平明显升高,同时心房肌Masson染色显示基因敲除后心房肌出现了纤维化,而对照组没有出现。结论PD-1基因敲除后出现心房肌细胞活性氧水平的升高并导致了C57BL/6小鼠的心房结构重构。
PD-1基因敲除;活性氧;心房结构重构;心房颤动
房颤是临床最常见的心律失常,在普通人群中的发病率约为2%,且随着年龄的增长发病率迅速升高,80岁以上人群中发病率甚至超过了9%[1]。房颤的发病机制比较复杂,目前普遍认为房颤起源于存在于心房的多发折返环[2],但对于多发折返环的产生机制仍然未得到完全阐明。近年来,有研究证实心房结构重构能够促进心房内多发折返环生成而使得房颤发病的易感性增高[3]。氧化应激主要指在细胞代谢过程中所产生的对机体具有损害作用的活性氧(ROS)。有证据表明房颤患者的心房肌存在大量的氧化应激损伤[3]。房颤发病过程中的许多病理生理学改变可能和逐步升高的氧化应激水平有关,这些变化包括NAD(P)H氧化酶和黄嘌呤氧化酶活性的持续升高,炎症过程加剧,RAS系统激活等。程序性死亡因子-1(programmed death-1,PD-1)是T细胞表面的CD28家族的一个重要的负性共刺激分子,该基因的缺失可以增强T细胞活性,提高体内的炎症水平[4]。目前有证据表明炎症和氧化应激关系密切[5,6]。那么,伴随着PD-1-/-小鼠机体的高炎症状态是否会影响小鼠心房肌细胞氧化应激水平并由此对小鼠心房结构重构产生影响?在本研究中,我们对比了C57BL/6-PD-1-/-小鼠和C57BL/6小鼠心房肌氧化应激水平和心房心肌纤维化水平,旨在探究二者之间的关系。
1 材料与方法
1.1 实验动物 C57BL/6-PD-1-/-小鼠由日本京都大学的Tasuku Honjo教授免费转让,实验组(C57BL/6-PD-1-/-)和对照组(C57BL/6小鼠)每组15只,雄性,6~8周龄。实验前均饲养于第四军医大学基础部神经生物教研室SPF级实验动物中心。
1.2 实验方法
1.2.1 Langendorff 灌注小鼠离体心脏获取心房肌细胞:脱颈处死小鼠后迅速摘除心脏并主动脉插管,悬挂于Langendorff离体灌注仪上,通过主动脉实现冠状动脉逆灌注,在冠状动脉灌注过程中保持灌注液温度在37℃并加入100%的氧气。最初用普通的台氏液灌注心脏清洗血液,然后用无钙台氏液灌注2 min,最后心脏用0.14 mg/ml胶原酶(Sigma-Aldrich)液灌注15 min左右,灌注结束后,心房被从心脏上分离下来剪成碎片,用玻璃移液管吹散这些碎片形成单个细胞。800 r/min离心5 min后,将细胞沉淀与含10%胎牛血清的DMEM培养基混匀,成纤维细胞差速贴壁1 h后换液,置于37℃培养箱以备后续试验。
1.2.2 心房肌细胞活性氧(reactive oxygen species,ROS)检测:取培养24 h的心房肌细胞,用0.1%胰酶1 ml滴于培养瓶,覆盖瓶底,当细胞开始收缩弃去胰酶;PBS温和清洗1次;放入2 ml无血清培养基;用弯头吸管反复吹打,制备单个细胞悬液。心房肌细胞用无血清培养基清洗两遍后,种植于96孔培养板,调整细胞浓度至106/ml,加用DMSO配置的浓度为2 μmol/L的DCFH-DA并在37℃培养箱中避光孵育20 min,后移入上样管上机记录数据。DCF的激发波长为495 nm,发射波长为525 nm,通过FL1检测。
1.2.3 病理学检查:心脏标本甲醛固定后,在70%乙醇中脱水,清洗后石蜡包埋。常规切片后在60℃烤箱中干燥,切片在Masson三色溶液(第四军医大学基础部病理学实验室)中浸入5 min,0.2%醋酸清洗10 s后用5%磷钨酸处理10 min,然后用0.2%醋酸溶液再次清洗2次,2%苯胺蓝溶液染色5 min,醋酸清洗2次后梯度酒精脱水后二甲苯清洗中性树胶封片。
2 结果
2.1 心房肌细胞氧化应激水平检测 通过流式细胞仪检测心房肌细胞(每组10 000个)内活性氧结果显示,试验组和对照组平均荧光强度差异有统计学意义[(30.2±1.7)vs(24.4±1.8),P<0.01],C57BL/6-PD-1-/-小鼠组明显升高。见图1。
2.2 心房病理学检查 心房肌Masson三色染色发现,在基因敲除组出现了心肌纤维化,而对照组未发现,在B组中可以看到染为蓝色的胶原纤维,而A组中没有看到。见图2、3。

图1 C57BL/6-PD-1-/-小鼠(B)和C57BL/6小鼠ROS检测
3 讨论
程序性死亡因子-1(programmed death-1,PD-1)是T细胞表面的CD28家族的一个重要的负性共刺激分子,它通过和其配体程序性死亡因子配体-1/2(programmed death ligand-1/2,PD-L1/2)结合后负性调节免疫反应并维持外周免疫耐受[7]。敲除该基因能够增强T细胞活性,提高体内的炎症水平。1998年有学者[8]成功制作出了PD-1基因敲除小鼠,有研究证实PD-1-/-小鼠分泌炎性因子的能力明显增强[9]。
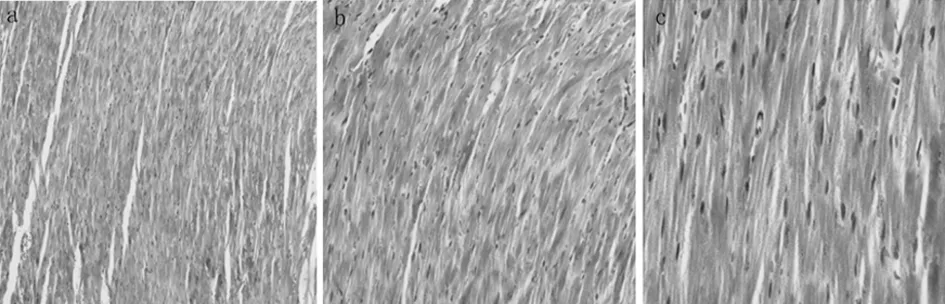
(Masson×100)(Masson×200)(Masson×400)

(Masson×100)(Masson×200)(Masson×400)
氧化应激是指机体内氧化和抗氧化失衡,导致某些自由基的产生和抗氧化防御之间出现严重失衡的一种病理状态。在许多病理生理情况下,炎症和氧化应激密切相关,高炎症水平往往伴随着高氧化应激水平,反之亦然。研究表明炎性因子可以通过白细胞膜上NADPH氧化酶复合物的氧化作用产生活性氧,放大氧化应激的反应[10]。有实验证明:炎性细胞因子(IL-6,TNF-α)可直接诱导中性粒细胞产生大量氧自由基[11],提高机体氧化应激水平。而氧自由基又可以进一步刺激炎性细胞活化,因此,氧化应激和炎性反应形成螺旋上升式的恶性循环。本研究表明,PD-1基因敲除小鼠本身伴随的高炎症状态影响了小鼠心房肌细胞的氧化应激水平,使得其明显身高。
氧化应激主要产物是对机体具有损害作用的活性氧(ROS),高氧化应激水平和心房结构重构密切相关,研究表明ROS在血管紧张素Ⅱ所诱导的心肌重构中也发挥了重要作用[12]。在本研究中,我们发现伴随C57BL/6-PD-1-/-小鼠的机体高炎症状态导致了心房细胞氧化应激水平明显升高,二者共同作用下导致了心房心肌纤维化形成。心肌纤维化被认为是心房重构的主要表现,因此可以认为PD-1基因敲除后C57BL/6-PD-1-/-小鼠出现了心房肌细胞活性氧水平升高、心房结构重构,由于心房结构重构和房颤发病易感性的密切关系,实验结果高度支持C57BL/6-PD-1-/-小鼠房颤发病易感性升高。
1 Page RL.Newly diagnosed atrial fibrillation.New England Journal of Medicine,2004,351:2408-2416.
2 Falk RH.Atrial fibrillation.New England Journal of Medicine,2001,344:1067-1078.
3 Deepa K,Sharma GL,Gang Xu,et al.Atrial Remodeling in Atrial Fibrillation and Some Related MicroRNAs.Cardiology,2011,120:111-121.
4 Kamphorst AO AR.Manipulating the PD-1 pathway to improve immunity.Curr Opin Immunol.2013;[Epub ahead of print].
5 Korantzopoulos P,Galaris D,Papaioannides D,et al.C-reactive protein and oxidative stress in atrial fibrillation.International Journal of Cardiology,2003,88:103-104.
6 Korantzopoulosp KT,Siogas K,Goudevenos J.Atrial fibrillation and electrical remodeling:the potential role of inflammation and oxidative stress.Med Sci Monit,2003,9:225-229.
7 Okazaki TH,Tasuk U.The PD-1-PD-L pathway in immunological tolerance.Trends in Immunology,2006,27:195-201.
8 Nishimurah MN,Nakano T,Honjo T.Immunological studies on PD-1 deficient mice:implication of PD-1 as a negative regulator for B cell responses.Int Immunol,1998,10:1563-1572.
9 Carter LL,Leach MW,Azoitei ML,et al.PD-1/PD-L1,but not PD-1/PD-L2,interactions regulate the severity of experimental autoimmune encephalomyelitis.Journal of Neuroimmunology,2007,182:124-134.
10 Rodriguez-Iturbe ZC,Quiroz Y,Sindhu RK,et al.Antioxidant-rich diet relieves hypertension and reduces renal immune infiltration in spontaneously hypertensive rats.Hypertension,2003,41:341-346.
11 Millerfj Jr GD,Rios CD,Heistad DD,et al.Superoxide production in vascular smooth muscle contributes to oxidative stress and impaired relaxation in atherosclerosis.Circ Res,1998,82:1298-1305.
12 Wu S,Gao J,Ohlemeyer C,et al.Activation of AP-1 through reactive oxygen species by angiotensin II in rat cardiomyocytes.Free Radical Biology and Medicine,2005,39:1601-1610.
ThechangesofoxidativestresslevelsofatrialmusclecellandatrialstructureremodelingafterPD-1geneknock-outinC57BL/6mice
FUGuoqiang,CAOYizhan,HEQianfeng,etal.DepartmentofEmergency,TangduHospital,TheFourthMilitaryMedicalUniversity,Xi’an710038,China
ObjectiveTo investigate the changes of oxidative stress levels of atrial muscle cell and effect on atrial structure remodeling after programmed cell death 1(PD-1) gene knock-out in C57BL/6 mice.MethodsThe two kinds of mice were enrolled in the study:C57BL/6 control group (15 mice,including 6 males and 9 females ) and C57BL/6-PD-1 group (15 mice,including 6males and 9 females).The oxidative stress levels of atrial muscle cell and atrial myocardial fibrosis were observed for both groups.ResultsAs compared with those in C57BL/6 control group,the oxidative stress levels of atrial muscle cell in PD-1 group were significantly increased (P<0.05),meanwhile,Masson staining showed that atrial myocardial fibrosis was found in PD-1 group,however,which was not observed in C57BL/6 control group.ConclusionThe increase of oxidative stress levels of atrial muscle cell presents after PD-1 gene knock-out in C57BL/6 mice,furthermore,which results in atrial structure remodeling of C57BL/6 mice.
PD-1 deficiency;reactive oxygen species;atrial structure remodeling;atrial fibrillation
10.3969/j.issn.1002-7386.2014.15.005
710038 西安市,第四军医大学唐都医院急诊科
王伯良,710038 西安市,第四军医大学唐都医院急诊科;
E-mail:wliang@fmmu.edu.cn
R 541.75
A
1002-7386(2014)15-2256-03
2014-01-22)
