25个油茶优良无性系的遗传分析与分子鉴别
2014-08-31孙佩光奚如春李俊成欧阳昆唏钟燕梅陈晓阳
孙佩光, 奚如春, 李俊成, 欧阳昆唏, 钟燕梅, 陈晓阳
(1 中国热带农业科学院 海口实验站/海南省香蕉遗传改良重点实验室,海南 海口 570102; 2 华南农业大学 亚热带农业生物资源保护与利用国家重点实验室/广东省森林植物种质创新与利用重点实验室,广东 广州 510642; 3 华南农业大学 林学院,广东 广州 510642)
25个油茶优良无性系的遗传分析与分子鉴别
孙佩光1,2, 奚如春2,3, 李俊成2,3, 欧阳昆唏2,3, 钟燕梅2,3, 陈晓阳2,3
(1 中国热带农业科学院 海口实验站/海南省香蕉遗传改良重点实验室,海南 海口 570102; 2 华南农业大学 亚热带农业生物资源保护与利用国家重点实验室/广东省森林植物种质创新与利用重点实验室,广东 广州 510642; 3 华南农业大学 林学院,广东 广州 510642)
【目的】为油茶种质资源的合理利用奠定理论基础,为油茶优良品种资源保护提供技术支持.【方法】采用SRAP分子标记对来源于江西省的25个油茶优良无性系进行遗传分析与分子鉴别.【结果和结论】11对SRAP引物组合共扩增出347个位点,其中多态性位点332个,多态性位点占比为95.68%.聚类分析结果表明,25个油茶优良无性系的遗传距离介于0.255 6~0.738 4,平均遗传距离为0.599 9,表明这些油茶无性系的地理来源相近.在遗传距离为0.528 0处,可以将25个油茶优良无性系分为5组.利用筛选出的引物构建了25个油茶优良无性系的DNA指纹图谱,每一对引物构建的指纹图谱均可以用于25个优良无性系的分子鉴别.
油茶; 优良无性系; SRAP; 遗传分析; 分子鉴别
油茶Camelliaoleifera是我国南方重要的木本油料树种,在生态经济建设中占有重要地位.近年来,在国家相关政策引导和支持下,我国的油茶产业发展迅速.但对于有些油茶边缘产区,由于未选育出油茶优良栽培品种,引进其他省区选育的并通过国家审定的优良品种成为促进本地区油茶产业快速发展的一个重要途径.随着各地区对油茶良种苗木需求的不断增加,油茶良种苗木市场在出现供不应求的同时,也出现了品系混杂、以假乱真现象.
分子标记技术为油茶的品种鉴定和遗传多样性评价提供了有力的工具.其中RAPD (Random amplified polymorphic DNA)[1-3]、ISSR(Inter-simple sequence repeat polymorphism)[4-7]和SRAP(Sequence-related amplified polymorphism)[8-13]标记技术已经成功应用于油茶种质资源遗传多样性评价、亲缘关系分析以及品种指纹图谱构建等方面的研究.油茶是重要的经济林树种之一,对其种质资源遗传多样性评价和DNA指纹图谱构建等方面的研究是基础理论研究与实际应用的桥梁,也是未来油茶关键基因定位、分子标记辅助育种等许多应用研究的理论依据和基础.本文从分子水平探讨了25个油茶优良无性系的遗传关系,构建了25个油茶优良无性系的DNA指纹图谱,本研究将为油茶种质资源的合理利用奠定基础,为油茶优良品种资源的保护提供技术支持.
1 材料与方法
1.1 试验材料
试验材料为来源于江西省的25个油茶优良无性系品种,试验材料保存于广东省林业科学研究院2007年营建的油茶种质资源收集圃,采样母树已进入投产期,树体生长健康,林分管理良好.25个优良无性系的主要经济性状参见奚如春等[14]和左继林等[15]相关文献.本试验于2012年4月开始,分别采集25个油茶优良无性系品种幼嫩枝条上的饱满嫩芽及嫩叶5~7片,标记后置于冰壶中带回实验室提取DNA.
1.2 试验仪器与试剂
试验仪器主要有:PCR仪(EDC-810型,北京东胜创新生物科技有限公司),离心机(5810R型,Eppendorf),电泳仪(CZ- 20 F型,北京市六一仪器厂),Eppendorf各量程移液器等.试验用dNTP,10×PCR buffer,TaqDNA聚合酶及100 bp DNA Ladder marker 等购自广州瑞真科技生物有限公司,琼脂糖和Gold View核酸染料购自广州鼎国生物科技有限公司,SRAP引物由上海生工合成,本研究所用引物序列见表1.

表1 本研究使用的SRAP引物序列
1.3 油茶DNA提取和SRAP-PCR扩增
使用TIANGEN DNA secure plant kit(离心柱型, DP320-03)进行油茶总DNA提取.油茶SRAP体系建立和优化参见孙佩光等[16]文献.使用六一仪器公司电泳仪(CZ- 20 F型)对PCR产物进行聚丙烯凝胶电泳,电泳时样品进样量为7 μL,加样后先用300 V低压电泳30 min,待样品全部进入聚丙烯凝胶后改用1 500 V恒压电泳3 h,硝酸银染色,氢氧化钠显色,待胶板干燥后用数码照相机拍照.
1.4 数据统计与分析方法
假定来自同一位点的同一等位基因在凝胶上迁移位置是相同的,根据电泳图片电泳条带的有无,将同一位置有扩增条带的标记为“1”,无条带的则标记为“0”,按照此方法对所有图片进行判读,结果形成0/1矩阵,使用NTSYS-pc2.10e软件计算遗传距离和相似系数,使用非加权平均法(UPGMA)进行聚类.
2 结果与分析
2.1 SRAP扩增多态性条带统计
本研究采用11对SRAP引物对25个油茶优良无性系进行了扩增,分析结果见表2.由表2可知,引物扩增条带多数集中在100~1 500 bp之间,11个引物组合共扩增到347个条带,其中多态性条带为332条,多态性条带占比为95.68%.11个引物组合扩增条带数为23~40条,其中多态性条带数为22~38条.引物组合Me9/Em17扩增条带最少,为23条,多态性条带为23条;引物组合Me6/Em16扩增条带最多为40条,其中多态性条带为38条;平均每个引物扩增条带数为31.55条,平均每个引物扩增的多态性条带为30.18条,总体而言,引物多态性比率较高.
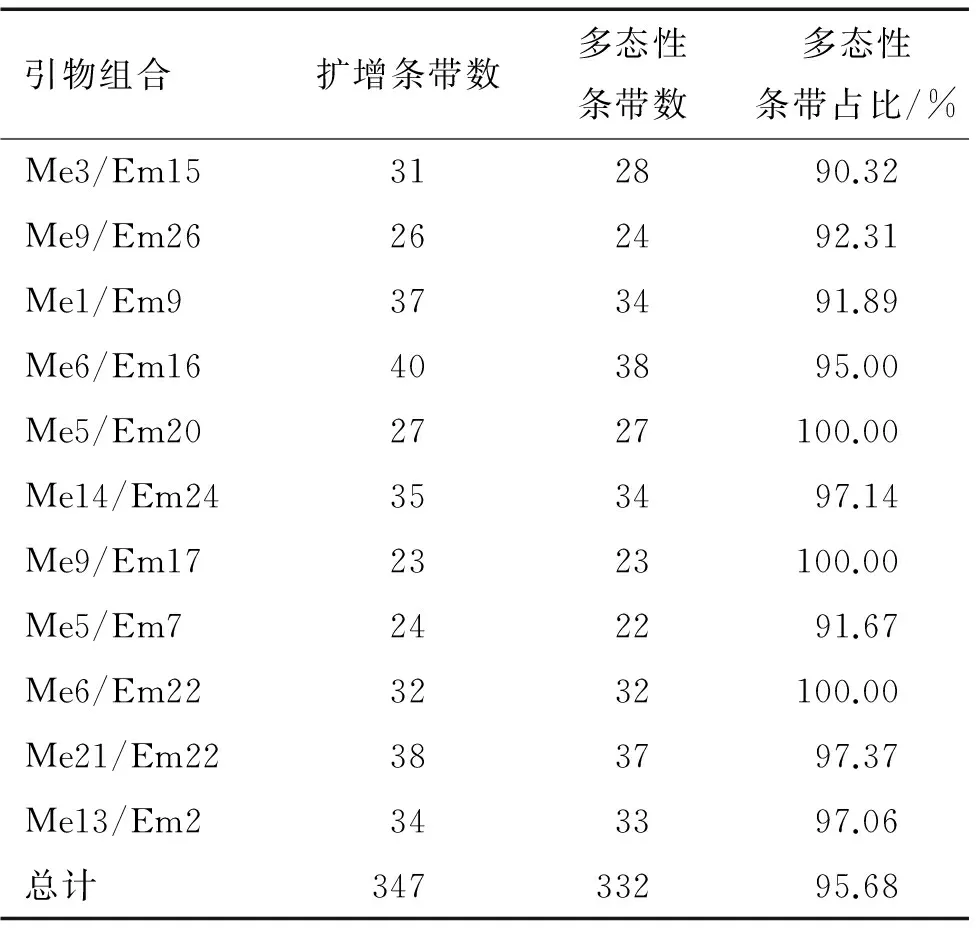
表2 引物扩增总条带与多态性条带统计
2.2 25个油茶优良无性系的聚类分析
根据SRAP标记分析结果,将25个油茶优良无性系进行聚类,从聚类分析结果(图1)可知,在遗传距离为0.528 0时,可以将25个油茶优良无性系分为5组:第1组包括赣永5、赣兴48、赣兴46和赣无15等4个油茶优良无性系;第2组包括赣永6、赣抚20、赣无2、赣无1等4个油茶优良无性系;第3组包括赣石84-3、赣石84- 8、赣55、赣6、赣无11、赣48、赣83-1、赣8、赣无16、赣83- 4、赣68、赣70、赣190、赣447等14个油茶优良无性系;第4组只包括赣71这1个油茶优良无性系;第5组包括赣无12和赣无24等2个油茶优良无性系.
从聚类结果可知,赣无11和赣48这2个油茶优良无性系的遗传距离最近,为0.256,表明这2个油茶优良无性系具有较近的亲缘关系.虽然两者在鲜出籽率、干出籽率、种仁含油量等性状上相差不大,但是这2个无性系在每平方米产油量、干出仁率、鲜果含油率、单位冠幅产油量等经济性状间存在较大差异[14-15],这说明SRAP揭示的亲缘关系与经济性状存在一定差异.
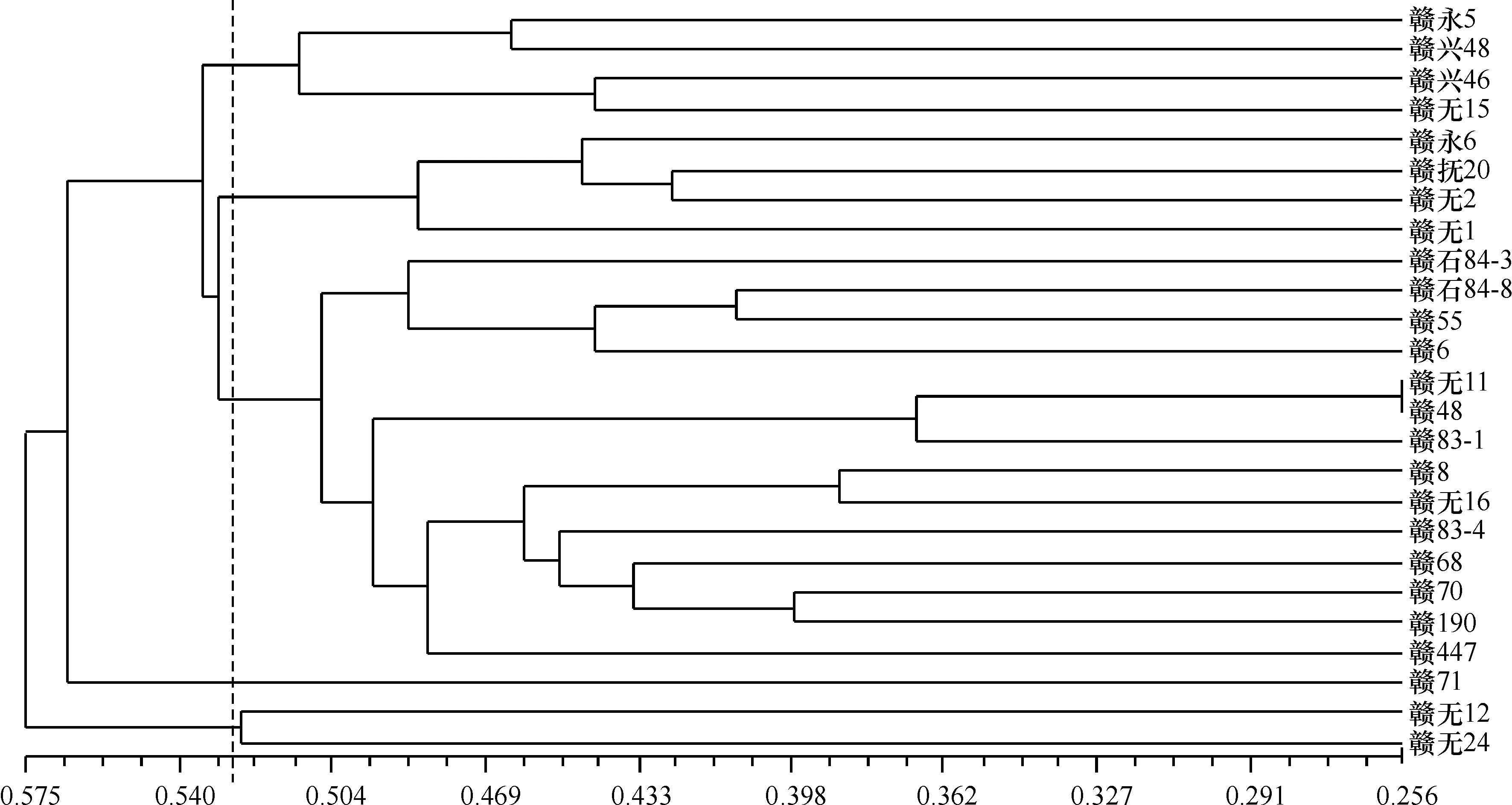
图1 25个优良无性系的UPGMA聚类图Fig.1 Genetic clustering of 25 superior clones by UPGMA
以第1组为例,分析SRAP聚类结果与经济性状聚类的差异.第1组包含赣永5、赣兴48、赣兴46、赣无15等4个无性系品种,其中赣永5和赣兴48这2个无性系品种在每平方米产油量、干出籽率、干出仁率以及鲜果含油率等性状上都比较接近,赣永5和赣兴48这2个无性系的单位冠幅产油量分别为995.4和1 148.7 kg/hm2,也比较接近,这2个无性系品种在遗传距离为0.463处聚在一起.赣兴46和赣无15这2个无性系品种在每平方米产油量、鲜出籽率、干出籽率、干出仁率、种仁含油量及鲜果含油量等性状上都比较接近[14-15],这2个无性系品种在遗传距离为0.443处聚在一起,这表明SRAP分子标记揭示的亲缘关系在一定程度上与经济性状相吻合.综上所述,SRAP分子标记在一定程度上揭示了油茶优良无性系品种间的差异和亲缘关系,SRAP分子聚类结果与经济性状的聚类结果存在一致性,但又存在一定差异,这也说明油茶遗传背景比较复杂.
2.3 25个优良品种的指纹图谱构建与分子鉴别
随机选择引物组合Me6/Em22的扩增图谱为例(图2),根据相同分子量位置上条带的有无,按照扩增图谱分子量从大到小排列,对扩增条带进行记录,形成0/1矩阵,构建25个油茶优良无性系的DNA指纹图谱(表3).由表3可知,25个油茶优良无性系品种的指纹图谱各不相同,说明各个无性系品种间在分子水平上存在明显差异,以此可以对25个油茶优良无性系进行分子鉴别.

1:赣永5;2:赣永6;3:赣兴46;4:赣兴48;5:赣抚20;6:赣无1;7:赣无2;8:赣无11;9:赣无12;10:赣无15;11:赣无24;12:赣83-1;13:赣83- 4;14:赣石84-3;15:赣石84- 8;16:赣6;17:赣8;18:赣无16;19:赣48;20:赣55;21:赣68;22:赣70;23:赣71;24:赣190;25:赣447;M:DNA marker.
图2 Me6/Em22引物组合对25个优良无性系的扩增结果
Fig.2 Amplification of 25 superior clones by Me6/Em22 primer combinations
在进行油茶优良无性系的分子鉴别时,可以分3个步骤进行.首先,构建各油茶优良无性系品种的标准DNA指纹图谱,即用一定数量的SRAP引物组合对各油茶主产区的油茶优良无性系品种进行SRAP-PCR扩增和聚丙烯凝胶电泳,以构建一定数量引物组合组成的油茶优良无性系品种的标准DNA指纹图谱库;其次,对市场上一些可疑苗木进行鉴定时,严格按照本试验操作流程,采取待检测苗木的叶片,使用相同的试验方法进行DNA提取,利用建库的若干个引物组合对待检测苗木进行SRAP-PCR扩增,并对PCR扩增产物进行聚丙烯凝胶电泳;最后,将可疑苗木的指纹图谱与油茶优良无性系品种标准DNA指纹图谱库进行比对,就可以快速判定待检测苗木是否为标准DNA图谱库中的某一无性系品种,从而实现可疑苗木的快速、准确检测与鉴定.
目前油茶优良无性系的苗木繁育多采用芽苗砧接的方法进行,嫁接苗与母本在分子水平上具有相同的DNA遗传特性,因此利用该方法进行油茶无性系的品种鉴定是可行的.当然,在计算机技术普及的今天,完全可以借助计算机技术实现待检测苗木的指纹图谱、电泳图谱与油茶优良无性系品种标准DNA指纹图谱、电泳图谱的快速准确比对工作.

表3 25个油茶优良无性系的DNA指纹图谱1)Tab.3 DNA fingerprinting of 25 superior clones of Camellia oleifera
1)表中的25个油茶优良无性系品种的DNA指纹图谱依据引物组合Me6/Em22的扩增结果构建.
3 讨论与结论
本研究使用11对SRAP引物组合对25个来源于江西省的油茶优良无性系进行了扩增,共检测到347个位点,其中332个为多态性位点,多态性位点的占比高达95.68%,说明这25个油茶优良无性系群体存在丰富的遗传变异.林萍等[8]、左雪枝等[12]也证实SRAP分子标记能够揭示油茶群体较高的遗传多样性.由于研究群体、分子标记种类、试验方法等方面的差异,关于油茶遗传多样性的研究结果不尽相同.张云[3]使用19条RAPD引物对福建省的42份油茶材料进行扩增,共扩增出159个条带,其中94个为多态性条带,多态性条带占比为59.12%.黄永芳等[2]使用18条RAPD引物对90个来源于湖南、广西等省的油茶优良无性系进行扩增,共扩增出593条谱带,其中564条为多态性谱带,多态性谱带占比为95.11%.一些学者利用ISSR标记评价油茶遗传多样性时发现,ISSR引物扩增条带数目为3~24条,多态性条带占比介于68.6%~92.56%[4-5,7].彭绍锋等[9]、韩欣等[11]利用SRAP标记的8对引物组合对14个油茶优良品种进行了扩增,共扩增出65个条带,其中多态性条带22个,多态性条带占比为33.85%,这与本研究结果相差较大.本文和林萍等[8]的研究均采用聚丙烯凝胶电泳分析,而彭绍锋等[9]使用的是琼脂糖电泳分析,可能是由于琼脂糖凝胶的分辨率较低,从而导致多态性条带比例较低.
利用SRAP分子标记在遗传距离为0.528 0处,可以将25个油茶优良无性系分为5组,SRAP聚类结果在某些品种间表现出一致性,但总体来说SRAP聚类结果表明各无性系品种未聚成具有规律性的大类,王保明等[5]和温强等[6]的研究也得出相似结论.一方面说明油茶群体的遗传背景比较复杂,SRAP标记可能与这些经济性状间的关联程度不大;另一方面可能由于油茶长期的异花授粉,导致油茶群体内遗传分化严重,存在较高的遗传多样性.本研究的25个油茶优良无性系的遗传距离介于0.255 6~0.738 4之间,平均遗传距离为0.599 9,说明这些油茶的地理来源较近.实际上,这些油茶优良无性系是江西省林科所的科研工作者从江西省境内油茶群体中选育出的平均单位冠幅产油量都超过750 kg/hm2的高产油茶优良无性系品种[15,17].
本研究利用筛选出的11对SRAP引物组合构建了25个油茶优良无性系的DNA指纹图谱,可以实现25个油茶优良无性系的分子鉴别.张国武等[4]利用ISSR标记形成的0/1矩阵数据可以将10个油茶优良无性系鉴别,温强等[6]指出利用ISSR标记形成的0/1矩阵数据可以一次性鉴别19~25个优良无性系,不同引物间互相搭配可以实现25个优良无性系的鉴别.王保明等[5]利用ISSR引物形成的0/1矩阵可以有效鉴别湖南省的23个油茶优良无性系.林萍等[8]筛选出13对SRAP引物组合,每一个引物组合都可以将长林系列的12个油茶优良无性系进行鉴别,此外还找到了某些优良无性系的特异性条带.笔者筛选出11对SRAP引物组合,利用每一对引物组合的0/1数据矩阵都可以实现25个油茶优良无性系的有效鉴别.在研究过程中我们也发现了一些品种的特异性条带,但由于特异性条带的数目较少,利用价值非常有限.在使用SRAP标记对油茶优良品种鉴定时,由于SRAP标记提供的信息量非常丰富,若仅选用某些品种的特异性条带对油茶优良无性系进行分子鉴别,无疑舍弃了大量有用的信息,容易出现误判的现象.将待检测苗木的DNA指纹图谱、电泳图谱与油茶优良无性系的标准DNA指纹图谱库、电泳图谱库相比对,可以充分利用SRAP标记提供的丰富的信息,准确判断待测苗木是否为某一油茶优良无性系品种,通过进一步的优化,这些比对工作完全可以借助计算机软件瞬间完成,这也是未来油茶品种鉴别和品种审定的发展趋势.
[1]陈永忠,张智俊,谭晓风.油茶优良无性系的RAPD分子鉴别[J].中南林学院学报,2005,25(4):40- 45.
[2]黄永芳,陈锡沐,庄雪影,等.油茶种质资源遗传多样性分析[J].林业科学,2006,42(4):38- 43.
[3]张云.油茶遗传多样性及遗传性状的RAPD分析[D].福州:福建师范大学,2003.
[4]张国武,钟文斌,乌云塔娜,等.油茶优良无性系ISSR分子鉴别[J].林业科学研究,2007,20(2): 278- 282.
[5]王保明,陈永忠,谭晓风,等.应用ISSR分析油茶无性系的遗传多样性[J].东北林业大学学报,2008,36(6):19- 24.
[6]温强,雷小林,叶金山,等.油茶高产无性系的ISSR分子鉴别[J].中南林业科技大学学报:自然科学版,2008,28(1):39- 43.
[7]于小玉,喻方圆,刘建兵,等.ISSR在油茶品种鉴别和遗传多样性分析中的应用[J].南京林业大学学报:自然科学版,2013,37(1):61- 66.
[8]林萍,姚小华,王开良,等.油茶长林系列优良无性系的SRAP分子鉴别及遗传分析[J].农业生物技术学报,2010,18(2):272- 279.
[9]彭邵锋,张党权,陈永忠,等.14个油茶良种遗传多样性的SRAP分析[J].中南林业科技大学学报:自然科学版,2011,31(1):80- 85.
[10]张婷,刘双青,梅辉,等.湖北省油茶资源遗传多样性的SRAP分析[J].华中师范大学学报:自然科学版,2011,45(3):477- 479.
[11]韩欣,张党权,王志平,等.基于SRAP的赣南油茶良种分子鉴别研究[J].中南林业科技大学学报:自然科学版,2012,32(3):147-151.
[12]左雪枝.SRAP标记技术优化与湖北油茶遗传多样性研究[D].武汉:华中农业大学, 2012.
[13]黄勇.基于SRAP分子标记的小果油茶遗传多样性分析[J].林业科学,2013,49(3):43-50.
[14]奚如春,龚春,黄宝祥,等.赣25个油茶高产无性系的脂肪酸组成及遗传变异的初步研究[J].江西林业科技,2002(4):14-16.
[15]左继林,龚春,汪建平,等.赣油茶25个优良无性系品质评价[J].浙江林学院学报,2008,25(5):624- 629.
[16]孙佩光,奚如春,钮世辉,等.油茶SRAP-PCR反应体系的建立和优化[J].基因组学与应用生物学,2010,29(6):1192-1199.
[17]奚如春,邓小梅,龚春,等.高亚油酸含量油茶优良无性系的选育[J].林业科学研究,2006,19(2):158-164.
【责任编辑李晓卉】
Geneticanalysesandmolecularidentificationof25superiorclonesofCamelliaoleifera
SUN Peiguang1,2, XI Ruchun2,3, Li Juncheng2,3, OUYANG Kunxi2,3, ZHONG Yanmei2,3, CHEN Xiaoyang2,3
(1 Haikou Experimental Station, Chinese Academy of Tropical Agricultural Sciences/Hainan Provincial Key Laboratory for Genetics and Breeding of Banana, Haikou 570102, China; 2 State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources/Guangdong Key Laboratory for Innovative Development and Utilization of Forest Plant Germplasm, South China Agricultural University, Guangzhou 510642, China; 3 College of Forestry, South China Agricultural University, Guangzhou 510642, China)
【Objective】This study aimed to lay a theoretical foundation for rational use ofCamelliaoleiferagermplasm resource and provide technical support for the conservation of eliteC.oleiferavarieties.【Method】SRAP molecular markers were used to assess the genetic diversity and molecular identification of 25 superior clones ofC.oleiferafrom Jiangxi Province.【Result and conclusion】Three hundred ard forty seven sites were amplified by 11 primer combinations of SRAP, among which 332 were polymorphic sites.The percentage of polymorphic sites was 95.68%.The result of cluster analysis indicated that the genetic distance of the 25 superior clones ranged from 0.255 6 to 0.738 4, and the average genetic distance was 0.599 9, indicating that these cultivars had similar geographical origins.The 25 superior clones were divided into five groups by cluster analysis according to genetic distance 0.528 0.DNA fingerprints of the 25 superior clones were constructed using the screened primer combinations.The fingerprint constructed by each primer combination can be used for molecular identification of the 25 superior clones.
Camelliaoleifera; superior clone; SRAP; genetic analysis; molecular identification
2013- 08- 02优先出版时间2014- 09- 30
优先出版网址:http:∥www.cnki.net/kcms/doi/10.7671/j.issn.1001-411X.2014.06.016.html
孙佩光(1980—),男,助理研究员,博士,E-mail:sunpeiguang888@sina.com; 通信作者:陈晓阳(1958—),男,教授,博士,E-mail:xychen@scau.edu.cn
广东省自然科学基金团队项目 (9351064201000002);广东省林业科技创新专项(2012KJCX011-02)
孙佩光, 奚如春, 李俊成,等.25个油茶优良无性系的遗传分析与分子鉴别[J].华南农业大学学报,2014,35(6):83- 88.
S727.32
A
1001- 411X(2014)06- 0083- 06
