基于单片段代换系的水稻抽穗期QTL上位性研究
2014-08-31杨自凤朱海涛刘自强曾瑞珍傅雪琳陈雄辉张桂权金玲玲刘桂富
杨自凤, 朱海涛, 刘自强, 曾瑞珍, 傅雪琳, 陈雄辉, 张桂权, 金玲玲,刘桂富
(1 华南农业大学 农学院/广东省植物分子育种重点实验室,广东 广州 510642;2 华南农业大学 理学院,广东 广州 510642)
基于单片段代换系的水稻抽穗期QTL上位性研究
杨自凤1, 朱海涛1, 刘自强1, 曾瑞珍1, 傅雪琳1, 陈雄辉1, 张桂权1, 金玲玲2,刘桂富1
(1 华南农业大学 农学院/广东省植物分子育种重点实验室,广东 广州 510642;2 华南农业大学 理学院,广东 广州 510642)
【目的】探索水稻抽穗期的遗传机制.【方法】以华粳籼74的8个单片段代换系为材料,构建了7个聚合了双QTL的次级F2作图群体,并通过分子标记的选择区分出每个群体的9种基因型以估算水稻抽穗期QTL的各类上位性分量.【结果和结论】除QTLHD3/HD8间的上位性互作不显著外,其他QTL对均存在显著的上位性效应,占85.7%;在检测的28个不同类型的上位性效应中,有60.7%的估计值达到5%或1%的显著水平,其中加加、加显或显加、显显上位性分别占71.3%、42.8%、85.6%.研究结果进一步证实了上位性作用在数量性状遗传体系中的普遍性和重要性,并为水稻抽穗期的分子聚合育种提供了依据和材料.
上位性; QTL; 单片段代换系; 抽穗期; 水稻
抽穗期是水稻重要的农艺性状之一,抽穗期的早迟直接决定了水稻品种的地区适应性和季节适应性,关系到水稻的产量和品质,因而在水稻种植和引种上具有重要的意义[1].水稻抽穗期是复杂的数量性状,受多基因控制,遗传机制表现为除受加性、显性作用外,还普遍存在着上位性互作,且对环境敏感[2],因而了解水稻抽穗期的遗传基础存在着较大的难度.QTL的上位性是探索复杂数量性状遗传机制和进行分子设计育种首先必须解决的难题[3-6].已有大量的研究报道了水稻抽穗期QTL的上位性[2,7-14],但这些研究多是利用常规的初级作图群体,个体或品系间存在着较大的遗传背景差异,因而所估算的上位性是有偏的[15].广东省植物分子育种重点实验室经过十几年的努力,已成功培育出1 529个水稻SSSLs,并用这些材料进行了QTL鉴定、定位、克隆、功能分析和聚合等研究[16-18].赵芳明等[19]估算了水稻株高、水稻粒型和产量相关性状的加-加上位性.李晓燕[20]和黄卓娆[21]报道了水稻抽穗期QTL的加-加上位性.Liu 等[22]和Ying等[23]分别报道了水稻单株分蘖数和穗数QTL的显-显上位性.这些研究为揭示数量性状遗传基础和进行分子聚合育种奠定了一些基础,但由于受制于材料的聚合,均未能同时估算QTL的各类上位性分量,因而其作用是有限的.本研究通过从F2群体中筛选出双片段聚合的不同类型材料,同时估算出水稻抽穗期双QTL的加-加,加-显或显-加,以及显-显上位性分量,以弥补上述研究的不足.
1 材料与方法
1.1 材料
受体亲本华粳籼74(HJX74),由广东省植物分子育种重点实验室培育的优良籼稻品种; 8个SSSLs,其替换片段来源于不同的供体,这些替换片段上携带有抽穗期QTLs.已有研究表明这8个SSSLs分别携带有HD QTL,并发现它们与一些已知的抽穗期QTL是等位的[20- 23],故本研究给予这些QTL与已知QTL相同的名称,当超过1个QTL时则后加序列号(表1).

表1 8个单片段代换系(SSSLs)的基本信息Tab.1 The basic information of 8 single segment substitution lines (SSSLs)
1.2 田间试验和抽穗期考察
田间试验在华南农业大学校内教学实验农场进行.试验分早、晚两季,早季为3—7月份,晚季8—12月份.种子萌发后均匀撒播至苗床上,20 d后移到大田,种植密度16.7 cm×16.7 cm, 每穴1株,常规的田间管理.于2012年晚季两两杂交,获得单片段杂合(HJX74×SSSL)和双片段杂合(SSSLi×SSSLj)种子.2013年早季种植其中的7个杂交组合,通过目标区域分子标记的检测严格区别真假杂种株,在真杂种株上收集F2种子.2013年晚季种植F2群体,每个群体约400个单株.抽穗期考察以每株主穗见穗为始穗标准,记录播种到始穗的天数.于苗期检测各单株目标区域标记基因型,考察记录各单株的抽穗期.亲本及F1材料考查中央20个单株的抽穗期,F2群体考察所有单株的抽穗期.
1.3 统计分析
1.3.1 试验误差估计 将7个F2群体中所有材料按不同基因型作单向分组,按不平衡数据进行方差分析,统计模型为yij=μ+Gi+eij,其中y、μ、G、e依次为表型值、平均数、基因型值、误差,下标i,j分别为基因型、观测值的序号.用限制性最大似然法(Restricted maximum likelihood, REML) 估算方差分量.方差分析由数量性状分析软件QTModel 0.70Beta执行(http:∥ibi.zju.edu.cn/software/qtmodel/index.html).1.3.2 QTL效应估计 基于HJX74为起点的加性-显性-上位性遗传模型,可分别估算各QTL的单位点效应[即加性效应(a)和显性效应(d)]及双位点互作效应[即上位性效应(e)],采用LSD法测验估计值的显著性.有关的公式如下:
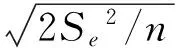

式中,P为亲本华粳籼74的抽穗期,Si、Si′、Dkl、Sk、Sl分别代表不同基因型的平均抽穗期,S、D分别为单片段代换系和双片段聚合系,i、i′分别为单片段的纯合体和杂合体,k、l则可以是单片段的纯合体或杂合体,tα、Se2分别是误差自由度下的临界t值和误差方差,n是所有基因型个体的平均数.
2 结果与分析
2.1 F2作图群体抽穗期的频率分布
为检测这8个SSSLs的HD QTL是否存在两两之间的上位性互作,本研究选配了一些双QTL的杂交组合,各自自交后产生F2群体,考察各群体内的个体抽穗期,制成次数分布图.结果(图1)表明,一些亲本间抽穗期的差异较大,如S1-S5,S2-S5,S3-S5和S4-S6,其余的差异则较小; F2个体抽穗期均出现超亲分离,证实亲本基因是分散分布的.由于每对亲本均只有2对独立基因的差异,因而每个F2群体均只有9种基因型,抽穗期表型按1AA∶2Aa∶1aa或1BB∶2Bb∶1bb的理论比例分离,形成一个近似的正态分布,但实际上F2表型的分离属偏正态分布(图1),这可能因为等位基因或非等位基因间存在互作,或者是选择压导致某类基因型个体数偏小的缘故.当将所有F2群体混合时,则共有8对基因分离,次数分布图基本做成正态分布,方差分析表明基因型间的变异极显著大于试验误差.
2.2 SSSLs携带有HD QTL的证实
比较各SSSL的纯合体和杂合体与HJX74的平均抽穗期,分别估得对应QTL的加性效应和显性效应(表2).显著性测验表明,除QTLEhd1-2的加性效应不显著外,其余的加性效应和显性效应均达显著水平.这个结果证实,这些SSSLs确实携带有HD QTLs.QTLEhd1-2的加性效应不显著或许因为该QTL的表达是环境敏感的.进一步分析发现,HD3、OsMADS50-1和OsMADS50-2的加性效应和显性效应是负值,表明来源于供体的等位基因有助于提早抽穗,将使HJX74提早2.1~7.4 d 抽穗;其他QTL的外源基因将使HJX74延迟抽穗0.7~11.7 d .此外,QTL的显性效应接近或超过加性效应,表明它们是完全显性或超显性遗传的,通过组配可获得期望抽穗期的杂种优势.
2.3 HD QTL上位性的估计
采用分子标记辅助选择区分7个双QTL的 9 种基因型,通过比较双QTL效应与各自2个单QTL效应和的偏差,分别估算了这 7 对QTL的4种上位性分量,即加-加(aa),加-显(ad),显-加(da)和显-显(dd)上位性.结果(表3)表明,QTLHD3/HD8互作不显著,而其他QTL对存在着显著的上位性效应;在检测的 28个上位性中,共有17个估计值达到5%或1%的显著水平,占60.7%,这充分证实上位性是普遍存在的.

图1 2个单片段代换系(Si)F2群体抽穗期的次数分布图(箭头所指为亲本抽穗期)Fig.1 Frequency distributions on heading date in each F2 population derived from two SSSLs (Si)
表2水稻抽穗期QTL加性、显性效应的估计值1)
Tab.2EstimationsofadditiveanddominanteffectsofQTLofriceheadingdated

QTLs加性效应显性效应HD3-2.1*-2.2*OsMADS50-1-3.2**-2.5**OsMADS50-2-6.0**-7.4**Hd12.2*6.3**HD810.9**11.7**OsLHY10.9**9.7**Ehd1-17.6**5.3**Ehd1-20.73.1**
1) 负号表示供体基因提早抽穗;“*”和“**”分别表示达到5%和1%的显著水平.
从QTL组合来看:1)一个QTL可以与多个其他QTL发生互作,如QTLOsMADS50-1与QTLHD8、Ehd1-2均有显著的互作;2)一个QTL即使没有单位点效应(加性或显性效应),发生上位性也是可能的,如QTLEhd1-2的加性效应不显著,但QTLHd1/Ehd1-2却有显著的加加上位性;3)一个QTL与其他QTL的互作方式有所不同,如QTLHD8的加性表达不影响QTLHD3的加性效应,但却负调控QTLOsMADS50-1、正调控QTLOsMADS50-2的加性效应;4) 2个QTL效应的大小、方向与其上位性的大小、方向并无直接的关联,如QTLHD8的加性效应为10.9 d,QTLHD3、OsMADS50-1、OsMADS50-2的加性效应依次为-2.1、-3.2、-6.0(表2),而QTLHD8与三者的加-加上位性则依次为0.6、-6.4、5.9(表3),即异方向QTL聚合的上位性有正有负、大小各异,同方向QTL聚合的上位性情形类似.可见,QTL 的上位性互作是复杂的.
表3水稻抽穗期成对QTL上位性效应的估计值1)
Tab.3EstimatedepistaticeffectsofpairQTLofriceheadingdated

QTLsaaaddaddHD3/HD80.6-1.80.8-0.9OsMADS50-1/HD8-6.4**-5.8**0.7-3.6**OsMADS50-1/Ehd1-20.1-2.6*1.1-3.1*OsMADS50-2/HD85.9**1.45.9**3.0*Hd1/OsLHY2.5*-0.4-6.2**-4.9**Hd1/Ehd1-23.3**-1.2-1.4-4.0**Ehd1-1/OsLHY-3.0*-3.7**-4.0**-4.1**
1)aa、ad、da和dd分别表示加-加、加-显、显-加和显-显上位性;负号表示供体基因互作提早抽穗;“*”和“**”分别表示达到5%和1%的显著水平.
从QTL上位性分量来看:1)显著的上位性以dd最多(占85.6%),aa其次(71.3%),ad或da最少(42.8%),表明显-显和加一加上位性更为普遍;2)除QTLOsMADS50-2/HD8外,所有显著的dd、ad或da均表现为负值,表明涉及到有显性效应参与的上位性有助于提早抽穗;3) 3 类上位性aa、ad/da、dd的平均值±标准误依次为(0.4±1.6)、(1.2±0.9)、(-2.5±1.0) d,表明显-显上位性的作用大(平均数大),且比较稳定(标准误小),其次为加-显或显-加上位性,亦比较稳定,加-加上位性较小,但变异大.
3 讨论
3.1 QTL上位性的普遍性
多基因遗传体系是复杂的网络结构,基因的表达往往受到其他基因的调控,因而上位性是不可避免的[24].Eshed等[25]报道在番茄的45个双染色体片段组合中有20%~48%的组合涉及到5个产量相关性状的显-显上位性;日本的Yano团队检测到8个水稻抽穗期QTL两两之间的加-加上位性[7];国内亦有许多关于QTL上位性的报道[9-10, 12-13,16,26-27].Liu等[22]和Ying等[23]曾报道在66个双QTL组合中,分别有89%和54.5%的组合涉及到水稻分蘖数和穗数QTL的显-显上位性.本研究发现,7对双片段聚合系中有6个组合(占85.7%)与水稻抽穗期QTL的上位性有关,其中加-加、加-显/显-加、显-显上位性依次占71.3%、42.8%、85.6%.高频率出现的上位性进一步证实它在复杂数量性状遗传中的重要地位.
3.2 QTL上位性的分析方法
用近等基因系分析QTL的上位性被认为是最有效的手段之一.前人[22-23,25]用2个QTL近等基因系杂交聚合双位点杂合体的方法分析了QTL的显-显上位性;赵芳明等[19]通过用2个QTL近等基因系构建次级F2群体并从中挑选双QTL聚合系的方法发现了QTL的加-加上位性.采用分子标记检测F2所有个体来区别基因型,工作量大、花费昂贵、找齐9种基因型的难度大,而且F2群体不能被重复利用.对此研究方法的改进是先培育双QTL聚合系(DSSL),再用受体、2个SSSLs和DSSL 为杂交亲本构建1个包含了 9 种基因型的半双列杂交群体,可同时估算双QTL的加-加、加-显、显-加和显-显 4 种上位性分量.这样做避免了分子标记的检测工作,易获得 9 种基因型,且可重复利用亲本和F1种子.
3.3 HD QTL上位性的意义
目前至少有618个水稻抽穗期QTL被贮存在Gramene QTL 数据库中 (http:∥www.gramene.org/qtl/),且有不少被克隆[7,28-31],通过设计育种一些HD QTL正在被聚合.实践表明,多个QTL聚合后的效应并非是单个QTL效应的代数和,而是普遍存在着上位性互作.因此,一个QTL能否被用于聚合育种,上位性起着至关重要的作用.当上位性不显著、或与 2 个QTL效应方向相同、或尽管与 2 个QTL效应相反但效应值较小,这 2 个QTL可考虑用于分子聚合育种.例如,本研究的2个迟熟基因Hd1(2.2 d)/OsLHY(10.9 d)的纯合体聚合后,因其上位性为2.5 d,因此可期望延迟抽穗期15.6 d(>13.1 d).另一方面,不同类型的上位性为不同种类材料(纯合体或杂合体)聚合提供了依据.此外,上位性研究有利于察觉2个QTL的上、下游关系,揭示水稻抽穗开花的机制,有关这方面的研究仍在探索中.
致谢:感谢华南农业大学测试中心王晓老师给予的支持和帮助!
[1]熊振民,蔡洪法.中国水稻[M].北京:中国农业科技出版社,1992:143-144.
[2]LI Z K, YU S B, LAFITTE H R, et al.QTL×environment interactions in rice: I: Heading date and plant height[J].Theor Appl Genet, 2003, 108(1): 141-153.
[3]PELEMAN J D, VAN DER VOORT J R.Breeding by design[J].Trends Plant Sci ,2003,8(7):330-334.
[4]WANG Y H, XUE Y B, LI J Y.Towards molecular breeding and improvement of rice in China[J].Trends Plant Sci, 2005,10:610-614.
[5]万建民.作物分子设计育种[J].作物学报, 2006,32(3):455-462.
[6]王建康.PFEIFFER W H.植物育种模拟的原理和应用[J].中国农业科学, 2007,40(1):1-12.
[7]YAMAMOTO T, LIN H, SASAKI T, et al.Identification of heading date quantitative trait locusHd6, and characterization of its epistatic interaction withHd2 in rice using advanced backcross progeny[J].Genetics, 2000,154: 885-891.
[8]YU S B, LI J X, XU C G, et al.Identification of quantitative trait loci and epistatic interactions for plant height and heading date in rice[J].Theor Appl Genet,2002,104(4): 619-625.
[9]袁爱平,曹立勇,庄杰云,等.水稻株高、抽穗期和有效穗数的QTL与环境的互作分析[J].遗传学报, 2003, 30(10):899-906.
[10]高用明,朱军,宋佑胜,等.水稻永久F2群体抽穗期QTL的上位性及其与环境互作效应的分析[J].作物学报,2004,30(9):849-854.
[11]LIU G F, YANG J, XU H, et al.Influence of epistasis and QTL × environment interaction on heading date of rice (OryzasativaL.) [J].J Genet Genomics,2007, 34(7): 608-615.
[12]张永生,刘喜,江玲,等.利用南京11×越光RIL群体进行抽穗期QTL定位分析[J].江苏农业学报, 2009,25(1): 6-12.
[13]雷东阳,陈立云.水稻抽穗期QTLs的检测及上位性和环境互作效应[J].湖南农业大学学报:自然科学版,2010, 36(3):245-249.
[14]戴高兴.超级杂交稻协优9308重组自交系抽穗期QTL定位及其与产量性状关系的研究[D].北京: 中国农业科学院,2012.
[15]ESHED Y, ZAMIR D.An introgression line population ofLycopersiconpennelliiin the cultivated tomato enables the identification and fine mapping of yield-associated QTL [J].Genetic, 1995,141(3): 1147-1162.
[16]姚方印.基于SSSL 的水稻抽穗期QTL 的鉴定及上位性分析[D].广州:华南农业大学,2006.
[17]郭奕生.基于SSSL的水稻抽穗期QTL的鉴定和定位[D].广州:华南农业大学,2008.
[18]杨子龙.基于单片段代换系水稻高产、优质、抗病分子设计育种[D].广州: 华南农业大学,2012.
[19]赵芳明,张桂权,曾瑞珍,等.利用单片段代换系研究水稻产量相关性状QTL加性及上位性效应[J].作物学报,2012,38(11):2007-2014.
[20]李晓燕.水稻抽穗期基因座等位基因变异及上位性分析[D].广州:华南农业大学,2010.
[21]黄卓娆.水稻抽穗期基因座等位基因和籼粳分化候选基因的序列分析[D].广州:华南农业大学,2012.
[22]LIU G F, ZHU H T, ZHANG G Q,et al.Dynamic analysis of QTLs on tiller number in rice (OryzasativaL.) with single segment substitution lines[J].Theor Appl Genet,2012, 125(1):143-153.
[23]YING Y Q, ZHU H T, YE G Y, et al.Detection of QTL on panicle number in rice (OryzasativaL.) under different densities with single segment substitution lines[J].Euphytica, 2014,195(3):355-368.
[24]GAO Y M, ZHU J.Advance on methodology of QTL mapping for plants[J].Hereditas, 2000,22 (3):175-179.
[25]ESHED Y, ZAMIR D.Less-than-additive epistatic interactions of quantitative trait loci in tomato[J].Genetics,1996,143(4): 1807-1817.
[26]陈爱华,柳絮,李广贤,等.水稻抽穗期基因上位性互作分析[J].山东农业科学,2012,44(6):13-16.
[27]李广贤,柳絮,徐仅婷,等.基于单片段代换系的水稻抽穗期 QTL 定位及上位性分析[J].山东农业科学,2013, 45( 5):30-34.
[28]DOI K, IZAWA T, FUSE T, et al.Ehd1, a B-type response regulator in rice, confers short-day promotion of flowering and controlsFT-like gene expression independently ofHd1[J].Genes & Development, 2004, 18(8): 926-936.
[29]MATSUBARA K, YAMANOUCHI U, WANG Z X, et al.Ehd2,a rice ortholog of the maizeINDETERMINATE1 gene, promotes flowering by up-regulatingEhd1[J].Plant Physiol, 2008,148(3):1425-1435.
[30]XUE W Y, XING Y Z, WEN X Y, et al.Natural variation inGhd7 is an important regulator of heading date and yield potential in rice[J].Nat Genet,2008,40(6):761-767.
[31]周勇,崔国昆,张言周,等.水稻抽穗期主效QTLqHd8.1的精细定位[J].中国水稻科学, 2012,2 6( 1): 43-48.
【责任编辑周志红】
EpistaticanalysisoftheQTLonheadingdateinriceusingsinglesegmentsubstitutionlines
YANG Zifeng1, ZHU Haitao1, LIU Ziqiang1, ZENG Ruizhen1, FU Xuelin1, CHEN Xionghui1, ZHANG Guiquan1,JIN Lingling2, LIU Guifu1
(1 College of Agriculture, South China Agricultural University/Guangdong Key Lab of Plant Molecular Breeding, Guangzhou 510642, China; 2 College of Sciences, South China Agricultural University, Guangzhou 510642, China)
【Objective】 To explore the genetic basis on heading date in rice.【Method】 Eight single segment substitution lines of Huajingxian 74 were applied as experimental materials to construct seven secondary F2populations pyramiding dual QTL, in each of which nine marker genotypes were distinguished to allow estimations of epistatic components for the QTL pairs.【Result and conclusion】 All QTL pairs tested, except for QTLHD3 andHD8, exhibited significantly epistatic effects, accounting for 85.7%.There were 60.7% of 28 epistatic components to be detected with significant estimations at the probability levels of 5% or 1%, where three types of epistatic interactions, e.g.additive-additive, additive-dominance or dominance-additive, and dominance-dominance epistatic effects accounting for 71.3%, 42.8% and 85.6%, respectively.These results further confirmed that the universality and the importance of epistasis existed in genetic systems of quantitative traits, providing useful frames and materials for molecular marker assisted pyramiding breeding on heading date in rice.
epistasis; QTL; single segment substitution lines; heading date; rice
2014- 01- 12优先出版时间2014- 09-30
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20141003.1227.015.html
杨自凤(1989—),女,硕士研究生;通信作者:金玲玲(1964—),女,副教授,硕士,E-mail:jinlingling@scau.edu.cn;刘桂富(1963—),男,副教授,博士,E-mail: guifuliu@scau.edu.cn
NSFC-广东联合基金重点项目(U1031002);广东省自然科学基金(S2013010012939); 亚热带农业生物资源保护与利用国家重点实验室开放课题(SKL-CUSAb-2013-07)
杨自凤, 朱海涛, 刘自强,等.基于单片段代换系的水稻抽穗期QTL上位性研究[J].华南农业大学学报,2014,35(6):24- 28.
S511; S502
A
1001- 411X(2014)06- 0024- 05
