洛克沙胂暴露对土壤微生物碳代谢功能多样性的影响
2014-08-31郭瑞子孙永学
张 草, 白 玲, 郭瑞子, 马 驿, 孙永学
(1 华南农业大学, 国家兽药安全评价(环境评估)实验室,广东 广州 510642;2 广东海洋大学 动物医学系,广东 湛江 524088)
洛克沙胂暴露对土壤微生物碳代谢功能多样性的影响
张 草1, 白 玲1, 郭瑞子1, 马 驿2, 孙永学1
(1 华南农业大学, 国家兽药安全评价(环境评估)实验室,广东 广州 510642;2 广东海洋大学 动物医学系,广东 湛江 524088)
【目的】运用Biolog法分析洛克沙胂作用下的土壤微生物群落碳代谢多样性,以揭示洛克沙胂在环境中残留对土壤微生物学性状的影响.【方法】采集新鲜土壤加入不同质量浓度的洛克沙胂溶液混匀,使药物质量分数(以As计)分别为:低质量分数组15 mg·kg-1、中质量分数组75 mg·kg-1、高质量分数组150 mg·kg-1,放置在室温(20~25 ℃)下培养,于处理后第1、2、3、5、8周分别采取培养土壤,用Biolog法进行分析.【结果和讨论】洛克沙胂对土壤微生物群落碳代谢功能影响显著,且存在一定的剂量依赖效应.经主成分分析,第1周,洛克沙胂低质量分数组(w=15 mg·kg-1)土壤微生物群落多样性和对照组差异不明显,第2、3、5、8周,各组土壤微生物群落碳代谢类型差异显著,其中高质量分数组(w=150 mg·kg-1)与对照组差异最大.结果表明,洛克沙胂可致土壤微生物群落碳代谢能力与多样性改变,胁迫浓度越高其作用越强.同时,洛克沙胂对土壤微生物群落碳代谢能力与多样性的影响还表现出时间差异,在暴露胁迫的后期(第5、8周),洛克沙胂的影响逐步减弱,可能与洛克沙胂在土壤中发生化学结构改变和降解有关.
洛克沙胂; 土壤微生物群落; 功能多样性; 微生物碳源利用率
洛克沙胂(Roxarsone)是一种有机胂类化合物,作为畜禽专用抗菌、促生长的饲料添加剂已在我国得到广泛使用,研究表明,畜禽摄入有机胂添加剂后在胃肠道吸收少、体内蓄积时间很短、残留量低,80%~90%以原形通过粪便排泄到体外.一个养殖规模为2亿羽肉鸡场,每年向环境排放8 t以上的砷[1].洛克沙胂污染土壤后使其质量降低,农作物产量减少,最终经过土壤物质循环降解可能转化成无机砷形式而造成更严重的危害,对人类的健康形成了很大的潜在风险.
土壤是一个非常复杂的生态系统,土壤微生物是土壤生态系统的重要组成部分,它在分解有机质和循环利用养分的过程中发挥着关键的作用[2-3].近年来以生物化学为基础的测定方法(微生物醌法,脂肪酸法等)和分子生物学方法(PCR-RFLP,TGGE,DGGE 等)相继得到了广泛应用[4- 8],其中,Biolog法已成为研究微生物功能多样性的重要工具,它为土壤微生物群落研究提供了一种更为简单、快速的方法[9-10],而且无需分离培养纯种微生物,并可最大限度地保留微生物群落原有的代谢特征.本试验通过研究不同质量浓度洛克沙胂对土壤微生物碳代谢功能的影响,揭示了洛克沙胂暴露胁迫对土壤微生物学性状的影响,为评估和监控洛克沙胂对土壤环境的早期污染和生态毒理学效应提供理论依据.
1 材料与方法
1.1 材料
洛克沙胂原料药,质量分数为98.5%,为广州惠华动物保健品有限公司产品.土壤采自华南农业大学试验田20~100 cm 土层的匀质土壤,质细,色深,基本理化性状为:有机碳(48.35±3.52) g·kg-1,总氮(2.38±0.19) g·kg-1,总磷(12.27±1.99) g·kg-1,总钾(0.15±0.04) g·kg-1,pH(6.2±0.55).供试土壤未检测出洛克沙胂残留.
1.2 方法
1.2.1 土壤处理 新鲜土壤过4 mm筛后在室温下放置3 d,分别倒入5 L的塑料桶中,每桶装3 kg鲜土,按每3 kg鲜土加入50 mL不同质量浓度的洛克沙胂溶液混匀,使药物质量分数(以As计)分别为:低质量分数组15 mg·kg-1、中质量分数组75 mg·kg-1、高质量分数组150 mg·kg-1,每组设置3个平行.不添加洛克沙胂溶液的土壤为空白对照组.将土壤的含水量调至最大蓄水量的50%,且以湿布盖在表面,放置在室温(20~25 ℃)下培养.培养期间损失的少量水分通过称重法来补充.于处理后第1、2、3、5、8周分别采取培养土壤进行分析.
1.2.2 Biolog法 采集新鲜土壤10 g,加90 mL灭菌生理盐水,210 r/min 25 ℃条件下振荡培养30 min,吸取上清液做1 000倍稀释,再吸取150 μL到Biolog EcoPlate 微平板孔内 25 ℃培养,在590和760 nm下测定Eco板的每孔光密度值,采集数据进行分析.每隔12 h测1次,连续测10 d.
平均每孔颜色变化率(AWCD)计算[11-12]方法:AWCD =∑(D-D)/n,式中D为各有培养基孔的光密度值,D为对照孔的光密度值,n为培养基数值,EcoPlate板的n为31.
多样性指数(Shannon-Wiener指数)H=-∑PilnPi,Pi为减去空白之后每孔的光密度值,Pi=(D-D)/∑(D-D).
丰富度指数指被利用的碳源的总数目,为每32孔中D-D的值大于0.25的孔数[13].
1.2.3 数据处理 采用 Microsoft Excel 2007 处理数据,SPSS 11.5 软件进行统计分析和主成分分析,采用单因素方差分析检验不同处理之间的差异(LSD,α= 0.05).所有数据均为平均值±标准误.
2 结果
2.1 土壤微生物对碳源的利用强度
由图1可知,洛克沙胂含量不同,土壤微生物对碳源的利用强度不同,对照组的碳代谢强度明显高于用药组,在试验早期(第1周),碳代谢强度随着洛克沙胂质量分数的增加而出现明显降低(P<0.05);第3周和5周,高、中质量分数组之间差异不显著,低质量分数组的碳代谢强度则高于高、中质量分数组;第8周,药物处理组的碳代谢强度升高.
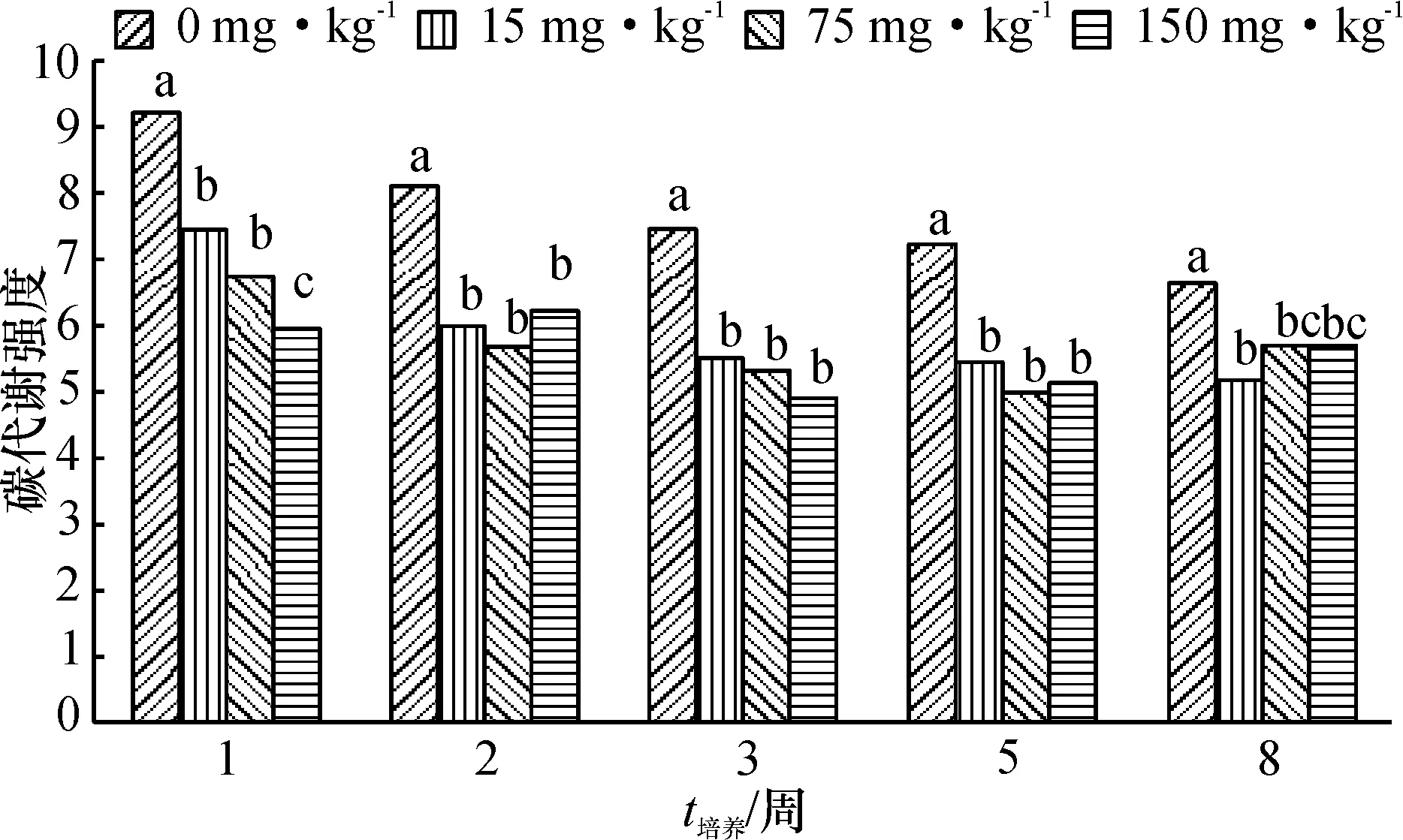
同一培养时间数据柱上,凡有一个相同字母者,表示差异不显著(P>0.05).
图1 不同质量分数洛克沙胂处理下土壤微生物群落利用碳源的强度
Fig.1 Carbon metabolic intensity of soil microbial communities for each treatment
2.2 土壤微生物群落碳代谢多样性
每孔颜色变化率是反映土壤微生物活性,即利用单一碳源能力的一个重要指标[14].图2表明,随着培养时间延长,颜色变化率逐渐升高,对照组的颜色变化率值显著高于用药组,且大小顺序为:空白对照组>低质量分数组>中质量分数组>高质量分数组.第1、2、3、5和8周,高质量分数(150 mg·kg-1)组土壤的颜色变化率值显著低于低质量分数组(P<0.05),较对照组降低了17.39%~54.69%;除了第1周外,其他时间采样点的中、高质量分数组之间的颜色变化率值差异均不显著.
培养基Shannon-Wiener多样性指数反映的是微生物对碳源类型的利用多少,丰富度指数是微生物利用碳源的数量,表1是土壤微生物群落代谢功能丰富度指数和多样性指数与药物浓度的变化情况,由表1可知,丰富度指数和多样性指数均与药物浓度和时间呈负相关.随着培养时间的延长,各组的多样性指数和丰富度指数逐渐降低,对照组的多样性指数和丰富度指数明显高于用药组,且空白对照组>低质量分数组>中质量分数组>高质量分数组.在用药后第1、2、3、5和8周时间点上,高质量分数组(150 mg·kg-1)土壤多样性指数与丰富度指数显著低于低质量分数组(P<0.05).
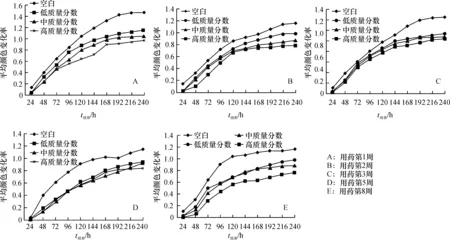
图2 不同质量分数洛克沙胂处理下不同时间土壤平均颜色变化率Fig.2 Average well colour development in soil under different treatments

表1 土壤微生物利用Biolog微平板碳源的丰富度指数和多样性指数1)Tab.1 Richness indexes and diversity indexes of utilized substrates under each treatment
1) 同行同一指标数据后凡有一个相同小写字母者,表示差异不显著(P>0.05).
2.3 土壤微生物群落代谢功能主成分分析
将Biolog-Eco微平板的31个碳源的测定结果形成的描述微生物群落代谢特征的多元向量变换为互不相关的主元向量(PC1和PC2是主元向量的分量),在降维后的主元向量空间中直接用点的位置直观地反映出不同微生物群落的代谢特征.分析结果表明:土壤微生物群落的代谢多样性类型有明显差异.
PC1解释了微生物群落碳代谢类型的分异程度 (图3), 第1周PC1为27.19%,得分系数F3,8=17.432,P<0.05,呈差异显著;第2周PC1为49.79%,得分系数F3,8=84.20,P<0.01,差异极显著;第3周PC1为50.40%,得分系数F3,8= 67.92,P<0.01,差异极显著;第5周PC1为45.82%,得分系数F3,8= 62.16,P<0.01,差异极显著;第8周PC1为63.82%,得分系数F3,8=86.46,P<0.001,差异极显著.由31个碳源的主成分分析可见,第1周,洛克沙胂低质量分数组(w=15 mg·kg-1)土壤微生物群落代谢类型和对照组差异不明显;第2、3、5周,各处理组的土壤微生物群落碳代谢类型差异明显(P<0.05),各采样点的高质量分数处理组(w=150 mg·kg-1)与对照的差异最大(群落碳代谢类型相差最远);培养后期(第5、8周),中、高质量分数处理组之间差异不显著.
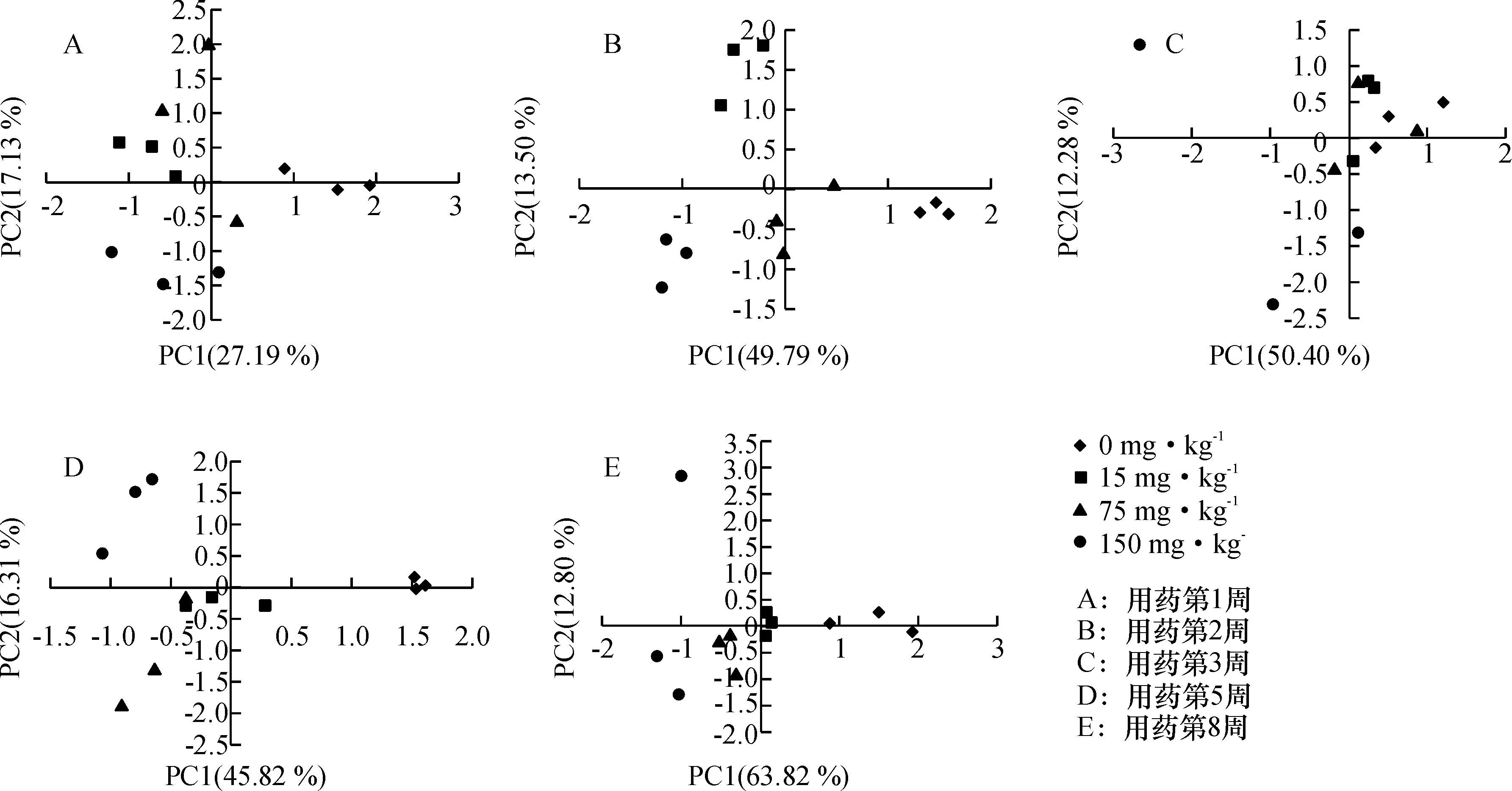
图3 不同处理土壤微生物群落碳代谢类型主成分分析Fig.3 Principal component analyses of the carbon-source metabolic capacity of soil microbial communities under different treatments
3 讨论
通常认为土壤微生物代谢功能多样性是定量描述土壤环境微生物群落变化特征的重要指标之一.由美国Biolog公司开发的自动微生物鉴定系统是一种简单、快速,以群落水平碳源利用类型为基础的氧化还原技术.近几十年以来,研究者通过污染稻田土和模拟盆栽等试验,对Cu、Zn、Pb、Cd、Cr、Hg、As等7种重金属[15-17]对土壤微生物数量及群落结构多样性的影响方面进行了大量研究工作,Muhammad等[18]研究Pb、Cd污染对土壤中微生物多样性的影响,结果表明高浓度的重金属能显著影响微生物的群落结构.Wang等[19]运用PCR-DGGE方法研究了Cu、Zn污染土壤中微生物的多样性,结果表明,重金属污染对土壤中微生物活性和群落组成产生了显著影响.华建峰等[20]采用Biolog法研究了重金属砷对土壤微生物群落多样性的影响,结果表明,中浓度As和高浓度As土壤微生物对糖类、氨基酸类等碳源的利用程度显著高于低浓度As土壤.洛克沙胂作为一种有机胂添加剂,它可降解为无机砷,对土壤微生物具有一定毒性作用,本试验中洛克沙胂暴露处理土壤的结果与其他重金属作用已有报道的结果相一致,土壤微生物的碳代谢功能多样性随用药浓度的升高而降低.
我国土壤砷含量最高背景值一般认为是15 mg·kg-1,曾婧等[21]对我国7 省区共43个养殖场周边环境土壤调查中显示砷含量为12.7~56.0 mg·kg-1.本试验以我国土壤砷含量最高背景值为低质量分数,设立15、75和150 mg·kg-1为低中高3个质量分数.研究结果表明,洛克沙胂作用于土壤后第1、2、3、5、8周时土壤微生物群落代谢功能多样性均受到影响,药物质量分数越高则土壤群落代谢功能性多样性指数越低.在整个培养时间内各用药组颜色变化率值均低于对照组,说明在洛克沙胂作用下,土壤微生物利用碳源的能力降低,且随药物质量分数的增加而降低.洛克沙胂本身具有杀菌和杀寄生虫的作用,进入生态环境后最终会降解成可溶于水的无机砷类物质,无机砷是毒性较大的重金属.重金属之所以对微生物有毒害作用,主要是因为重金属大都不能被生物分解,极易在生物体内积累,而且它们极易与一些生物大分子酶的活性中心和极性电子基团结合,导致这些生物大分子失活,最终引起微生物死亡.土壤微生物数量减少,碳代谢能力与强度降低,第1、2、3、5周,中、高质量分数洛克沙胂处理组与对照组之间的差异显著,表明洛克沙胂暴露胁迫质量分数越高,对土壤的微生物生态毒性就越大.第8周,药物处理组的碳代谢能力与强度升高,可能是由于土壤中药物的有效作用质量分数降低,一些对洛克沙胂耐受的微生物得到生长并逐渐成为优势菌群.
主成分分析明显区分了不同质量分数洛克沙胂影响下的土壤微生物群落碳代谢类型差异程度,具体表现在随着污染程度的增加,其在主成分分布图上向X轴的负方向延伸,洛克沙胂质量分数越高则与对照组相距越远;自第1周开始,低质量分数组与对照组明显分开;培养前中期,中、高质量分数组与对照组各自明显分开,说明中、高质量分数洛克沙胂改变了土壤微生物碳代谢类型;后期(第5、8周)差异不显著.土壤本身是非常复杂的系统,可能是药物在土壤中随着时间的推移发生迁移、转化、吸附等有关.
目前,研究重金属对土壤微生物学性状的影响大都是在实验室受控条件下进行的,通常使用单因子变量来进行研究,但在自然环境中,往往有各种环境因素相互作用,因此要将实验室得出的结论外推到自然条件下比较困难,而且室内与野外试验的结果也常有差异.另外,不同的微生物由于重金属污染的长期与短期效应而表现出不同的敏感性.而室内试验由于是在可控条件下操作,仍可较明确反映单一因素的影响情况,因此,进一步研究洛克沙胂对土壤微生物的生态毒理还需结合野外的实地试验结果来反应重金属污染的生态效应.
[1] CHEN Tao, LIU Xingmei, ZHU Muzhi, et al. Identification of trace element source and associated risk assessment in vegetable soils of the urban-rural transitional area of Hangzhou, China[J]. Environ Pollut,2008,151(1):67- 68.
[2] KIRK J L, BEAUDETTE L A, HART M, et al. Methods of studying soil microbial diversity[J]. J Microbiol Methods,2004,58(2):169-188.
[3] STEENWERTH K L, JACKSON L E, CALDERON' F J, et al. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California[J]. Soil Biol Biochem, 2002, 34(11): 1599-1611.
[4] 白清云.土壤微生物群落结构的化学估价方法[J]. 农业环境保护, 1997(6):13-17.
[5] 胡洪营,童中华. 微生物醌指纹法在环境微生物群体组成研究中的应用[J]. 微生物学通报, 2002(4):95-98.
[6] 田雅楠,王红旗. Biolog法在环境微生物功能多样性研究中的应用[J]. 环境科学与技术, 2011(3):50-57.
[7] KIMURA M, SHIBAGAKI T, NAKAJIMA Y, et al. Community structure of the microbiota in the floodwater of a Japanese paddy field estimated by restriction fragment length polymorphism and denaturing gradient gel electrophoresis pattern analyses[J]. Biol Fertil Soils, 2002,36(4):306-312.
[8] SANDAA R A, TORSVIK V, ENGER Ø. Influence of long-term heavy-metal contamination on microbial communities in soil[J]. Soil Biol Biochem, 2001,33(3):287- 295.
[9] KONG W D, ZHU Y G, FU B J, et al. The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community[J]. Environ Pollut, 2006, 143(1): 129-137.
[10]赵娜,林威鹏,蔡昆争,等. 家畜粪便堆肥对番茄青枯病、土壤酶活性及土壤微生物功能多样性的影响[J]. 生态学报, 2010, 30(19): 5327-5337.
[11]GARLAND J L, MILLS A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source-utilization[J]. Appl Environ Microbiol, 1991, 57(8): 2351- 2359.
[12]SCHUTTER M, DICK R. Shifts in substrate utilization potential and structure of soil microbial communities in response to carbon substrates[J]. Soil Biol Biochem, 2001, 33(11):1481-1491.
[13]ROGERS B F, TATE R L Ⅲ. Temporal analysis of the soil microbial community along a toposequence in Pineland soils[J]. Soil Biol Biochem, 2001, 33(10): 1389-1401.
[14]ZABINSKI C A, GANNON J E. Effects of recreational impacts on soil microbial communities[J]. Environ Manage, 1997, 21(2): 133- 238.
[15]蒋艳梅. 重金属Cu,Zn,Cd,Pb 复合污染对稻田土壤微生物群落结构与功能的影响[D].杭州: 浙江大学, 2007.
[16]阎姝,潘根兴,李恋卿. 重金属污染降低水稻土微生物商并改变 PLFA 群落结构苏南某地污染稻田的案例研究[J].生态环境,2008,17(5):1828-1832.
[17]吴建军,蒋艳梅,吴愉萍,等. 重金属复合污染对水稻土微生物生物量和群落结构的影响[J]. 土壤学报, 2008, 45(6): 1102-1109.
[18]MUHAMMAD A, XU Jianming, LI Zhaojun, et al. Effects of lead and cadmium nitrate on biomass and substrate utilization pattern of soil microbial communities[J]. Chemosphere, 2005, 60(4): 508-514.
[19]WANG Yuanpeng, SHI Jiyan, WANG Hui. The influence of soil heavy metals pollution on soil microbial biomass, enzyme activity, and community composition near a copper smelter[J]. Ecotoxicol Environ Safe, 2006, 67(1):75- 81.
[20]华建峰,林先贵,蒋倩,等. 砷矿区农田土壤微生物群落碳源代谢多样性[J]. 应用生态学报, 2013, 24(2):473- 480.
[21]曾婧. 我国部分猪场砷污染调查及阿散酸在猪鸡饲后的排泄规律研究[D]. 广州:华南农业大学,2010.
【责任编辑柴 焰】
Effectsofroxarsoneexpotocarbon-sourcemetaboliccapacityandfunctionaldiversityofsoilmicrobialcommunities
ZHANG Cao1, BAI Ling1, GUO Ruizi1, MA Yi2, SUN Yongxue1
(1 National Laboratory of Safety Evaluation (Environmental Assessment) of Veterinary Drugs, South China Agricultural University, Guangzhou 510642, China; 2 Department of Veterinary Medicine, Guangdong Ocean University, Zhanjiang 524088, China)
【Objective】 To evaluate the effects of roxarsone residues on the microbiological characteristics of soil, the carbon-source metabolic functions of the soil microbial communities exposed to roxarsone and studied by Biolog technology. 【Method】 Fresh soil with different concentrations of roxarsone solution mix were collected so that drugs were (as As): group 15 mg·kg-1, group 75 mg·kg-1, group 150 mg·kg-1, cultivated at room temperature (20-25 ℃). Soil samples were taken after 1,2,3,5,8 weeks of treatment for analysis using Biolog method. 【Result and conclusion】 The results showed that the carbon-source metabolic functions of the soil microbial communities of groups treated with roxarsone were significantly distinguished from that of CK, indicating a dose-dependent relationship. The carbon-source metabolic functional diversity of soil microbial communities in the lower roxarsone groups (w=15 mg·kg-1) were not significantly different from the control group during the 1st week. However, the soil microbial community functional diversity in the four groups (control, low, medium and high group) was significantly different in the 2nd, 3rd, 5th and 8th week. The difference between control and treatment groups appeared to be much more severe with the increase of roxarsone concentration. It is concluded that the carbon-source metabolic capacity and functional diversity of soil microorganisms in roxarsone treatment groups change with the increase of roxarsone concentration. In the 2nd week and 3rd week, the functional diversity of the soil microbial community of the three roxarsone groups decrease more rapidly compared with that in the 5th week and 8th week, which might be caused by the chemical conversion and degradation of roxarsone in soil.
roxarsone; soil microbial community; functional diversity; microbial utilization rate of carbon source
2013- 12- 05优先出版时间2014- 07- 17
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20140717.0910.031.html
张 草(1987—),男,硕士研究生,E-mail:372985394@qq.com;通信作者:孙永学(1969—),男,教授,博士,E-mail: sunyx@scau.edu.cn
国家自然科学基金 (31172368);广东省自然科学基金 (S2011010001090)
张 草, 白 玲, 郭瑞子,等.洛克沙胂暴露对土壤微生物碳代谢功能多样性的影响[J].华南农业大学学报,2014,35(5):8- 13.
S859
A
1001- 411X(2014)05- 0008- 06
