盐度渐变对斑尾复鰕虎鱼幼鱼血清渗透压和离子浓度及鳃丝Na+/K+–ATP酶活力的影响
2014-08-31税春施永海华雪铭张忠华张海明刘永士
税春,施永海,华雪铭,张忠华,张海明,刘永士
(1.上海海洋大学农业部淡水水产种质资源重点实验室,上海 201306;2.上海市水产研究所,上海200433;3.上海高校知识服务平台上海海洋大学水产动物遗传育种中心,上海 201306;4.上海市水产养殖工程技术研究中心,上海 201306)
盐度渐变对斑尾复鰕虎鱼幼鱼血清渗透压和离子浓度及鳃丝Na+/K+–ATP酶活力的影响
税春1,2,3,4,施永海2*,华雪铭1,3,4,张忠华2,张海明2,刘永士2
(1.上海海洋大学农业部淡水水产种质资源重点实验室,上海 201306;2.上海市水产研究所,上海200433;3.上海高校知识服务平台上海海洋大学水产动物遗传育种中心,上海 201306;4.上海市水产养殖工程技术研究中心,上海 201306)
为了解斑尾复鰕虎鱼的渗透压调节机制,设置0.5、10、15、20、25、30、35、40、50共10个盐度组,采用外界盐度渐变的方法对该鱼幼鱼血清渗透压、血清离子浓度及鳃丝Na+/K+–ATP酶活力进行了检测和分析。结果显示:在盐度0~50内,血清渗透压及血清离子含量均随盐度升高而升高,盐度为40~50时,血清渗透压及各离子含量均显著高于对照组(盐度6);在0~35的盐度中,血清渗透压及离子含量都保持相对稳定,在0盐度组,鳃丝Na+/K+–ATP酶活性最强,25和35盐度组的鳃丝Na+/K+–ATP酶活性比5~20和40~50盐度组的明显增强,25和35盐度组之间Na+/K+–ATP酶活性无显著性差异,5~20和40~50盐度组之间也均无显著差异,在盐度5~35内,鳃丝Na+/K+–ATP酶活性随外界盐度升高呈升高趋势;回归分析得到血清等渗点为0.308 mol/kg,相对应的盐度为10.8;Na+、Cl–、K+等离子点分别为340.28、137.08和4.51 mmol/L,相对应的盐度分别为28.1、8.9和 18.5。以上结果表明,斑尾复鰕虎鱼幼鱼对外界盐度变化有较强的适应性,属于广盐性鱼类,其盐度的耐受范围和适宜范围分别为0.3~35和5~15。
斑尾复鰕虎鱼;盐度;血清渗透压;血清离子;鳃丝Na+/K+–ATP酶活性
鳃作为鱼类主要的渗透压调节器官,在其适应外界环境盐度变化的过程中发挥着积极作用,能调节单价离子的吸收或排出[1–3]。鳃的泌氯细胞表面具有高活力的 Na+/K+–ATP酶[4],对于维持细胞膜对离子的通透性、各离子浓度与渗透压的稳定具有重要作用。国内外对鱼类渗透压调节的研究多以鳃丝Na+/K+–ATP酶、血清渗透压和离子浓度等作为评价指标。
斑尾复鰕虎鱼(Synechogobius ommaturus Richardson),俗称光鱼,属鰕虎鱼科(Gobiidae),复鰕虎鱼属(Synechogobius),是鰕虎鱼中的大型经济鱼类,主要栖息于近岸底层的淤泥或沙质水域,具有较强的盐度耐受能力,不仅可以在海水中生长,还能在河口处存活[5–6]。该鱼生长迅速,肉质细嫩,味道鲜美,越来越受到消费者的喜爱。近年来,该鱼常混养于菊黄东方鲀池塘中,并有较好的养殖效益。目前,有关斑尾复鰕虎鱼的研究主要集中在遗传、分类、繁殖等方面[7–9]。关于该鱼的渗透压调节机制和调节能力的研究很少有报道。本研究检测和分析盐度渐变过程中斑尾复鰕虎鱼血清渗透压、血清离子含量及鳃丝Na+/K+–ATP酶活力,旨在掌握斑尾复鰕虎鱼对外界盐度变化的生理响应,探讨该鱼的渗透压调节机制,为更好地保护和开发斑尾复鰕虎鱼资源提供参考数据。
1 材料与方法
1.1 供试鱼
试验用斑尾复鰕虎鱼幼鱼捕捞自菊黄东方鲀混养池塘,暂养于室内水泥池,每天以商品膨化料(粗蛋白45%,粗脂肪6.5%)表观饱食投喂2次(8:00、16:00)。2周后,挑选270尾体格健康、个体均匀的幼鱼,体质量(17.43±3.11) g,体长(111.56±6.68) mm,随机分配到9个容积为200 L的水缸中,每缸30尾,水的盐度为6。
1.2 试验设计
试验设置0、5、10、15、20、25、30、35、40 和50共10个盐度组及对照组(当地自然海水组,盐度为6)。将幼鱼于盐度为6的水中稳定3 d。随机从3个缸中分别取5尾鰕虎鱼作为对照组样品。对照样品采集后,随机选取其中3个缸的幼鱼作为降盐组试验鱼,剩余6个缸的幼鱼作为升盐组试验鱼通过添加浓缩海水或除氯自来水的方法以每天2~3盐度的速度升降至目标盐度,用YSI30盐度计测量盐度。每到目标盐度后从相应的缸中分别取5尾鱼置于相同盐度(即该采样盐度)、相同水体的缸中稳定 3 d,其余继续进行盐度的升降和采样。整个试验持续21 d。每次取样前24 h停止投喂。
1.3 试验管理
暂养和试验期间(盐度为6),每天定时吸污、换水,换水量约 2/3。整个试验过程持续充氧,采用自然光照和自然光周期(14 h光照)。水温25.0~29.2℃,pH 7.71~8.25,溶氧量>6.0 mg/L。
1.4 样品采集
血清的采集:采样前将鱼置于冰水中麻醉[10],捞出并擦干体表水分,用1 mL一次性无菌注射器从尾部静脉取血,然后转移至已预冷的1.5 mL无菌离心管中。于0 ℃冰箱中放置过夜后,用冷冻离心机8 000 r/min、4 ℃离心20 min,将上层血清收集保存于–80 ℃冰箱中,解冻后测定渗透压和离子含量。
鳃丝的采集:将采完血的鱼立即放入冰盘中,先取下整个鳃,用预冷的生理盐水(1.2%)清洗,用滤纸吸干水分,采集鳃丝置于预冷的离心管中,保存于–80 ℃冰箱中,解冻后测定Na+/K+–ATP酶活力。
每次采样前分别采集相应外界水环境的水样于0~4 ℃保存,用以检测渗透压和离子浓度。
1.5 样品的测定
酶液的制备:称取0.1 g鳃丝,加入0.9 mL生理盐水,用高速匀浆器在冰浴中以2 000 r/min匀浆1 min,匀浆液用高速冷冻离心机3 000 r/min离心10 min,取上清液作为待测样本,于 24 h内完成Na+/K+–ATP酶活力测定。
Na+/K+–ATP酶活性采用南京建成生物工程研究所的超微量Na+/K+–ATPase测定试剂盒测定。组织蛋白含量采用BCA法[11]测定。以每小时每毫克组织蛋白中的ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位(U)。
血清和外界水体渗透压用冰点渗透压仪(Gonotec 030,德国)测定。血清和水体Na+、K+、Cl–的含量采用南京建成生物公司的检测试验盒测定。
1.6 数据分析
采用 Excel 2003对数据进行初步处理,用SPSS17.0分析软件对数据进行回归分析和单因素方差分析。若影响显著,则进行Duncan’s多重比较
2 结果与分析
2.1 盐度渐变对供试鱼血清渗透压与离子浓度的影响
盐度为10~30时,血清渗透压随盐度升高而升高(表1)。在盐度为50的环境中,血清渗透压最高(P <0.05),其次是盐度为40的试验组。从盐度由0升高至35时,除盐度0与30组间存在差异(P<0.05)外,其余各组血清渗透压之间无显著差异(P>0.05)血清渗透压与水体渗透压间的关系可以用线性方程表示,回归直线和等渗线的交点显示血清的等渗点为0.308 mol/kg,相对应的盐度为10.8(图1)。
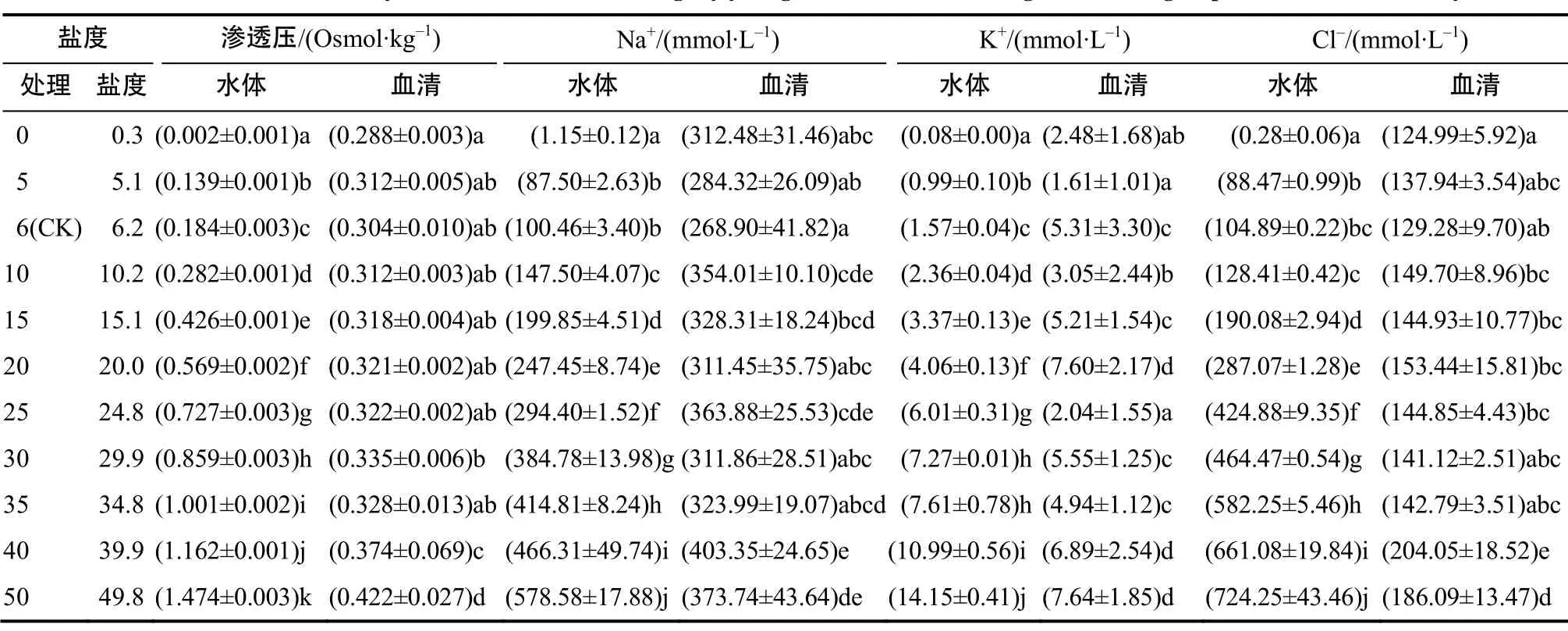
表1 不同试验盐度下水体和血清渗透压与离子含量Table 1 Plasma osmolality and ions concentration in goby young fish and its surrouding water from groups with different salinity
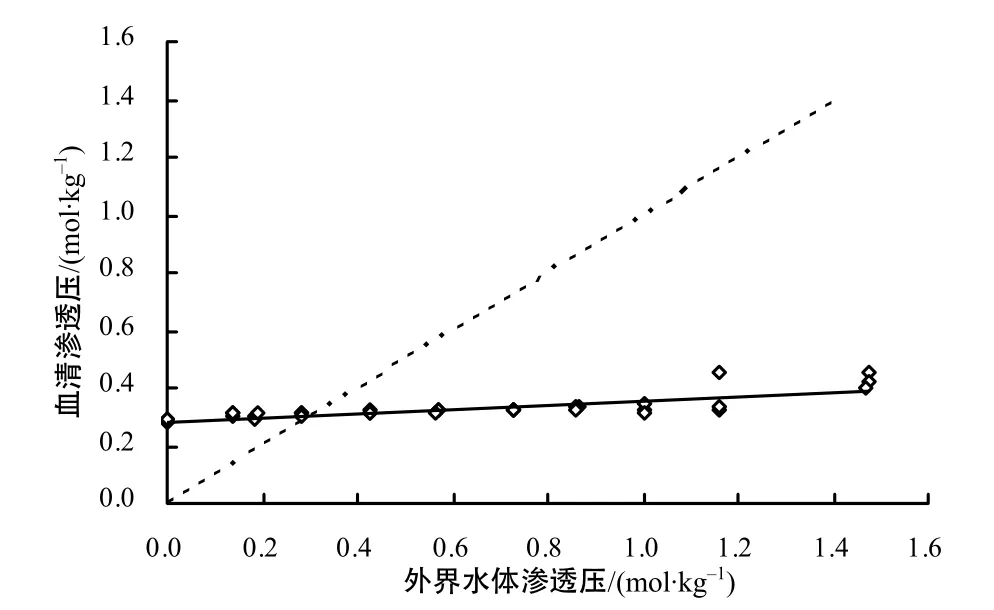
图1 斑尾复鰕虎鱼血清渗透压和外界水体渗透压的关系Fig. 1 The relationship between the plasma and medium osmolality in goby young fish (Synechogobius ommaturus Richardson)
对照组血清Na+含量最低,但与0和5盐度组无显著差异(P>0.05)(表1)。盐度为10~50环境下的血清Na+含量较对照组均有上升,且盐度为40的试验组含量最高(P<0.05)。盐度为0~35,Cl–含量保持相对稳定。至盐度40及50,其含量显著升高(P<0.05)。在盐度40与50条件下,血清K+含量较高。0~35(除20盐度组外)盐度组间的血清K+含量无显著差异(P>0.05)。血清 Na+、Cl–和 K+与水体相应指标均可以用线性方程来良好的拟合(表2)。根据方程得到 Na+、Cl–和 K+的等离子点分别是340.28、137.08和4.51 mmol/L,相对应的盐度分别是28.1、8.9和18.5。

表2 斑尾复鰕虎鱼幼鱼血清离子浓度与水体相应指标的相关性Table 2 The relationship between the plasma and medium ions concentration in goby young fish (Synechogobius ommaturus Richardson)
2.2 盐度渐变对斑尾复鰕虎鱼鳃丝 Na+/K+–ATP酶活性的影响
从图 2可以看出,0盐度组幼鱼的鳃丝Na+/K+–ATP酶活性最强(P<0.05);25和35盐度组幼鱼的鳃丝 Na+/K+–ATP酶活性明显比 5~20和40~50盐度组的强(P<0.05),但在25和35盐度组之间无显著性差异(P>0.05),5~20和40~50盐度组之间也均无显著性差异(P>0.05)。另外,在盐度5~35,幼鱼鳃丝Na+/K+–ATPase酶活性与外界盐度呈正相关关系,可用线性方程y = 0.66x + 33.75(r2= 0.50;P<0.01)来拟合。
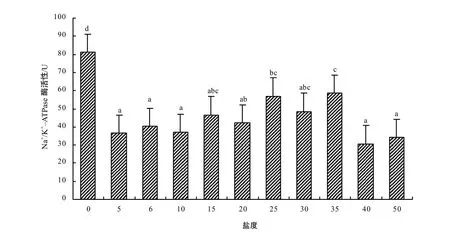
图2 斑尾复鰕虎鱼幼鱼鳃丝Na+/K+–ATP酶活性与盐度的关系Fig. 2 Gill Na+/K+–ATPase activities in goby young fish (Synechogobius ommaturus Richardson.) reared at different salinities
3 讨 论
a. 斑尾复鰕虎鱼幼鱼血清渗透压及离子浓度的变化规律。斑尾复鰕虎鱼幼鱼的血清渗透压在0.286~0.453 mol/kg,介于狭盐性的海水和淡水鱼的血清渗透压之间[11–13],说明斑尾复鰕虎鱼是广盐性鱼类。广盐性鱼类进入高渗环境后,由于鱼体渗透压低于外界渗透压,鱼体会被动失水。为了补偿水分,鱼类开始大量吞饮海水,补充水分的同时也摄入了大量离子,血清离子浓度相对升高,渗透压也因此升高;血清渗透压的升高诱使Na+/K+–ATP酶活力提高,加强对过剩的盐离子的外排作用,避免渗透压过渡升高并维持其稳定[13–14]。当斑尾复鰕虎鱼幼鱼血清渗透压升高时,血清中 Na+、Cl–浓度也在上升,且增幅较大,说明这2种离子对血清渗透压的影响较大。但斑尾复鰕虎鱼幼鱼血清中K+浓度的增幅却并不显著,这与赵峰等[15–16]对史氏鲟(Acipenser schrenckii)的研究结果一致。即当史氏鲟血清 Na+、Cl–浓度升高后,K+浓度并未出现较大波动,证明细胞膜保持着较好的完整性。
b. 斑尾复鰕虎鱼幼鱼鳃丝Na+/K+–ATP酶活性的变化规律。鱼类的鳃上皮细胞中具有可以调节细胞膜离子通透性的Na+/K+– ATP酶,它能维持血清离子及渗透压稳定[4,17]。生活在等渗环境中的广盐性鱼类,其鳃丝Na+/K+–ATP酶活力较低[18]。随着外界水体盐度的上升,Na+/K+–ATP酶活力也会上升,本研究在5~35盐度范围内Na+/K+–ATP酶活性呈现与之基本相同的变化规律,即在盐度 5~20时,Na+/K+–ATP酶活力较低,随着盐度的逐渐升高,鳃丝Na+/K+–ATP酶活力随之上升。较大的内外渗透压差或离子浓度差是迫使机体提高鳃丝Na+/K+–ATP酶活力,以排除过多盐离子的主要原因[12]。但是,当盐度上升至40~50时,鳃丝Na+/K+–ATP酶活力不但没有继续升高,反而降低,这种现象在遮目鱼(Chanos ahanos)[19]和大鳞鲃(Barbus capito)[12]均有发现。这可能是高盐度胁迫使鳃丝Na+/K+–ATP酶活力产生了不可逆的变化,因此,盐度40和50已经超过了该鱼的耐受范围。
c. 斑尾复鰕虎鱼幼鱼的渗透压调节。从斑尾复鰕虎鱼幼鱼鳃丝 Na+/K+–ATP酶活力的变化情况看,位于等渗点附近的酶活较低,随着盐度的升高或下降,酶活均上升,属典型的广盐性鱼类。虽然血清K+、Na+、Cl–含量随盐度升高而呈上升趋势,但回归方程的斜率均较低,血清渗透压维持在0.288~0.374 mol/kg,说明斑尾复鰕虎鱼具有较强的离子调节能力,这对于维持机体渗透压稳定和对水体盐度变化的适应具有积极意义。
综上所述,斑尾复鰕虎鱼幼鱼对盐度变化具有较强的适应性,其适宜的盐度范围为 5~15,可耐受的盐度范围为0.3~35。
[1] Evans D H,Claiborne J B.The Physiology of Fishes [M].Boca Raton:CRC Press,1993:315–343.
[2] 魏渲辉,汝少国,徐路,等.海水和淡水适应过程中广盐性鱼类鳃氯细胞的形态与功能变化及其激素调节[J].海洋科学,2001,25(4):16–20.
[3] Foskett J K,Scheffey C.The chloride cells:Definitive identification as the salt-secretory cell in teleosts[J]. Science,1982,215(4529):164–166.
[4] Karnaky K J.Structure and function of the chloride cell of Fundulus heterolitus and other teleosts[J].American Society of Zoologists,26(1):209–224.
[5] 成庆泰,郑葆珊.中国鱼类系统检索[M].北京:科学出版社,1987:429–436.
[6] 陈大刚.鱼港内斑尾复鰕虎鱼生物学的初步调查[J].动物学杂志,1978(1):12–15.
[7] 宋娜,宋林,高天翔,等.斑尾复鰕虎鱼群体多样性比较分析[J].水产学报,2011,35(2):321–326.
[8] Na S,Xiu M Z,Tian X G.Genetic diversity and population structure of spottedtail goby (Synechogobius ommaturus) based on AFLP analysis [J].Biochemical Systematics and Ecology,2010,38(6):1089–1095.
[9] 孙帼英,陈建过.斑尾复鰕虎鱼的生物学研究[J].水产学报,1993,17(2):146–153.
[10] 王瑞芳,庄平,冯广鹏,等.盐度升高对中华绒螯蟹几种非特异性免疫因子的影响[J].水产学报,2012,36(4):546–552.
[11] Smith,P K,Krohn R I,Hermanson G T,et al Measurement of protein using bicinchoninic acid[J]. Analytical Biochemistry,1985,150(1):76–85.
[12] 耿龙武,徐伟,李池陶,等.盐碱对大鳞鲃血清渗透压、离子含量及鳃丝Na+/K+–ATP酶活力的影响[J].中国水产科学,2011,18(2):458–465.
[13] 潘鲁青,唐贤明,刘泓宇,等.盐度对褐牙鲆(Paralichthys olivaceus)幼鱼血浆渗透压和鳃丝Na+/K+–ATPase 酶活力的影响[J].海洋与湖沼,2006 37(1):1–6.
[14] Xuguang H,Ping Z,Longzhen Z,et al.Osmoregulation in juvenile Chinese sturgeon (Acipenser sinensis Gray) during brackish water adaptation [J].Fish Physiol Biochem,2009,35(2):223–230.
[15] 赵峰,庄平,章龙珍,等.盐度驯化对史氏鲟鳃Na+/K+–ATP酶活力、血清渗透压及离子浓度的影响[J].水产学报,2006,30(4):444–449.
[16] McEnroe M,Cech J J.Osmoregulation in juvenile and adult white sturgeon,Acipenser transmontanus[J].Env Bio Fish,1985,14(1):23–30.
[17] 林浩然.鱼类生理学[M].3版.广州:广东高等教育出版社,2002:119–132.
[18] Mancera J M,Mccormic S D.Rapid activation of gill Na+/K+–ATPase in the euryhaline teleost Fundulus heteroclitus [J].J Exp Zool,2000,287(4):263–274.
[19] Lin Y M,Chen C N,Lee T H.The expression of gill Na+,K+–ATPase in milkfish,Chanos chanos,acclimated to seawater,brackish water and fresh water [J].Comp Biochem Physiol,2003,135(3):489–497.
责任编辑:罗 维
英文编辑:罗 维
Effects of gradual salinity change on plasma osmolality, ions and gill Na+/K+-ATPase activity of goby (Synechogobius ommaturus Richardson) young fish
SHUI Chun1, 2,3,4,SHI Yong-hai2*,HUA Xue-ming1,3,4,ZHANG Zhong-hua2,ZHANG Hai-ming2,LIU Yong-shi2
(1.Key Laboratory of Freshwater Fishery Germplasm Resources, Ministry of Agriculture, Shanghai 201306, China; 2.Shanghai Fisheries Research Institute, Shanghai 200433, China; 3.Shanghai University Knowledge Service Platform, Shanghai Ocean University Aquatic Animal Breeding Center, Shanghai 201306, China; 4.Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China)
Changes in plasma osmolality, concentration of ions (Na+, Cl–, K+) and gill Na+/K+–ATPase activity of goby (Synechogobius ommaturus Richardson) young fish were valued by gradually changing the medium salinity from 6 (control) to 0, 5, 10, 15, 20, 25, 30, 35, 40, and 50. The changes of both of the plasma osmolality and ions showed a similar trend, which increased with the increasing of medium salinity when the salinity was in the range of 0–50; plasma osmolality and ions were significantly higher compared to the control group (salinity 6) and remained steady at salinity of 0–35. Na+/K+–ATPase activity reached its peak at the salinity of 0. Na+/K+–ATPase activities of goby young fishes ingroups with salinity at 25 and 35 were evidently stronger than those in groups with salinity range of 5–20 and of 40–50. There were no significant differences in Na+/K+–ATPase activities between 25 and 35 groups and the differences were also of no statistical significance in groups with salinity range of 5–20 and of 40–50. In salinity range of 5–35, the gill Na+/K+–ATPase activity increased with the ascending of the degree of salinity. Regression analysis showed serum isosmotic point was estimated as 0.308 mol/kg, which corresponded to salinity 10.8. The isoionic point of Na+, Cl–and K+were 340.28 mmol/L, 137.08 mmol/L and 4.51 mmol/L, respectively. which corresponded to salinity 28.1, 8.9 and 18.5. The results indicated that the goby young fish might have a great capability of acclimation to salinity change. It tolerates salinities ranging from 0.3 to 35, and the optimal living salinities were in the range of 5 to 15.
Synechogobius ommaturus; salinity; plasma osmolality; plasma ions; gill Na+/K+–ATPase activity
10.13331/j.cnki.jhau.2014.01.015
时间:2014– – 00:00
网络出版地址:
S965;Q959.483
A
1007−1032(2014)01−0069−05
2013–04–14
国家公益性行业(农业)科研专项(201203065);上海市科技兴农重点攻关项目(沪农科攻字(2011)第1–4号)
税春(1988—),男,四川沪州人,硕士研究生,主要从事水产动物营养与饲料及鱼类生理学研究,hejiangsc@foxmail.com;
*通信作者,yonghais@163.com
