猪瘟病毒弱毒C株ST细胞传代疫苗对仔猪的免疫效果
2014-08-31陈果亮余兴龙
陈果亮,余兴龙
(1.湖南农业大学动物医学院,湖南 长沙 410128;2. 湖南美神育种有限公司,湖南 株洲 412007)
猪瘟病毒弱毒C株ST细胞传代疫苗对仔猪的免疫效果
陈果亮1,2,余兴龙1*
(1.湖南农业大学动物医学院,湖南 长沙 410128;2. 湖南美神育种有限公司,湖南 株洲 412007)
将猪瘟病毒弱毒C株ST细胞苗以不同剂量(106TCID50和105TCID50)免疫28日龄仔猪,通过临床症状观察、病理剖检和组织病理学观察、抗体检测、特异性淋巴细胞增殖试验及抗原检测等方法评价疫苗免疫效果。结果表明:该疫苗接种仔猪后无任何临床症状,无病毒血症,无排毒现象;不同剂量免疫组,在2免后10 d左右猪瘟特异性抗体阳转,抗体水平于2免后 20 d左右达到峰值。以上结果表明,猪瘟弱毒疫苗毒株C株的ST细胞传代疫苗对仔猪安全有效。
猪瘟病毒;C株;ST细胞;免疫效果
1 材料和方法
1.1 供试猪与疫苗
供试猪为18 头28日龄左右仔猪,经IDEXX猪瘟抗体检测试剂盒检测为CSFV抗体阴性,购自无CSFV猪场。将CSFV兔化弱毒C株(由湖南农业大学分子与免疫实验室传代保存)接种ST细胞并传代培养,收毒后测定病毒滴度,作为接种用C株ST细胞疫苗。
1.2 免疫试验
18 头仔猪随机分为高剂量免疫组、低剂量免疫组和对照组,每组 6头。免疫分1次免疫(首免)和2次免疫(加强免疫),高、低剂量免疫组分别经颈部肌肉注射1 mL含106TCID50和含105TCID50病毒的C 株ST细胞疫苗,对照组注射ST细胞培养液1 mL;首免后21 d进行加强免疫。免疫前7 d及免疫后每3 d对试验组进行前腔静脉采血:采非抗凝血分离血清,用于抗体检测;免疫后每隔3 d采集抗凝血、肛拭子、鼻拭子,用于核酸检测。
1.3 抗体检测
用 IDEXX 公司 CSFV抗体检测试剂盒检测血清中的 CSFV 特异性中和抗体。
1.4 临床观察与剖检和样品采集
首免后,每天记录各组仔猪的直肠温度和临床变化,连续监测7 d。所有仔猪在2免后24 d处死并进行病理剖检,采集扁桃体、脾脏和腹股沟淋巴结用于淋巴细胞增殖试验、组织病理学检查及病原学检测。
1.5 细胞免疫应答检测
分离脾脏的淋巴细胞,根据文献[4]的CFSE法检测淋巴细胞增殖能力。
1.6 组织病理学和病原学检查
根据参考文献[4]的方法对扁桃体、脾脏和腹股沟淋巴结进行石蜡切片的制作,并进行组织病理学观察。根据 CSFV 石门株的基因序列(序列的GenBank登录号为AF092448)设计1对CSFV特异性引物,用于CSFV核酸的检测,上游引物序列为5′– CGGTTAGGGAG GAGTACGCA–3′,下游引物序列为5′–TGATGCTG TCACACAGGTGAA–3′。用TRIzol 试剂(Invitrogen公司产品)分别提取抗凝血、肛拭子、鼻拭子、扁桃体、脾脏和腹股沟淋巴结的总RNA,溶于20 μL DEPC处理的灭菌双蒸水中,取 2 μL RNA,采用大连宝生物One–step RT–PCR试剂盒进行扩增,以检测CSFV核酸。扩增体系按说明书进行配置。反应程序为:50 ℃反转录30 min 94 ℃灭活反转录酶2 min,35个循环(94 ℃预变性30 s,55 ℃ 退火30 s,72 ℃ 延伸1 min),最后72℃总延伸 7 min。PCR产物于4 ℃保存,用琼脂糖凝胶电泳法检测PCR结果。
2 结 果
2.1 CSFV特异性中和抗体检测结果
高剂量和低剂量免疫组在2次免疫后 10 d左右,CSFV特异性抗体开始转阳,之后抗体水平持续升高,并于加强免疫后20 d左右达到峰值,随后有所降低,2个免疫组的抗体水平的变化基本一致而对照组CSFV特异性抗体一直为阴性(图1)。
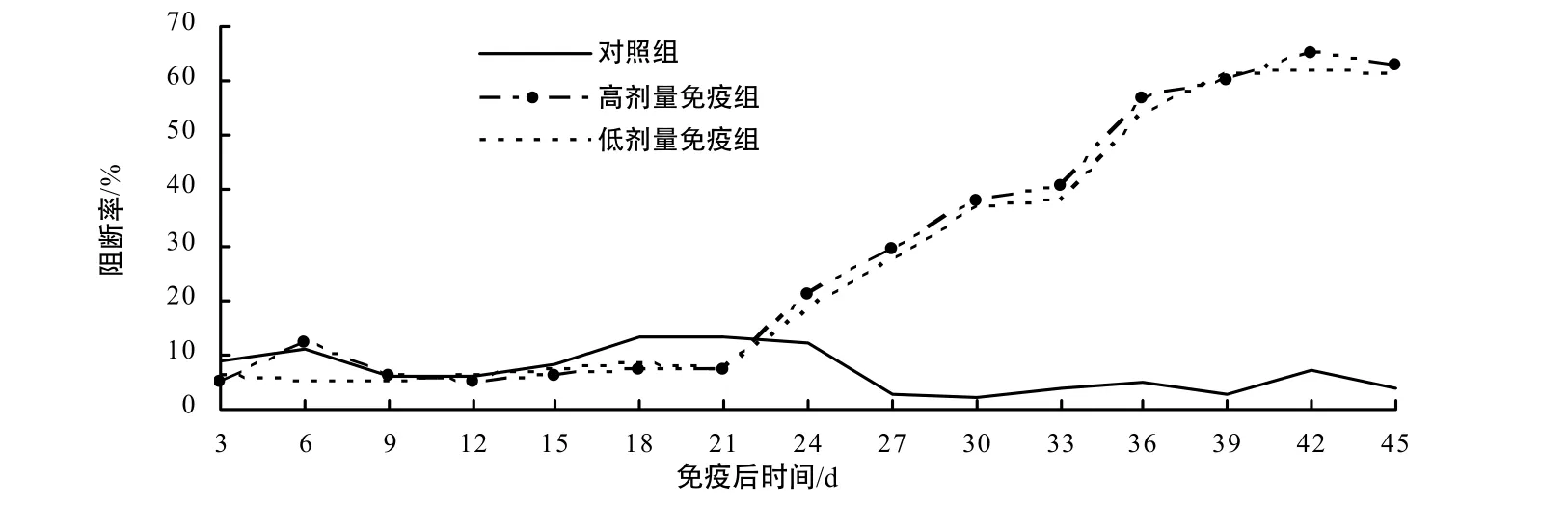
图1 ELISA检测CSFV特异性中和抗体Fig. 1 Detection of CSFV specific antibody titers by ELISA
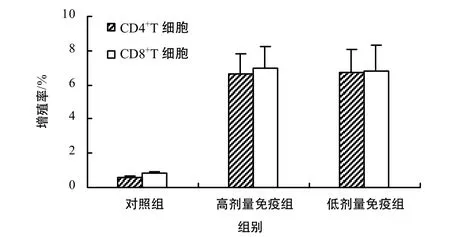
图2 T淋巴细胞增殖效率检测Fig. 2 Detection of T lymphocyte cells proliferation
2.2 特异性淋巴细胞增殖结果
用 CFSE染色方法评价了免疫猪 CD8+和CD4+T 细胞经CSFV抗原刺激后的增殖反应。结果表明,CSFV C株 ST细胞苗免疫猪的脾细胞经CSFV C株体外刺激后诱导了平均 5.2%~6.7%的CD4+T 细胞增殖和4.8%~6.8%的 CD8+T 细胞增殖,而对照组没有产生任何特异性淋巴细胞增殖,差异极显著(P< 0.01) (图2)。
2.3 临床及病理解剖检验结果
对照组和CSFV C株ST细胞疫苗免疫的猪没有出现任何异常临床症状,体温(38.5~39.5 ℃)正常,病理剖检眼睛观察未见明显病理变化。
2.4 组织病理学观察结果
石蜡切片检查结果表明,免疫组和对照组的扁桃体、脾脏和腹股沟淋巴结没有出现明显的组织病理学变化(图3)。
图3 组织病理学观察Fig. 3 Tissue pathology observation
2.5 病毒血症、肛拭子、鼻拭子及脏器病毒核酸的检测
用RT–PCR 检测免疫猪免疫后3、6、9 d的血液的病毒核酸。结果表明,免疫后9 d内仔猪体内均无病毒血症检出。将所有猪的肛拭子和鼻拭子进行CSFV的核酸检测,结果免疫组和对照组均无病毒排出。对所有猪的脾脏、腹股沟淋巴结及扁桃体进行检测发现,免疫组和对照组猪的脏器中均无CSFV核酸检出。
3 讨 论
本研究中,用不同剂量CSFV C株ST细胞疫苗免疫的仔猪,其体温均未出现异常,也没明显的临床症状。免疫后,在猪体内无病毒血症且不排毒这与其他研究[5,6]用不同培养体系制备的CSFV C株疫苗免疫猪体后也不往外排毒的结果一致。C株ST细胞疫苗免疫后的猪,各脏器均无明显病理学变化,且未检查到CSFV特异性核酸,表明CSFV C 株ST细胞疫苗对仔猪十分安全。
CSFV C株ST细胞疫苗不同剂量接种仔猪后21 d内抗体基本呈阴性,在第21天加强免疫后不久抗体转阳,且持续升高,表明该疫苗能刺激机体产生良好的免疫应答,这一结果与张平[1]等人的报道一致,即目前市售商品化疫苗首次免疫后21 d内
基本检测不到CSFV特异性抗体,必须加强免疫一次才能有显著的抗体升高,同时也提示如果仅拿抗体水平来评价临床免疫效果,需在2免后进行。免疫后的猪脾脏中的CD8+和CD4+T细胞经特异性抗原刺激能产生特异性的增殖,表明免疫C株ST细胞疫苗后,可同时诱导猪产生体液免疫和细胞免疫。有研究[7–9]指出,细胞免疫可能在早期免疫中提供免疫保护,因此,在临床评价猪瘟弱毒疫苗免疫效果时应该加强猪群特异性细胞免疫方面的检测。
[1] 张平,孙惠玲,孙继国.5种商品化猪瘟疫苗免疫猪后的抗体水平监测比较[J].动物医学进展,2010,31(10):113–115.
[2] 仇华吉,童光志,沈荣显.猪瘟兔化弱毒疫苗半个世纪的回顾[J].中国农业科学,2005,38(8):1675–1685.
[3] 牛建强,蓝天,陈峰,等.猪瘟的防控措施[J].动物医学进展,2006,27(7):108–110.
[4] 孙元,刘大飞,王宇飞,等.表达猪瘟病毒E2蛋白的重组腺病毒对猪的免疫效力评价[J].中国动物传染病学报,2009,17(1):15–21.
[5] 王在时.畜禽重大疫病免疫预防研究进展[M].北京:中国农业出版社,1996:64–71.
[6] Kojnok J,Palatka Z,Bognar K.Requirements of rabbit-adapted swine fever vaccine[J].Archiv Fur Experimentelle Veterinarmedizin,1980,34(1):67–72.
[7] Terzic S,Sver L,Valpotic I,et al.Proportions and phenotypic expression of peripheral blood leucocytes in pigs vaccinated with an attenuated C strain and a subunit E2 vaccine against classical swine fever[J].Journal of Veterinary Medicine Series B–Infectious Diseases and Veterinary Public Health,2003,50(4):166–171.
[8] Pauly T,Elbers K,Konig M,et al.Classical swine fever virus–specific cytotoxic T lymphocytes and identification of a T cell epitope[J].Journal of General Virology,1995 76(12):3039–3049.
[9] Armengol E,Wiesmuller K H,Wienhold D,et al Identification of T–cell epitopes in the structural and non–structural proteins of classical swine fever virus[J] Journal of General Virology,2002,83(3):551–560.
责任编辑:罗 维
英文编辑:罗 维
Immuno-efficacy of classcical swine fever virus C strain propagated in ST cells on piglets
CHEN Guo-liang1,2, YU Xing-long1*
(1.College of Veterinary Medicine, Hunan Agriculture University, Changsha 410128, China; 2.Hunan Meishen Breeding Co.,Ltd., Zhuzhou, Hunan 412007, China)
Twenty-eight day-old piglets were inoculated with classical swine fever virus (CSFV) attenuated C strain propagated in ST cells at different doses (106TCID50and 105TCID50). The immuno-efficacy was evaluated by clinical symptoms, pathologic autopsy and histopathology, antibody detection, lymphocyte proliferation assay and antigen detection. The results showed that this C strain induced no observed clinical symptom, no viremia, no virus shedding. An identical booster immunization was conducted 3 weeks post primary immunization,about 10 days after the second immunization, the CSFV specific antibody changed to be positive and the level of which arrived at a peak 20 days after the second immunization. In conclusion, the CSFV C strain propagated in ST cells is safe and efficiency to the piglets.
classical swine fever virus; C strain; ST cell; immuno-efficacy
10.13331/j.cnki.jhau.2014.01.014
时间:2014– – 00:00
网络出版地址:
S852.65+1
A
1007−1032(2014)01−0065−04
中国于 20 世纪 50 年代首先研发出了举世闻名的猪瘟病毒(CSFV)兔化弱毒疫苗(C株)。根据疫苗制造工艺的不同,C株弱毒疫苗分组织苗(乳兔组织苗、牛体反应组织苗)和细胞苗(猪睾丸细胞(ST)苗)。目前,2种疫苗的使用都很普遍[1–2]。但C株ST细胞苗对仔猪的免疫效果在国内尚缺乏临床试验报道,且该疫苗在临床应用过程中应该采取怎样的免疫程序也没有明确的科学依据。目前,多数集约化养殖场仍采取了多次免疫接种,如21日龄首免和65日龄加强免疫的免疫程序[3]。笔者用 ST细胞培养CSFV兔化弱毒C株,传代驯化后采用2种剂量免疫仔猪,探寻疫苗的安全性及抗体消长规律,以期为临床制定CSFV兔化弱毒C株ST细胞苗的免疫程序提供参考依据。
2013–04–12
湖南省科技重大专项(2007FJ1003);湖南农业大学人才引进基金(04YJ03)
陈果亮(1981—),男,湖南湘潭人,博士研究生,主要从事动物传染病学研究,446443800@qq.com;*通信作者,xlyu999@ yahoo.com.cn
