新型12-N-取代苦参酸衍生物的合成及其抗结核活性*
2014-08-30付海根李迎红宋丹青汪燕翔
付海根,唐 胜,李迎红,宋丹青,汪燕翔
(中国医学科学院 北京协和医学院 医药生物技术研究所,北京 100050)
·研究论文·
新型12-N-取代苦参酸衍生物的合成及其抗结核活性*
付海根,唐 胜,李迎红,宋丹青,汪燕翔
(中国医学科学院 北京协和医学院 医药生物技术研究所,北京 100050)
以苦参碱为起始原料,经水解开环,羧基保护制得中间体苦参酸甲酯(3);3与烷基溴或取代酰氯分别经烷基化反应、酰基化反应和磺酰化反应在12-N原子上引入不同结构类型的基团制得新化合物——12-N-取代基苦参丁甲酯(5a~5d);5再经酯水解或LiALH4还原反应合成了一系列新型的12-N-取代基苦参酸或12-N-取代基苦参酸丁醇,其结构经1H NMR,13C NMR和HR-ESI-MS表征。初步的体外生物活性测试结果表明,12-N-正十二烷基苦参丁甲酯具有较佳的抗结核活性,对敏感结核菌株H37Rv的MIC为8.0μg·mL-1。
苦参碱;12-N-取代基苦参酸;合成;抗结核活性;构效关系
目前,现有的抗结核药物有效性的降低以及长期治疗导致患者依从性较差,同时往往会导致多药耐药和广泛抗药性发生。新发肺结核病例的出现,多药耐药结核分枝杆菌感染发生率的增加,一线抗结核药物异烟肼和利福平的不良反应[1-2],以及与结核病相关的HIV感染[3-4]发病率升高,导致科研人员重新将目光投向新抗结核药物的发现上。尤其是多药耐药结核杆菌以及几乎无药可治的广泛耐药结核杆菌的出现,加速了新化学实体的开发和用药策略的创新,以应对日趋严重的结核感染[5-6]。然而,除了结构修饰的药物,自20世纪60年代尚未开发出真正全新母核的抗结核药物。虽然新的抗结核药物Bedaquiline去年刚刚通过美国FDA批准[7],但是对于与目前使用的抗结核药物无交叉耐药的新结构骨架的化学实体仍然需求迫切。
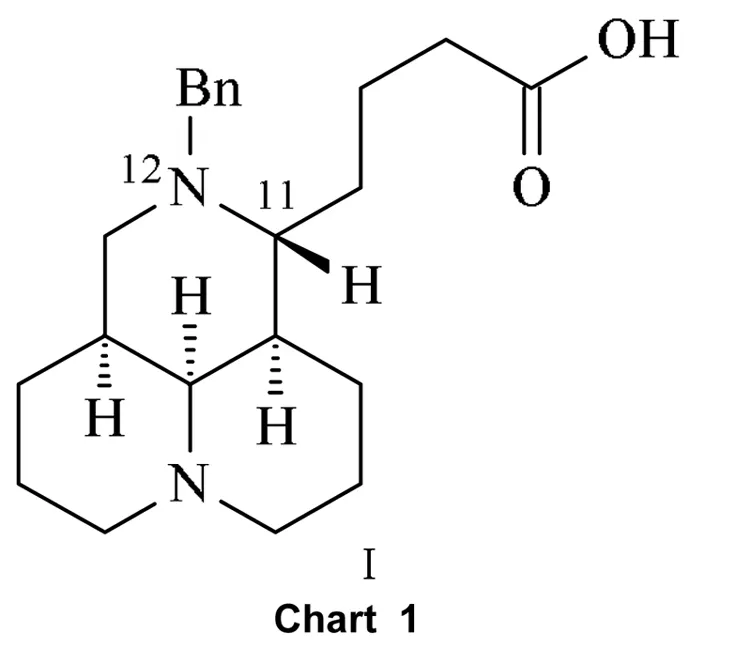
在长期寻找新结构骨架的抗结核药物研究中,本课题组对自制的大量不同结构骨架化合物库进行了体外抗结核活性筛选,发现苦参酸类化合物——12-N-苄基苦参酸(Ⅰ,Chart 1)对敏感结核菌株H37Rv的MIC值为128μg·mL-1,显示出一定的结核杆菌抑制活性。鉴于此类化合物具有较好的柔性结构、溶解度高、结构修饰潜力等特点,对其进行深入的构效关系研究,有望寻找到全新结构骨架的抗结核候选物。
为此,本研究选择Ⅰ为先导化合物,一方面在12-N上引入正丁基、正辛基、正十二烷基、芳香基团等疏水基团来增大化合物的ClogP值,以此来增加化合物的抗结核活性[8];另一方面,在11-位合成相应的丁酸、丁醇以及丁酯侧链衍生物,进一步探讨此类化合物的抗结核构效关系,以期寻找到全新结构骨架、治疗指数高、与现有药物不存在交叉耐药的全新抗结核化合物。
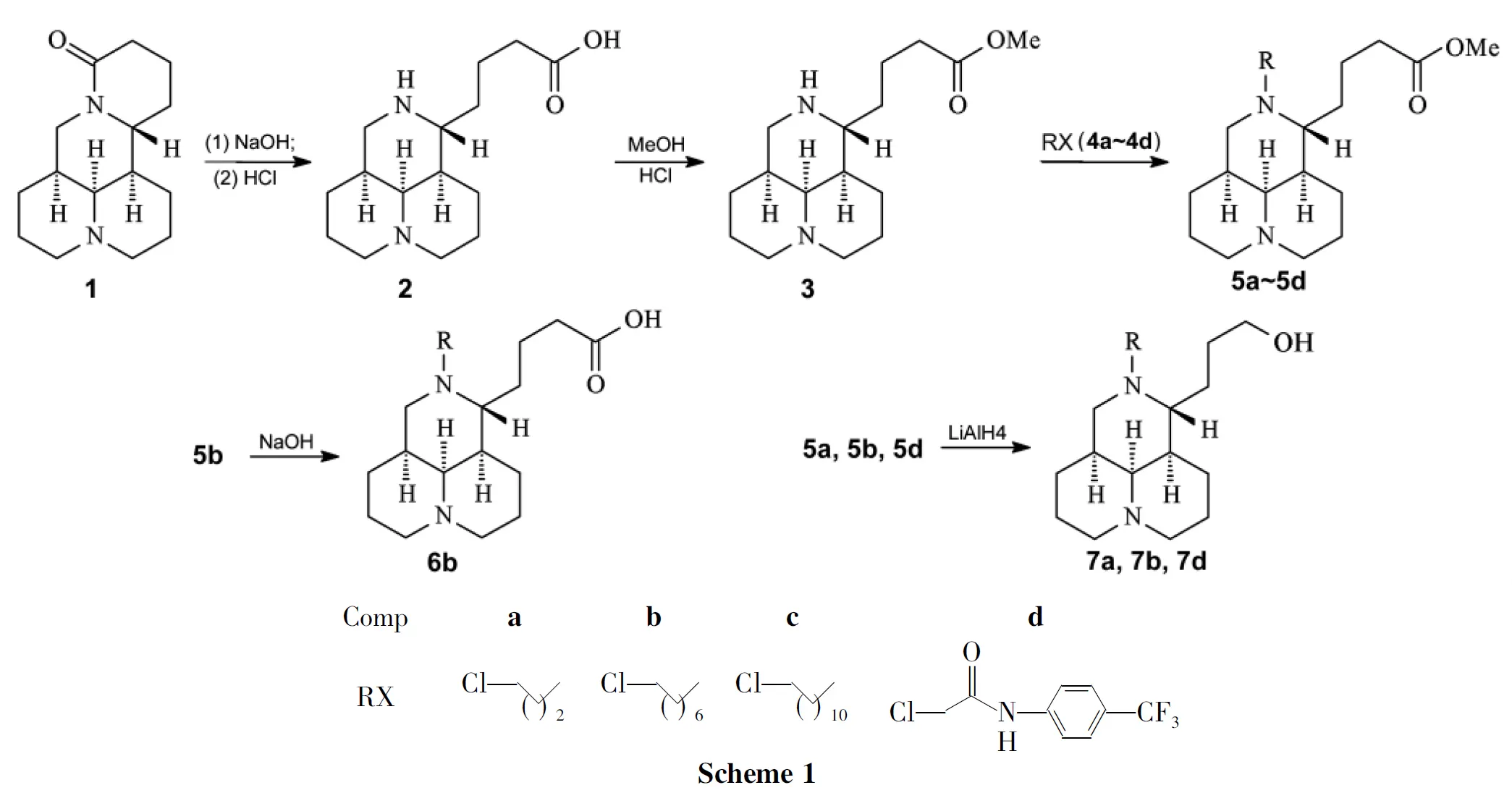
通过逆合成分析,本文以苦参碱(1)为起始原料,在碱性条件下水解内酰胺键,将其D环打开,制得裸露出12-N原子和11-位丁酸侧链羧基两个把手基团的苦参酸(2);先将2侧链的羧基转化成酯进行保护之后,再通过分别在12-N原子上引入不同结构类型的基团(卤代烷、取代酰基、取代磺酰基等)制得新化合物——12-N-取代基苦参丁甲酯(5a~5d);将5b的酯水解合成了新型的12-N-取代基苦参酸甲酯(6b);将5a,5b和5d酯用LiAlH4还原成伯醇,合成了一系列新型的12-N-取代基苦参酸丁醇(7a,7b和7d)(Scheme 1),其结构经1H NMR,13C NMR和HR-ESI-MS表征。并对5~7的抗结核菌株H37Rv的活性进行了初步的研究。通过5~7对H37Rv的MIC值,研究其构效关系。
1 实验部分
1.1 仪器与试剂
Varian Inova 400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Autospec Ultima-TOF型质谱仪。
4a~4d及四氢铝锂等均为分析纯;结核分枝杆菌标准株H37Rv,本课题组保存菌株;培养基,改良米氏7H9液体培养基(自配)。
1.2 合成
(1)苦参酸甲酯(3)的合成[9]
在反应瓶中加入120g和5mol·L-1NaOH溶液100mL,搅拌下回流使其溶解;回流反应2h。缓慢倾入烧杯中,自然冷却至室温,析出白色固体,过滤,滤饼缓慢加入6mol·mL-1盐酸(60mL),搅拌使其溶解。蒸干水得中间体2;加入甲醇100mL,搅拌使其溶解;过滤,滤液回流反应4h。蒸干溶剂得白色固体324g(无需纯化,直接用于后续反应)。
(2)5a~5d的合成(以5a为例)
在反应瓶中加入32.4g(8.57mmol)和乙腈20mL,搅拌使其溶解;依次加入K2CO33.34g和正溴丁烷(4a),于室温反应18h。过滤,滤液蒸干溶剂,残留物加入乙酸乙酯250mL和水250mL,搅拌使其溶解;分液,有机层用饱和食盐水(3×50mL)洗涤,无水Na2SO4干燥,蒸干溶剂得油状粗品,经COMBIFLASH快速柱色谱[洗脱剂:A=V(二氯甲烷)∶V(甲醇)=10∶1]纯化得棕色固体5a。
用类似的方法合成棕色固体5b~5d(其中5d用CH2Cl2为溶剂)。
12-N-正丁基苦参丁甲酯(5a):产率52%;1H NMRδ:4.10(t,J=10.1Hz,1H),3.89~3.84(m,1H),3.61(d,J=8.0Hz,1H),3.48~3.14(m,9H),3.13~3.01(m,1H),2.92~2.89(m,2H),2.78(d,J=8.0Hz,1H),2.44~2.22(m,3H),1.94~1.84(m,2H),1.69~1.58(m,9H),1.50~1.40(m,1H),1.39~1.25(m,2H),0.92(t,J=7.3Hz,3H);13C NMRδ:174.74,60.76,58.26(2),54.70(2),52.70,50.08,35.72,33.12,30.83,26.45,24.78,24.41,23.95,20.08(2),19.76,18.36,14.04;HR-ESI-MSm/z:Calcd for C20H36N2O2{[M+H]+}337.28495,found 337.28480。
12-N-正辛基苦参丁甲酯(5b):产率35%;1H NMRδ:3.61(s,3H),3.54~3.21(m,6H),3.06~3.02(m,2H),2.78~2.70(m,2H),2.44~2.27(m,2H),2.19(t,J=7.4Hz,1H),2.10~2.02(m,2H),1.96~1.79(m,2H),1.66(s,4H),1.61~1.43(m,5H),1.40(s,3H),1.34~1.21(m,9H),0.93~0.82(m,3H);13C NMRδ:174.91,61.80,60.26,58.84(2),56.52,51.69,50.08,34.15,33.10,31.69,31.61,29.04(2),28.97,28.86,26.80,24.97,22.52,22.50,20.38(2),19.08,14.38;HR-ESI-MSm/z:Calcd for C24H44N2O2{[M+H]+}393.34756,found 393.34744。
12-N-正十二烷基苦参丁甲酯(5c):产率36%;1H NMRδ:3.77~3.66(m,1H),3.60(s,3H),3.51~3.17(m,3H),2.92(t,J=12.5Hz,1H),2.81~2.62(m,2H),2.34(s,1H),2.25~2.10(m,2H),2.04~1.96(m,1H),1.89~1.81(m,2H),1.75~1.64(m,1H),1.63~1.39(m,8H),1.41~1.15(m,24H),0.86(t,J=7.3Hz,3H);13C NMRδ:174.97,63.64,7.15(2),57.05,56.91,53.08,51.60,35.56,34.20,33.71,32.94,31.76,29.47,29.38,29.22,29.17,29.02,28.00,27.26,26.86,26.51,24.99,22.56,20.95,20.70,18.98,14.41;HR-SEI-MSm/z:Calcd for C28H52N2O2{[M+H]+}449.41016,found 449.41013。
12-N-对三氟甲基苯胺羰甲基苦参丁甲酯(5d):产率26%;1H NMRδ:9.90(s,1H),8.57(d,J=8.6Hz,1H),7.48~7.39(m,1H),7.25(d,J=8.6Hz,1H),3.94(s,3H),3.55~3.50(m,1H),3.44~3.42(m,1H),3.27~3.20(m,3H),3.07~3.03(m,1H),2.98~2.82(m,2H),2.55~2.53(m,1H),2.31~2.16(m,3H),1.89~1.86(m,3H),1.80~1.69(m,2H),1.61~1.42(m,10H);13C NMRδ:174.88,169.97,51.25,128.07,126.24,23.55,121.57,121.25,115.30,111.63,63.63,57.02,55.08,54.32,54.06,51.46,36.00,33.65,30.94,27.63,25.34,24.73,19.57,19.03,18.81;HR-ESI-MSm/z:Calcd for C25H34N3O3F3{[M+H]+}481.25521,found 481.25487。
(3)12-N-正辛基苦参丁酸(6b)的合成
在反应瓶中加入5b0.39g(1mmol)和2mol·mL-1NaOH溶液20mL,搅拌下回流反应2h。用1mol·mL-1盐酸调至pH 1~2,析出固体,过滤,滤饼干燥得棕色固体6b,产率67%;1H NMRδ:12.05(s,1H),4.44~4.39(m,1H),4.07(t,J=10.0Hz,1H),3.94~3.84(m,1H),3.57(d,J=10.0Hz,1H),3.37~3.10(m,1H),3.06~2.80(m,4H),2.72(d,J=10.5Hz,1H),2.35(d,J=10.5Hz,1H),1.90~1.80(m,3H),1.79~1.58(m,8H),1.54~1.40(m,3H),1.36~1.28(m,13H),0.88(t,J=7.3Hz,3H);13C NMRδ:175.39,60.74,60.50,58.56(2),54.69,53.13,35.91,32.27,31.66,31.62,30.90,29.06,28.95,26.91,26.71,24.43,24.14,22.85,22.53,21.00,18.38,14.43;HR-SEI-MSm/z:Calcd for C23H42N2O2{[M+H]+}379.36829,found 379.3680。
(4)7a,7b和7d的合成(以7a为例)
在反应瓶中加入5a0.67g(2mmol)和无水THF 20mL,冰水浴冷却,搅拌下加入LiAlH491mg(1.2当量),于室温反应30min;滴加20%NaOH溶液5mL淬灭反应。过滤,滤液蒸干溶剂得油状粗品,经中压制备色谱(洗脱剂:A=5∶1)纯化得7a。
用类似的方法合成7b和7d。
12-N-正丁基苦参丁醇(7a):白色固体,产率30%;1H NMRδ:4.07(t,J=10.5Hz,1H),3.99~3.83(m,1H),3.31~3.21(m,5H),3.08~2.83(m,4H),2.71(d,J=10.5Hz,1H),2.35(d,J=10.5Hz,1H),1.80~1.63(m,13H),1.45~1.42(m,3H),1.42~1.26(m,4H),0.93(t,J=7.3Hz,3H);13C NMRδ:60.74,60.48,58.56(2),54.69,52.94,50.11,38.81,35.89,32.25,30.93,26.84,24.85,24.44,24.14,20.89,20.09,18.38,14.02;HR-ESI-MSm/z:Calcd for C19H36N2O{[M+H]+}309.29004,found 309.28980。
12-N-正辛基苦参丁醇(7b):棕色固体,产率47%;1H NMRδ:4.07(t,J=10.5Hz,1H),3.94~3.78(m,1H),3.78~3.48(m,6H),3.31~3.21(m,4H),3.06~2.81(m,3H),2.71(d,J=10.0Hz,1H),2.35(d,J=10.0Hz,1H),1.70~1.63(m,11H),1.51~1.45(m,3H),1.40~1.19(m,10H),0.88(t,J=7.3Hz,3H);13C NMRδ:60.74,60.50,58.55(2),54.69,53.14,50.06,35.91,32.27,31.66,30.92,29.06(2),28.95,26.89,26.71,24.43,24.14,22.85,22.54,20.96,18.37,14.43;HR-ESI-MSm/z:Calcd for C23H44N2O{[M+H]+}365.35264,found 365.35254。
12-N-对三氟甲基苯胺羰甲基苦参丁醇(7d):棕色固体,产率62%;1H NMRδ:10.08(s,1H),8.44(d,J=8.6Hz,1H),7.56~7.46(m,1H),7.30(d,J=8.6Hz,1H),4.63~4.59(m,1H),4.32~4.16(m,2H),4.13~4.04(m,1H),3.61~3.50(m,2H),3.28~3.24(m,2H),3.02~2.91(m,2H),2.58(d,J=11.2Hz,1H),2.44(d,J=11.2Hz,1H),1.95~1.60(m,12H),1.50~1.30(m,6H);13C NMRδ:164.46,152.82,127.25(2),126.19,118.92(2),61.18,60.69,60.43,56.76,54.69,54.62,52.29,36.57,32.28,30.71,29.66,29.22,24.32,24.08,23.71,18.44,18.32;HR-ESI-MSm/z:Calcd for C24H34N3O2F3{[M+H]+}454.26759,found 454.26786。
1.3 体外抗结核活性测定
无菌48孔板(本室研制结核菌快速药敏专用微量培养板)按药敏试验设计要求,各孔分别加入用2倍浓度培养基稀释的药物。各化合物制成适当浓度的的初溶液,用培养基稀释成各所用化合物的二倍浓度,每种化合物各10个梯度,加入48孔板每孔100μL。试验药终浓度分别为(128.0,64.0,32.0,16.0,8.0,4.0,2.0,1.0,0.5,0.25,0.125,0.0625)μg·mL-1。对照药异烟肼和利福平的终浓度分别为(32.0,16.0,8.0,4.0,2.0,1.0,0.5,0.25,0.125,0.0625,0.032)μg·mL-1。结核分枝杆菌H37Rv,每孔接种100μL,每孔菌量为4×10-3mg。设2个不含抗菌药的生长阳性对照孔和两个以蒸馏水替代培养基的生长阴性对照孔,将48孔板加盖后周围用透明胶带密封,置于湿盒37℃孵育。第3d后观察阳性生长对照孔和阴性生长对照孔,观察到两者有明确差别时,对各个试验孔细菌生长的数量和形态进行观察,判定抑制记录结果,第7d后再观察记录一次进行确认。
2 结果与讨论
2.1 体外抗结核活性
使用分枝杆菌微量直观快速药敏试验法,对5~7进行体外抗结核活性评价,结果见表1。从表1可见:
(1)维持11-位丁酸甲酯侧链不变,通过RX对12-位N进行修饰后发现:当取代基为烷基长链的衍生物(5a~5c)的抗结核活性均优于先导化合物Ⅰ;当12-位为正十二烷取代的衍生物(5c)抑制活性为8μg·mL-1,显示出较强的抗结核活性;而当12-位为取代芳酰基团时的衍生物(5d)对H37Rv的抑制活性为32μg·mL-1,活性略优于先导物Ⅰ。
(2)将11-位丁酸甲酯侧链水解为丁酸或还原为丁醇,6和7的抑制活性为(32~128)μg·mL-1,仅表现出中度的体外抗结核活性。

表1 化合物的抗结核活性Table 1 Antitubercular activities of compounds
(3)对于同系列的N-取代苦参丁酸,N-取代苦参丁醇,N-取代苦参丁酯,12-位侧链脂溶性(ClogP)的增大有利于活性的提高。
3 结论
以苦参碱为起始原料,以Ⅰ为先导物,在母核苦参酸上两个引入“把手”基团进行结构修饰和改造,设计并合成了10个结构全新的12-N-取代苦参酸衍生物(5~7)。初步构效关系表明:11-位丁酸甲酯侧链有助于抗结核活性的保持,酸基和醇羟基不是活性必须基团;12-位引入适当的疏水基团有利于抗结核活性的提高。12-N-正十二烷基苦参丁甲酯表现出较强的抗结核活性(MIC 8.0μg·mL-1),可作为候选物进一步开展其初步药代动力学以及安全性等成药性研究;也可作为探针化合物进一步探索其抗结核作用机制。
本研究结果为N-取代苦参酸衍生物的进一步抗结核活性研究提供了重要的科学依据,并可将本研究中使用的修饰策略应用于其他抗结核衍生物的设计与合成中。
本文采用的方法简便易行,原料易得,反应条件温和,后处理相对简便,具有较高的可行性。
[1] Jiao W W,Mokrousov I,Sun G Z,etal.Molecular characteristics of rifampin and isoniazid resistant Mycobacterium tuberculosis strains from Beijing,China[J].Chin Med J(Engl),2007,120:814-819.
[2] Zhao Y,Xu S,Wang L,etal.National survey of drug-resistant tuberculosis in China[J].N Engl J Med,2012,366:2161-2170.
[3] Verma S C,Dhungana G P,Joshi H S,etal.Prevalence of pulmonary tuberculosis among HIV infected persons in Pokhara,Nepal[J].J Nepal Health Res Counc,2012,10:32-36.
[4] Cain K P,Varma J K.Finding tuberculosis at the first encounter with HIV care:Don't miss the opportunity to save a life[J].Int J Tuberc Lung Dis,2012,16:1138.
[5] Tomioka H.Current status of some antituberculosis drugs and the development of new antituberculous agents with special reference to their in vitro and in vivo antimicrobial activities[J].Curr Pharm Des,2006,12:4047-4070.
[6] Spigelman M K.New tuberculosis therapeutics:A growing pipeline[J].J Infect Dis,2007,196(S1):28-34.
[7] FDA: FDA news release[http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm333695.htm].
[8] Liu Y X,Xiao C L,Wang Y X,etal.Synthesis,structureeactivity relationship and in vitro anti-mycobacterial evaluation of 13-n-octylberberine derivatives[J].Eur J Med Chem,2012,52:156-158.
[9] Wang L S,You Y J,Wang S Q,etal.Synthesis,characterization and in vitro anti-tumor activities of matrine derivatives[J].Bio Med Chem Lett,2012,22:4100-4102.
SynthesisandAntitubercularActivitiesofNovel12-N-substitutedMatrinicAcidDerivatives
FU Hai-gen,TANG Sheng,LI Ying-hong,SONG Dan-qing,WANG Yan-xiang
(Institute of Medicinal Biotechnology,China Academy of Medical Sciences and Peking Union Medical College,Beijing 100050,China)
A intermediate,methyl matrinate(3),was prepared by hydrolytic loop-open and carboxyl protection from matrine.Five novel methyl 12-N-substituted matrinate(5a~5d)were synthesized by alkylation(or acylation or sulfonyl)of 3with alkylbramides or substituted-acylchloride. A series of novel structural nucleus——12-N-substituted matrinic acid derivatives were synthesized by hydrolysis or reduction of esters of 5. The structures were characterized by1H NMR,13C NMR and HR-ESI-MS.Primary against Mycobacterium tuberculosis strain H37Rv activity tests indicated that methyl-12-N-dodecyl-matrinate exhibited a potent anti-mycobacterial activity with MIC value of 8.0μg·mL-1.
matrine;12-N-substituted matrinic acid;synthesis;antitubercular;structure-activity relationship
2014-06-26
“ 十二五重大新药创制”科技重大专项资助项目(2012ZX09301002-001-017)
付海根(1990-),男,汉族,江西吉安人,硕士研究生,主要从事药物合成的研究。Tel.010-63015284,E-mail:fuhaigen@hotmail.com
汪燕翔,博士,副研究员,Tel. 010-63015284,E-mail:lionking_0421@hotmail.com
O621.3;R914.5
A
1005-1511(2015)01-0739-05
