介质阻挡放电辅助甲烷蒸汽重整的动力学分析
2014-08-30刘倩郑洪涛杨仁陈曦
刘倩,郑洪涛,杨仁,陈曦
(哈尔滨工程大学动力与能源工程学院,哈尔滨黑龙江150001)
化学回热循环燃气轮机(CRGT)作为一种先进循环燃气轮机,其热效率由简单燃机的35.04%~40.1%增加到46.5% ~51.3%,NOx等污染物排放由几百微降低到十几微甚至1×10-6以下[1-2]。化学回热器作为CRGT的核心部件,通过强吸热的燃料蒸汽重整方式增加余热利用深度。目前,工业用甲烷蒸汽重整反应需要在高温(700~900℃)高压(2~3 MPa)的条件下在催化剂表面进行,为了和CRGT涡轮排气余热温度(350~500℃)相吻合,选择一种新的催化方式显得尤为重要。与传统的热化学方法相比,等离子体辅助甲烷蒸汽重整具有反应速度快、反应温度低、装置体积小、启动快等优点[3-4]。因此作者提出了采用介质阻挡放电(DBD)低温等离子体催化燃料蒸汽重整技术用于化学回热器设计的新思路。由于DBD具有明显的非平衡特性,为了提高目的产物的收率以提高能源利用率,需要对DBD催化蒸汽重整的反应机理进行研究。目前国内外学者在数值研究方面有了一定进展,主要建立了纯流体加热模型[5]、Fluid 模型[6]、0维替代模型[7]、汤生(Townsend)电离模型[8]等。上述学者多对DBD催化甲烷偶联、部分氧化或二氧化碳重整等进行了数值研究,而对DBD催化甲烷蒸汽重整的数值研究较少。
考虑到水蒸气的来源问题,目前学者通过实验主要研究了水浴温度(120℃左右)下等离子体催化甲烷蒸汽重整特性[9-10]。而在化学回热循环燃气轮机中,蒸汽通过蒸汽发生装置产生,含量充足,因此研究高蒸汽流量下的等离子体催化甲烷蒸汽重整情况显得十分必要。首先通过实验的方法研究较高温度(350~500℃)时不同操作参数对重整过程中反应物转化及其产物选择性的影响规律,为反应机理的研究提供数据支持。然后发展和建立一套可用于描述DBD催化甲烷蒸汽重整的详细反应机理方程,并结合敏感性分析及其实验数据对其进行修正和完善。再结合该动力学机理模型和CHEMKIN中路径分析模块研究低温常压无催化剂时单独等离子体催化甲烷蒸汽重整技术对甲烷转化的动力学影响。最后通过在放电区域添加Ni催化剂的实验即等离子协同催化实验对上述分析进行了初步的验证。
1 实验装置
实验装置见图1。反应物为甲烷和水蒸气,其中水蒸气由蒸汽炉产生,同时在入口反应物中加入体积分数为10%的氮气,用于定量计算出口处气体总摩尔流量。甲烷和氮气流量通过质量流量控制器(Brooks 5850E)控制,水流量通过平流泵(Beijing Xingda Co.,2PB00C)控制。气体掺混均匀后进入反应器。DBD反应器采用石英玻璃作为阻挡介质,其放电区域长130 mm,放电间隙为1 mm,总放电区域体积为12 cm3,见图2。反应器采用陶瓷加热器进行加热,并利用温度控制器控制其加热温度,保证温度稳定在设定值。由于热惯性,实际温度值与设定温度值有5℃左右的偏差。反应器输入电压和频率是由低温等离子体电源(CTP-2000K)控制,其放电电压为4 000 V,频率为41.93 kHz,总有效输入功率为70 W。在每组实验的开始和结尾均记录电压和频率值以确保实验的稳定运行。反应器出口处气体利用气相色谱仪(Agilent GC 7890A)进行定性和定量分析,其中CH4通过FID检测器进行分析,CO、CO2和 N2通过 TCD B检测器进行分析,H2通过TCD C检测器进行分析。为了保证色谱仪的正常工作,出口处未参加反应的水需要通过冷凝器冷凝,气体样本在进入色谱仪之前再次用变色硅胶进行干燥,确保没有水蒸气进入色谱仪。实验分别在不同的停留时间、水蒸气/甲烷摩尔比和反应温度下进行,各实验中压力均为0.12 MPa。
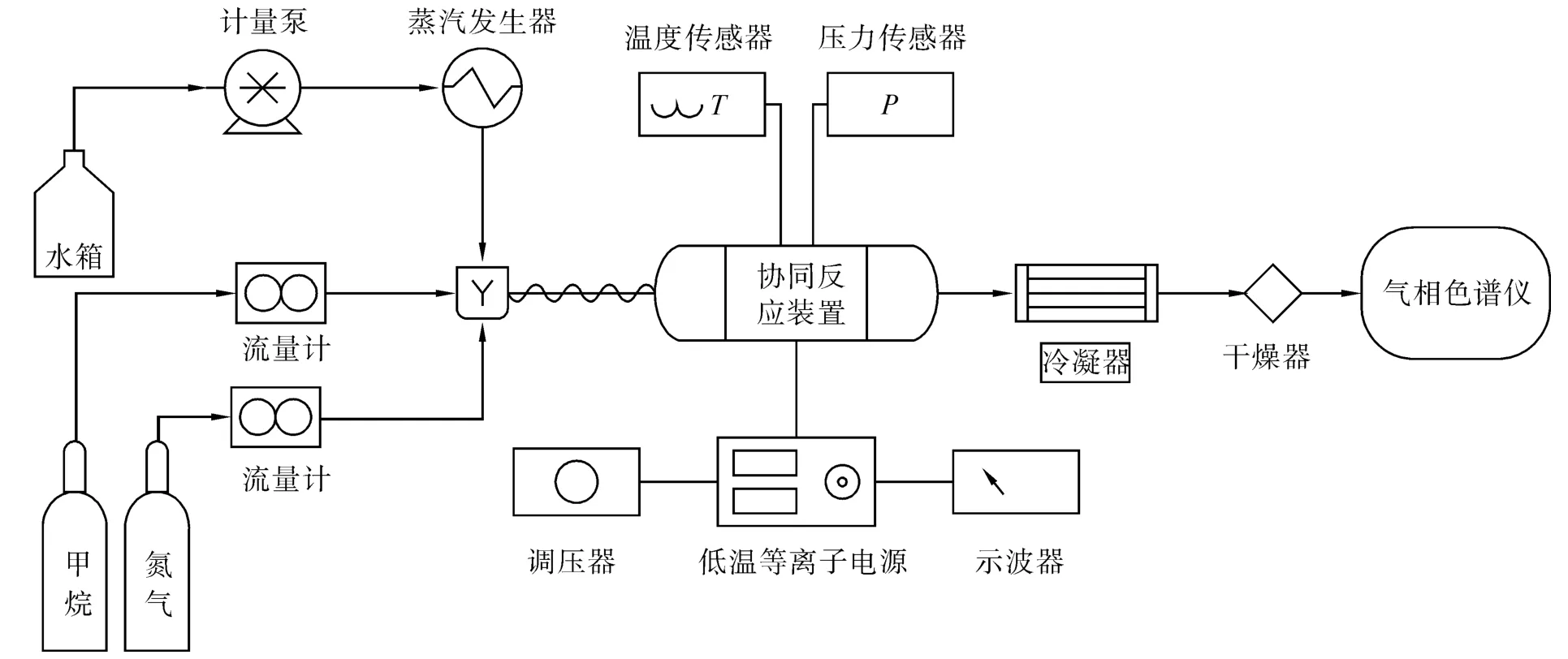
图1 介质阻挡放电催化系统示意图Fig.1 Diagram of dielectric barrier discharge-assisted system
利用可视化反应器(见图2(a))确定了等离子协同催化(discharge packed bed reactor,DPB)反应器能够正常工作的结构形式为双阻挡介质结构,即分别在内、外电极的外侧、内侧放置一环形阻挡介质,见图3。DPB反应器中采用的催化剂为商用Ni质量分数为40%的 Ni/SiO2催化剂,颗粒大小为φ5 mm×2.5 mm圆柱的1/4(山东齐鲁化学研究所供应)。

图2 实验用反应器Fig.2 Experimental reactor
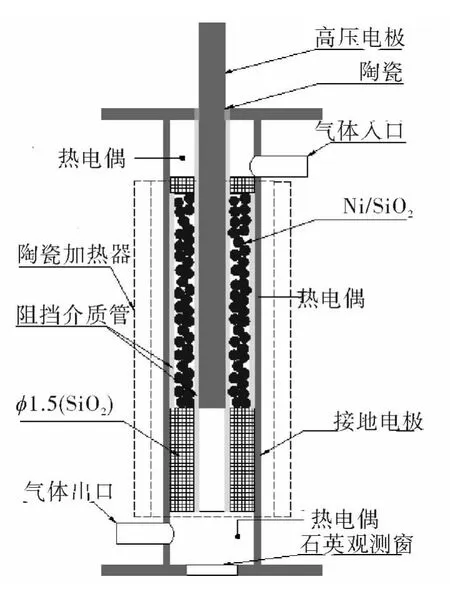
图3 定型DPB反应器结构示意图Fig.3 Structural sketch of final DPB reactor
2 结果和讨论
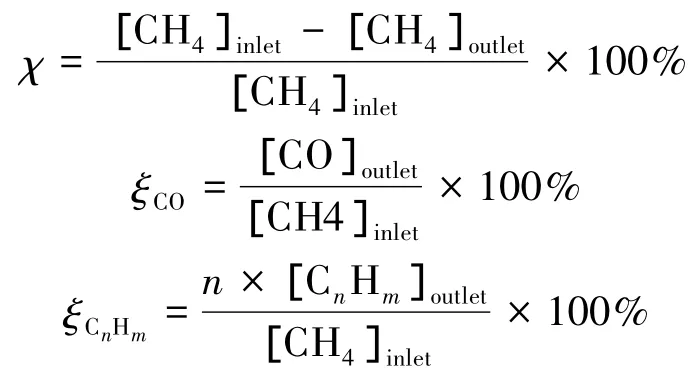
实验中采用甲烷转化率χ及产物产量ζi作为反应器性能评价标准,其定义如下:
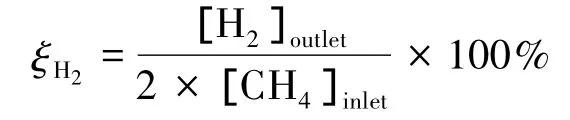
2.1 动力学模型建立
根据低温等离子体化学理论,低温等离子体化学催化过程主要包括电子碰撞反应和自由基反应。在折合电场作用下放电区域发生部分高能电子(1eV<Te<10eV)碰撞CH4和H2O分子发生激发、解离和电离等反应,产生振动活化组分、自由基、离子和电子等组分。其中自由基参与的反应在甲烷转化中占主导地位,离子在反应中几乎不起作用[11]。产生的自由基进一步反应生成合成气(H2+CO)及低碳烃(C2/C3)。根据实验结果,在计算过程当中包含了 C2、C3、C4、C5及其炭黑(C)。为了不使等离子体催化重整的化学反应机理进一步复杂化,机理的提出主要围绕合成气和低碳烃的产生过程进行建立和优化,而关于高碳烃的产生主要采用了2个反应方程代替,并对其Arrhenius系数进行部分修正。
等离子体催化过程中的电子碰撞反应仅发生在高能电子群内,即只有达到一定能量的电子才能有效碰撞反应物分子,并以一定的概率发生化学反应。采用全局平均电子能量替代局部高能电子能量,即建立电子碰撞反应速率常数与平均电子能量的关系式。首先基于电子碰撞截面数据,利用BOLSIG+软件[12],求解Blotzmann方程,得到了反应速率常数与平均电子能量之间的对应关系;然后结合平均电子能量与电子温度的关系式,通过ORIGIN进行拟合,得到反应速率常数关于电子温度的Arrhenius形式关系式,而电子E也作为一种普通的气相组分参与反应[13]。自由基反应的反应速率常数通过 NIST Chemistry Webbook查询得到。
低温等离子体催化重整模型包括质量守恒方程、物质组分守恒方程及其气体能量守恒方程和电子能量守恒方程。在计算过程中,假定自由基一旦产生便扩散到整个区域,即为0维模型。基于低温等离子体催化理论知识及其实验过程中测定的温度情况可知,等离子体催化过程中电子温度较高,而中性组分和自由基的温度基本保持不变,即与来流气体温度一致。因此在模型设置中假定气体温度保持不变。注意模型中没有包括用于计算电势的泊松方程,因此计算过程中没有考虑电荷分布及其电极附近鞘层的形成等。选择输入功率P作为可以调节的参数,通过改变P保证甲烷出口浓度与实验数据接近,并根据相关文献和实验数据,利用CHEMKINPRO软件中的敏感性分析模块,最终给出了包含175个反应方程及39种组分的反应方程组,使甲烷转化及产物产量与实验结果基本吻合。反应机理模型建立过程中采用压力为1.2×10-6MPa,反应温度为400℃,停留时间为0.59 s,S/C 为2,输入功率为70 W时的操作条件下的实验结果作为对照依据,该输入功率一旦选定则保持不变,避免输入功率变化对甲烷转化率和产物分布的影响。
分子组分: ECH4H2O H2CO2COC2H6C2H4C2H2CH3OHCH3OCH2OC3H8C3H6C4H10C5H12,
自由基组分:CH3CH2CHCC2H5C2H3C2HHCOOH HO I*C3H7N*C3H7C4H9,
离子组分:CH4+CH3+H-CH2-OH-O-CH2+CH+C+。
2.2 模型的优化和证实
图4表明了实验研究中停留时间τ、水蒸气/甲烷摩尔比(S/C)和反应温度T对甲烷转化率和各产物产量的影响规律。为了证实得到的反应机理方程,利用动力学模型计算了不同操作条件下的甲烷转化率和各产物组分的产量,如图4所示。
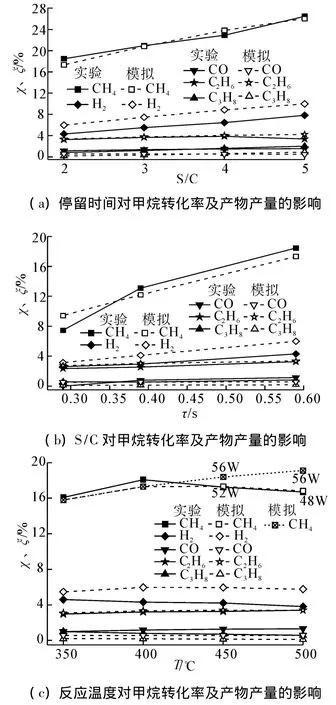
图4 不同操作条件对产物产量的影响规律Fig.4 The rules of different operating conditions on products yield
结果表明:该反应机理能准确预测不同操作条件下的甲烷转化率的变化规律及其各产物产量的变化趋势,其中C2H6的预测值与实验值偏差在4%以内,但是该动力学模型高估了H2的产量(偏差约为18% ~40%)、低估了CO(偏差约为60% ~80%)和C3H8的产量(偏差约为20% ~50%)。在实验过程中可以观测到略显黄色且带有刺激性气味的油滴,这是在冷凝器中液化成油滴且随着冷凝水流出的高碳烃。说明在实验过程中部分甲烷转化为C4以上的高碳烃。由于在反应机理中仅采用2个方程表明高碳烃的生成,因此对高碳烃产量的低估可能是高估H2产量的主要原因,从路径图5中也可以看出,大部分中间产物通过和H基的抽氢反应生成了H2,这与文献[14]分析结果一致。
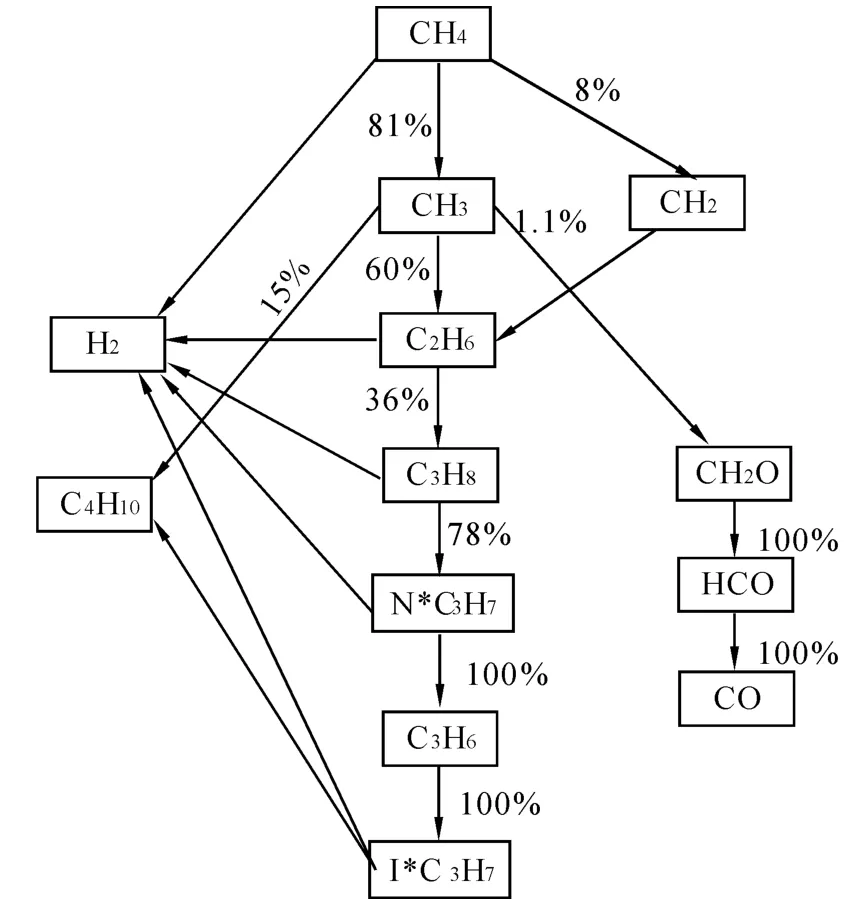
图5 反应路径图Fig.5 Reaction path flux analysis
2.3 动力学分析
图4(a)表明随着停留时间的增加,甲烷转化率和产物产量均大幅度增加。这是因为当等离子体电源功率一定时,高能电子密度和能量基本保持不变,较长的停留时间增加了电子碰撞反应的概率,并且由于等离子体具有非平衡特性,高能电子碰撞CH4产生的 CH3之间发生偶联反应产生了 C2H6及其C3H8等,当停留时间较长时,C2、C3等组分又进一步脱氢偶联,生成了C4以上的高碳烃,使甲烷转化率提高,具体见表1。
图4(b)为S/C的影响,由于实验过程中为保证停留时间不变,S/C增加意味着甲烷的含量逐渐减小。从图中可知随着S/C增加,甲烷转化率、H2和CO产量单调增加。从直方图6(a)可知,影响甲烷转化的主要反应方程为R130、R129、R3及其R37,其中R130和R129分别为CH4与OH基和H基的反应,而OH基和H基主要来自电子碰撞H2O解离反应方程R12。图7(a)表明了不同S/C对各主要反应中的消耗速率的影响规律。从图中可知,随着S/C增加,R12中电子碰撞H2O的消耗速率大幅度增加,即电子碰撞H2O的概率增加,而R3中电子碰撞CH4的消耗速率略有下降;但由于OH基和H基的浓度增加,虽然甲烷含量降低,R129和R130的反应速率基本保持不变。图6(a)表明随着S/C增加,CH4的总消耗速率是降低的,这与文献[10]结果一致;但由于本实验中甲烷含量逐渐减小,因此相对消耗速率大幅度增加,CH4转化率提高。
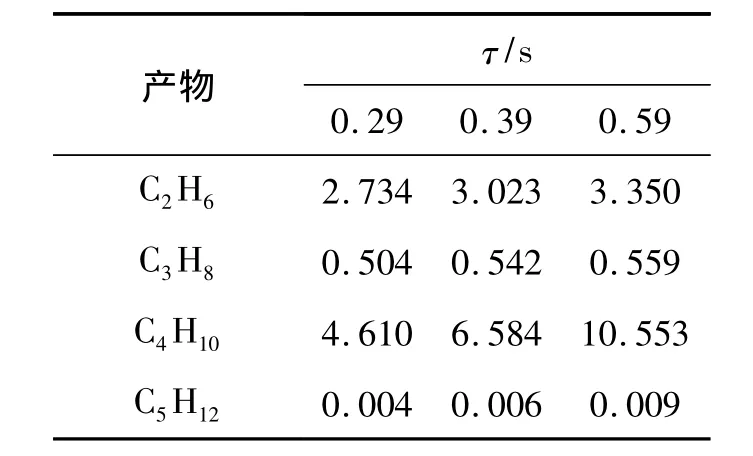
表1 不同停留时间对碳氢化合物产量的影响Table 1 Effect of resident time on hydrocarbon yield %
图4(c)表明了反应温度对甲烷转化率和产物产量的影响规律。在数值模拟中,当输入功率保持不变即设定值为56 W时,甲烷转化率呈线性增长趋势。根据图7(b)可知,温度对电子碰撞CH4和H2O(R3和R12)的反应速率几乎没有影响,但随着温度增加,CH4和H基反应速率增强(R129),CH4的总消耗速率不断增加。而实验研究表明随着反应温度的增加,甲烷转化率呈现先增加后减少的趋势。这可能是由于温度的增加导致石英玻璃管的电导率增加,欧姆损耗和介电损耗等增强,当输入功率不变时,作用于反应气体的功率减少[15]。因此在数值研究中,随着反应温度的增加,相应地降低输入功率,对应于反应温度为450℃和500℃时的功率分别调整为54 W和52 W,此时CH4转化率结果与实验值吻合较好,这也证实了温度对阻挡介质材料属性的影响。

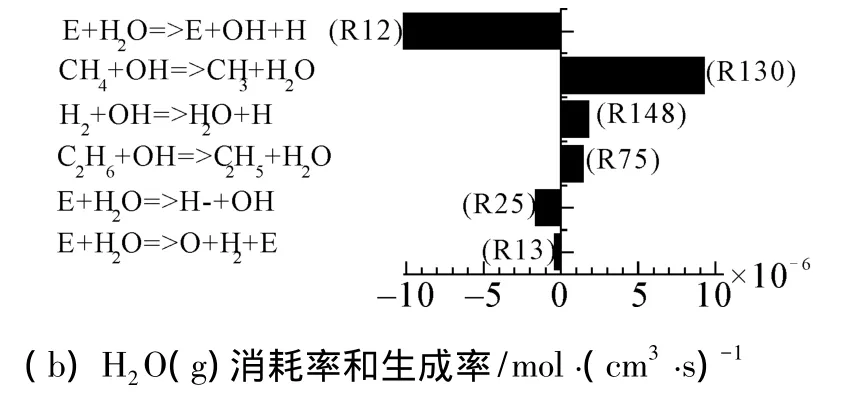
图6 CH4和H2O的主要的产生和消耗反应的反应速率Fig.6 Time-averaged reaction rates of the dominant reaction pathways for the production and consumption of CH4and H2O
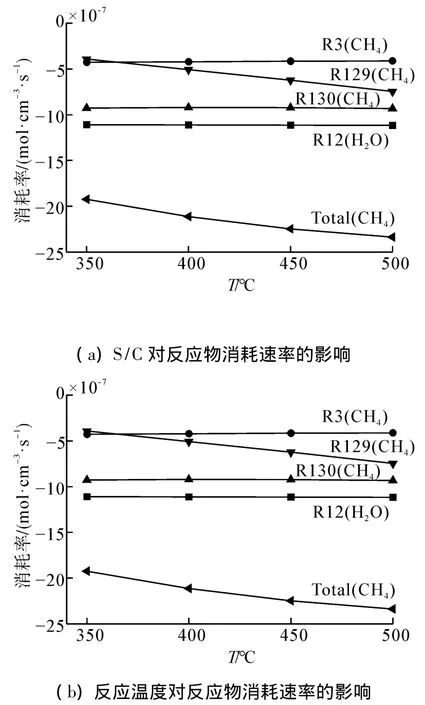
图7 S/C和反应温度对反应物消耗速率的影响Fig.7 Consumption rate of reactants with increasing S/C,wall temperature
为了明确等离子体催化甲烷蒸汽重整过程中影响产物选择性的主要反应,结合优化的反应机理,利用CHEMKIN-PRO软件中的路径流分析模块,进行了反应路径流分析。操作条件是压力为1.2×10-6MPa,反应温度为400 ℃,停留时间为0.59 s,S/C为2,输入功率为70 W。不同操作条件下的反应路径基本一致,只是百分数略有不同。甲烷主要通过电子碰撞反应及其与OH基和H基结合产生CH3,而CH2、CH及C的产量较少。从实验结果可知,CO产量较低,仅为1%,低碳烃(C2、C3)产量在4%左右,另一部分甲烷转化为高碳烃化合物。从路径图7分析可知,60%的CH3基结合生成了C2H6,并进一步通过脱氢偶联反应转化为高碳烃;仅有1.1%的CH3基和O基结合通过路径CH3+O→CH2O→HCO→CO最终生成了CO,而CO几乎没有转化为CO2,这与实验结果相吻合。
根据方程(1)、(2)可知,甲烷蒸汽产生合成气的反应为强吸热反应,而甲烷偶联生成碳烃化合物的反应则为弱吸热反应,不利于余热回收。因此增加合成气的产量和避免高碳烃的生成是提高余热回收利用的主要手段,结合路径分析图,主要应采取2个措施:1)抑制CH3基再结合生成C2H6;2)提高O基浓度,即提高CH3基与O基结合的反应速率。通过H2O生成和消耗速率图可知,通过电子碰撞反应83%的反应的H2O的生成了OH基和H基,仅有3%的反应的H2O生成了O基,而且生成的OH基的大部分又和CH4再结合生成了H2O。因此抑制OH基与CH4的结合,同时促进OH→O是提高O基浓度的关键。
由催化剂表面的甲烷蒸汽重整反应机理可知[16],通过选择合适的催化剂,如 Ni催化剂,可以保证通过高能电子碰撞反应产生的自由基及时吸附到催化剂表面,利用催化剂的选择性特点,降低烷基与烷基的再结合概率,提高OH基向O基的转化,从而提高合成气的产量,降低高碳烃的产量,见式(3)~(10):
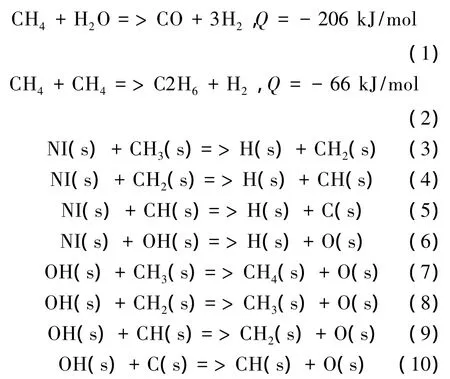
2.4 等离子协同催化实验验证
根据实验及数值研究结果可知,甲烷蒸汽重整过程中会产生高碳烃,该反应过程近似绝热甚至是放热,不利于余热的回收利用;且在化学回热循环燃气轮机中,化学回热器产生的裂解气将直接注入燃烧室燃烧,较高分子量的燃料不利于提高燃烧效率和拓宽熄火极限。因此,作者首次提出有效碳回收率的概念,用以表征裂解气中碳的存在形式,作为衡量回热特性和燃烧特性的宏观评价指标。
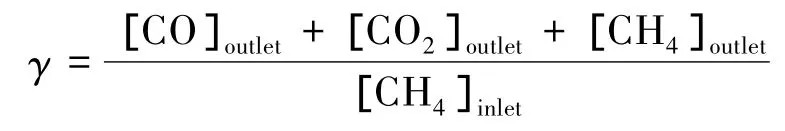
利用DPB反应器,研究了压力为1.2,反应温度为400℃,停留时间为0.39 s,S/C为2,输入功率为70 W时的操作条件下的甲烷蒸汽重整情况,各重整特性参数见表2。从表中可知,在放电区域加入催化剂后,合成气的产量有了显著提高,C2及C3产量为0%,有效碳回收率达到了100%,即产物中没有生成高碳烃等。因此该实验结果与动力学预测结果相吻合,在接下来的工作中,作者将结合实验数据,在等离子体催化甲烷蒸汽重整反应机理模型的基础上进一步研究等离子体与催化剂协同催化时的反应机理及其重整特性。
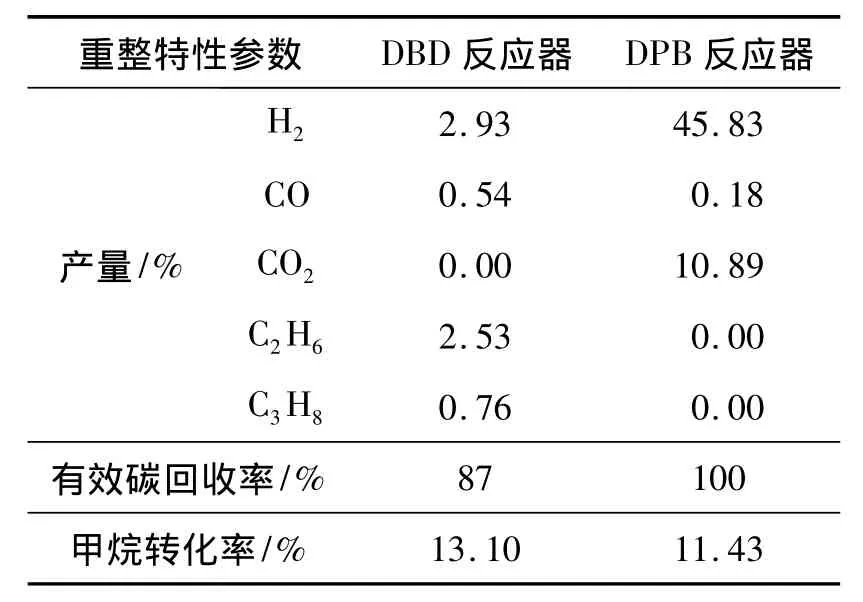
表2 不同催化反应器下重整结果对照表Table 2 Comparison of reforming results under different reactors
3 结论
1)实验研究发现DBD辅助甲烷蒸汽重整在停留时间为0.59 s时有较高的转化率,但有效碳回收率较低,不同操作条件下CO产量为1%,低碳烃(C2、C3)产量为4%左右,剩余CH4转化为高碳烃(C4以上);
2)发展并完善的动力学机理可以准确预测不同操作条件下DBD催化重整过程中的甲烷转化率及其各产物产量的变化趋势。其中CH3+CH3→C2H6和 OH+CH4→H2O+CH3是影响CO产量的主要限制反应;
3)等离子与催化剂协同催化实验中有效碳回收率达到100%,通过在放电区域添加Ni催化剂,可以提高合成气的产量,避免高碳烃生成。在接下来的工作中将进一步研究其动力学机理。
[1]CARCSACI C,FACCHINI B,HARVEY S.Modular approach to analysis of chemically recuperated gas turbine cycles[J].Energy Conversion Management,1998;39(16/18):1693-1703.
[2]PAN Fumin,ZHENG Hongtao,LIU Qingzhen,et al.Design and performance calculations of chemically recuperated gas turbine on ship[J].Proc IMechE Part A:J Power and Energy,2013,227(8):908-918.
[3]HAMMER T,KAPPES T,BALDAUF M.Plasma catalytic hybrid processes:gas discharge initiation and plasma activation of catalytic processes[J].Catalysis Today,2004,89:5-14.
[4]颜士鑫,李晓东,钟犁,等.滑动弧等离子体协助甲烷蒸汽重整制氢[J].太阳能学报,2011,32(5):766-770.YAN Shixin,LI Xiaodong,ZHONG Li,et al.Gliding arc discharge plasma assisted reforming of methane into hydrogen with oxygen and water vapor[J].Acta Energiae Solaris Sinica,2011,32(5):766-770.
[5]RUSU I,CORMIER J M.On a possible mechanism of the methane steam reforming in a gliding arc reactor[J].Chemical Engineering Journal,2003,91:23-31.
[6]PETROVI D,MARTENS T,Van DIJK J,et al.Modeling of a dielectric barrier discharge used as a flowing chemical reactor[J].Journal of Physics:Conference Series,2008,133:1-8.
[7]NAIR S A,NOZAKI T,OKAZAKI K.Methane oxidative conversion pathways in a dielectric barrier discharge reactor-Investigation of gas phase mechanism[J].Chemical Engineering Journal,2007,132:85-95.
[8]李洁,王彧婕,龙华丽,等.强电场中甲烷活化的汤生模型及反应动力学分析[J].化学工程,2007,35(8):25-28.LI Jie,WANG Yujie,LONG Hihua,et al.Townsend ionization model and kinetic analysis of methane activated in strong electric field[J].Chemical Engineering,2007,35(8):25-28.
[9]SUGASAWA M,TERASAWA T,FUTAMURA S.Effects of initial water content on steam reforming of aliphatic hydrocarbons with nonthermal plasma[J].Journal of Electrostatics,2010,68:212-217.
[10]ZHANG X,WANG B W,LIU Y W,et al.Conversion of methane by steam reforming using dielectric-barrier discharge[J].Chinese Journal of Chemical Engineering,2009,17(4):625-629.
[11]HIRAOKA K,AOYAMA K,MORISE K.A study of reaction mechanisms of methane in a radio-frequency glow discharge plasma using radical and ion scavengers[J].Canadina Journal of Chemistry,1985,63:2899-2905.
[12]HAGELAAR G J M,PITCHFORD L C.Solving the Boltzmann equation to obtain electron transport coefficients and rate coefficients for fluid models[J].Plasma Sci Sources and Tech,2005,14:722.
[13]KEE R J,RUPLEY F M.,MEEKS E,et al.CHEMKINIII:a Fortran chemical kinetics package for the analysis of gas-phase chemical and plasma kinetics.SAND96-8216,1996 CHEMKIN-PRO[R].San Diego:Reaction Design,2008.
[14]SUN W T,UDDI M,WON S H,et al.Kinetic effects of non-equilibrium plasma-assisted methane oxidation on diffusion flame extinction limits[J].Combustion and Flame,2012,159(1):221-229.
[15]HAMMER T H,KAPPES T H,BALDAUF M.Plasma catalytic hybrid processes:gas discharge initiation and plasma activation of catalytic processes[J].Catalysis Today,2004,89:5-14.
[16]JANARDHANAN V M,DEUTSCHMANN O.CFD analysis of a solid oxide fuel cell with internal reforming:coupled interactions of transport,heterogeneous catalysis and electrochemical processes[J].J Power Sources,2006,162(2):1192-1202.
