CC16在慢性阻塞性肺疾病急性加重期血清和痰液中的变化及临床意义
2014-08-30沈奕播刘双林聂洪玉王长征徐东兰
沈奕播 刘双林 聂洪玉 李 琦 王长征 徐东兰
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases, COPD)是以持续性的气流受限为特点,气流受限不完全可逆呈进行性发展,主要与肺脏对有害气体和颗粒的异常炎症反应有关,是一种可以预防及治疗的疾病。COPD已成为全球第四位的致死原因,在我国>40岁的人群中COPD患者发病率高达至8.2%,农村人口发病率更高,因其高发病率,高病死率,目前对COPD的治疗和预防具有非常重要的意义[1-4]。Clara细胞分泌蛋白(CC16)主要由终末细支气管和呼吸性细支气管上皮的非纤毛细胞Clara细胞分泌的一种蛋白质,因其相对分子量接近16×103,故称为CC16。目前研究发现它参与人体炎症反应、调节免疫及抗纤维化等作用,对气道炎症反应具有保护作用[5-7]。研究显示COPD患者血清CC16浓度显著低于健康对照组,而在慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease, AECOPD)患者血清中CC16水平较稳定期COPD患者和健康对照组显著降低,经过治疗后CC16浓度可升高,表明其对COPD的严重程度及治疗后的评估有一定临床意义[8-11]。目前CC16在AECOPD患者痰液中的检测及意义国内外报道较少。本研究通过对AECOPD患者血清和痰液中CC16含量的检测,旨在进一步探讨CC16与AECOPD的关系。
对象与方法
一、研究对象
本研究分为四组:①吸烟对照组30例;②不吸烟对照组30例;③COPD稳定期组30例;④AECOPD组31例。所有COPD患者诊断及病情分级均符合2007 慢性阻塞性疾病全球倡仪(global initiative for chronic obstructive lung disease, GOLD)指南中诊断标准Ⅱ~Ⅳ级患者[1]。所有AECOPD组患者还需符合:近期内咳嗽、咳痰及呼吸困难症状在基线水平上急性加重,需调整治疗方案。此外AECOPD及COPD组患者均需排除:①除外其他的呼吸系统疾病如:肺炎、哮喘等;②长期或近期使用免疫抑制剂者,由结核、真菌、肿瘤等因素导致的慢性喘息者;③合并有肝、肾和造血系统等严重疾病者;④研究前30 d内,有全身糖皮质激素和长期吸入糖皮质激素+长效β2受体激动剂(inhaled corticosteroids+long-acting beta2-agonists, ICS+LABA)史;⑤经检查证实突发气胸、肺栓塞导致的症状加重者。选用同龄人为对照组,吸烟指数>200支年。
二、研究方法
1. 外周血采集和处理:四组患者采集空腹静脉血4 ml,AECOPD患者血清需在治疗前空腹采集。外周血标本采集后室温静置20 min,以离心半径8 cm,3000 r/min离心10 min后分离血清,血清标本置于-70℃冻存,待测CC16及炎症因子浓度。
2. 痰液采集和处理:清晨清洁漱口后,嘱患者深吸气后用力咳出(或于3%高渗盐水5~7 ml以雾化吸入诱导咯痰)于培养皿中。将痰液以4倍等体积0.1%的二硫苏糖醇稀释后涡旋震荡10 min,再加入等体积的磷酸盐缓冲液充分震荡5 min,以离心半径8 cm,2000 r/min离心10 min,上清液分装置于-70°冰箱冻存,待测CC16及炎症因子。
3. CC16及炎症因子的测定:均采用ELISA检测血清及痰液中的CC16及炎症因子的浓度,操作步骤严格按照说明书操作。
三、统计学方法
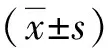
结 果
一、一般情况
四组患者在年龄上无显著性差异,AECOPD组与COPD组患者病程及吸烟指数也无显著差异(P>0.05)。第1 s用力呼吸容积占预测值百分比(forced expiratory volume in one seond percentage, FEV1%)和1 s用力呼气容积占用力肺活量百分比(forced expiratory volume in one second/forced vital capacity, FEV1/FVC)在对照组与COPD组与AECOPD组有统计学差异(P<0.05),见表1。
二、主要指标
CC16在血清中的浓度变化显示,不吸烟对照组CC16显著高于其他三组(P<0.05),而吸烟对照组显著高于COPD及AECOPD组(P<0.05),COPD组高于AECOPD组,组间差异有统计学意义(P<0.05)。IL-6、IL-8、TNF-α在不吸烟对照组浓度低于其他三组,且有统计学意义(P<0.05),吸烟对照组低于COPD及AECOPD组,并有统计学意义(P<0.05),COPD组低于AECOPD组,组间有统计学意义(P<0.05),见表2。痰液中CC16与各指标的浓度变化,见表3。

表1 四组患者一般情况
注:a与COPD组及AECOPD组比较P<0.05;FEV1%:第1秒用力呼气容积占预测值百分比;FEV1/FVC1(%):1秒用力呼气容积占用肺活量百分比

表2 血清中各指标浓度比较
注:a与AECOPD组比较P<0.05;b与COPD组比较P<0.05;c与吸烟对照组比较P<0.05;CC16:Clara细胞分泌蛋白;IL-6:白介素-6;IL-8:白介素-8;IL-10:白介素-10;TNF-α:肿瘤细胞坏死因子-α
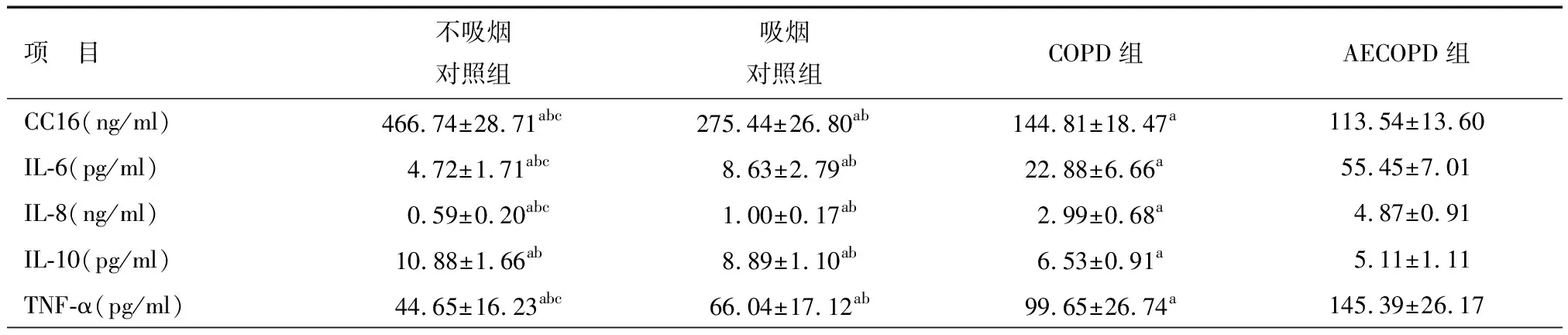
表3 痰液中各指标浓度比较
注:a与AECOPD组比较P<0.05;b与COPD组比较P<0.05;c与吸烟对照组比较P<0.05;CC16:Clara细胞分泌蛋白;IL-6:白介素-6;IL-8:白介素-8;IL-10:白介素-10;TNF-α:肿瘤细胞坏死因子-α
三、AECOPD患者血清及痰液中CC16与炎性因子的相关性分析
AECOPD患者血清中CC16与IL-6、IL-8、TNF-α水平呈明显的负相关性(P<0.05),与IL-10呈明显正相关性(P<0.05),见表4。痰液中各指标的相关性,结果与血清中一致,见表5。
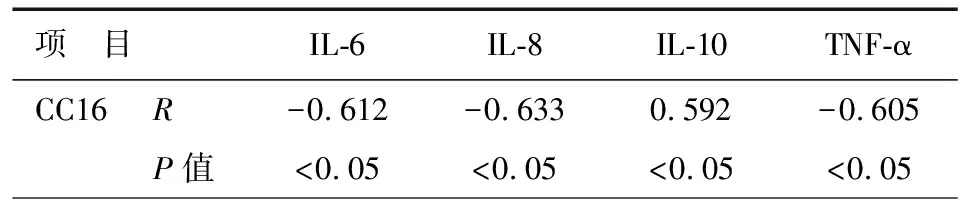
表4 AECOPD患者血清中CC16与各指标相关性
注:CC16:Clara细胞分泌蛋白;IL-6:白介素-6;IL-8:白介素-8;IL-10:白介素-10;TNF-α:肿瘤细胞坏死因子-α
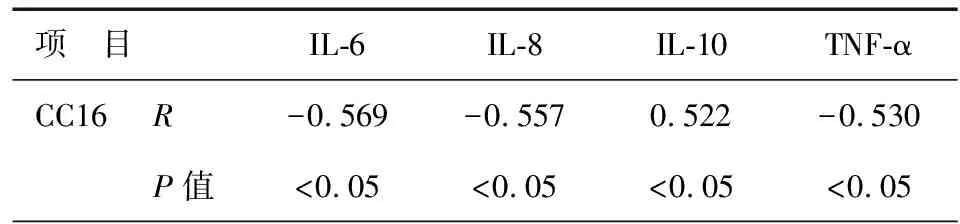
表5 AECOPD患者痰液中CC16与各指标相关性
注:CC16:Clara细胞分泌蛋白;IL-6:白介素-6;IL-8:白介素-8;IL-10:白介素-10;TNF-α:肿瘤细胞坏死因子-α
讨 论
本研究比较了健康对照组(30例)、吸烟对照组(30例)、COPD组(30例)及AECOPD组(31例)四组的一般情况资料。资料显示各组女性志愿者相对较少,这与中国吸烟女性较少有关。通过对血清及痰液中CC16的检测,发现吸烟对照组、COPD及AECOPD组CC16的浓度均有下降,本研究与国外的报道基本一致。Lomas等[5]对2083例稳定期COPD患者研究发现:COPD患者血清CC16显著低于正常对照组。但上述研究并未涉及不同程度的COPD患者组间有无统计学差异,而Park等[12]的研究中患者血清CC16浓度与肺功能FEV1呈显著的负相关。这些研究均提示血清CC16水平下降是区别COPD与健康对照组的重要标志物,并且与COPD气流受限程度具有相关性。
本研究发现CC16最大的差异在于吸烟对照组与非吸烟对照组。这都提示吸烟对CC16水平影响较大,也进一步提示了吸烟的危害。这与Lomas等[5]的研究一致。研究表明CC16水平下降也是吸烟对气道损害的重要生物标志物。动物实验也进一步证实吸烟所致的慢性肺部炎症可引起CC16分泌减少,从而导致血清中CC16水平下降。因而吸烟可能导致肺泡上皮Clara细胞分泌颗粒减少,引起血清和痰液中CC16水平下降[13]。
本研究发现细胞因子IL-6、IL-8、IL-10、TNF-α在四组组间的血清及痰液中存在统计学差异,这与国内外报道一致[14-15]。这提示长期吸烟可能已经引起炎症细胞在肺内的活化及浸润,释放出大量的细胞因子和炎性介质。而大量的研究显示烟雾对呼吸道的损害呈累积性,最终导致气道保护反应丧失[16]。烟雾所产生的物理化学刺激长期作用于呼吸道可导致气道黏膜损伤及慢性炎症,引起大小气道功能减退,最终发展成为COPD[16]。这也说明吸烟是COPD最重要的危险因素。本研究中AECOPD患者相对于COPD稳定期患者血清及痰液中上述细胞因子显著升高,考虑为炎症细胞在AECOPD患者肺内的进一步活化和气道大量募集,释放多种细胞因子,导致气道大量黏液分泌及气道的高反应性增加,导致病情加重。而目前有研究也证实上述细胞因子参与COPD炎症及急性加重的过程,与COPD的发生发展密切相关[17]。
CC16作为终末细支气管上皮Clara细胞分泌蛋白是天然的内源性磷脂酶A2抑制剂,它可以通过抑制炎症反应的关键酶分泌型磷脂酶A2(secrectory phospholipase2, sPLA2)、TNF-α来抑制炎症级联反应[10]。本研究发现CC16与多种促炎因子(IL-6、IL-8、TNF-a)存在负相关,而与抑炎因子(IL-10)正相关。目前国外研究也证实血清中CC16与炎症因子存在相关性,它可能直接或间接地抑制了炎症因子的释放,而随着病情加重,炎症因子的持续活化导致Clara细胞的破坏以及CC16分泌减少[18-19]。目前痰液中CC16的研究较少,本研究发现痰液中CC16与炎症因子的相关性与血清结果一致。因此CC16可能成为AECOPD、COPD和吸烟的参考标志物,因其标本收集便捷可替代血清作为辅助了解COPD的病情严重程度和治疗的参考。
参 考 文 献
1 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J]. 中华内科杂志, 2007,46(3): 254-261.
2 GOLD Executive and Science Committees. the Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2011.
3 文富强. 重视慢性阻塞性肺疾病的合并症[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(2): 99-102.
4 曾天星, 洪旭初. 慢性阻塞性肺疾病的表型及治疗[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(2): 216-219.
5 Lomas DA, Silverman EK, Edwards LD, et al. Evaluation of serum CC-16 as a biomarker for COPD in the ECLIPSE cohort[J]. Thorax, 2008, 63(12): 1058-1063.
6 Bernard A. Club cell protein and chronic obstructive pulmonary disease progression: the unrealized potential of a peripheral lung biomarker[J]. Am J Respir Crit Care Med, 2014, 189(5): 614-615.
7 Hasegawa M, Fujimoto M, Hamaguchi Y, et al. Use of serum clara cell 16-kDa (CC16) levels as a potential indicator of active pulmonary fibrosis in systemic sclerosis[J]. Rheumatol, 2011, 38(5): 877-884.
8 Braido F, Riccio A, Guerra L, et al. Detection of CC16 in sputum: A potential biomarker of COPD small airways damage[J]. Journal of Allergy and Clinical Immunology, 2005, 115(2): S13.
9 Dickens JA, Lomas DA. CC-16 as a biomarker in chronic obstructive pulmonary disease[J]. COPD, 2012, 9(5): 574-575.
10 Braido F, Riccio AM, Guerra L, et al. Clara cell 16 protein in COPD sputum: a marker of small airways damage?[J]. Respiratory Medicine, 2007, 101(10): 2119-2124.
11 H Garcia A, Moreno D, V Garmendia J, et al. Biomarkers in Asthma and COPD[J]. Recent Patents on Biomarkers, 2013, 3(2): 137-144.
12 Park HY, Churg A, Wright JL, et al. Club cell protein 16 and disease progression in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2013, 188(12): 1413-1419.
13 Van Miert E, Dumont X, Bernard A. CC16 as a marker of lung epithelial hyperpermeability in an acute model of rats exposed to mainstream cigarette smoke[J]. Toxicology Letters, 2005, 159(2): 115-123.
14 Wang Y, Chen Y, Li Q, et al. Detection and significance of tumor necrosis factor-α, interleukin-8 and interleukin-10 from peripheral blood mononuclear cells in patients with chronic obstructive pulmonary disease[J]. Hebei Med J, 2012, 3: 8-12.
15 Kunz LI, Lapperre TS, Snoeck-Stroband JB, et al. Smoking status and anti-inflammatory macrophages in bronchoalveolar lavage and induced sputum in COPD[J]. Respir Res, 2011, 12(1): 1-11.
16 Kim V, Rogers T J, Criner G J. New concepts in the pathobiology of chronic obstructive pulmonary disease[J]. Proceedings of the American Thoracic Society, 2008, 5(4): 478-485.
17 Drost EM, Skwarski KM, Sauleda J, et al. Oxidative stress and airway inflammation in severe exacerbations of COPD[J]. Thorax, 2005, 60(4): 293-300.
18 Loukides S, Kostikas K, Papaporfyriou A, et al. Clara cell secretory protein (cc16) and surfactant protein D in sputum supernatant in severe refractory asthma[C]. Am J Respir Crit Care Med, 2012, 185: A2196-A2207.
19 Hizawa N. Associating serum biomarkers with genetic susceptibility to chronic obstructive pulmonary disease: a step towards improved diagnosis and therapy?[J]. Am J Respir Crit Care med, 2012, 186(12): 1201-1202.
