澳洲茄碱对黑色素瘤细胞的抑制作用*
2014-08-29陈来胡珺李姗姗张洁徐彭陈兰英
★ 陈来 胡珺 李姗姗 张洁 徐彭 陈兰英,3
(1.江西中医药大学 江西 南昌 330006;2.南昌市洪都中医院 江西 南昌 330000;3.中药固体制剂制造技术国家工程研究中心 江西 南昌 330006)
黑色素瘤是一类因黑色素细胞异常增殖导致的肿瘤,恶性程度高、易转移、预后差、致死率高。近几年来的病例呈现增加趋势[1,2],然而,目前缺乏安全有效的治疗药物及方法[3]。龙葵(SolanumnigrumL.)全草均可入药, 是一种药食两用的植物,分布广,来源广泛,加工方便[4,5]。本课题探讨了龙葵提取物中澳洲茄碱对黑色素瘤的生长抑制效果并对其机制进行了研究。
1 仪器与材料
1.1 仪器 SHELLAB CO2培养箱,Leica倒置显微镜,EMax型酶标仪(Molecular Device公司),LightCycler®96 SW 1.1序列检测系统(Roche),岛津UV-1700/2450紫外分光光度计。
1.2 材料 链霉素、青霉素、MTT粉末、DMSO、胰蛋白酶均购自Sigma公司; DMEM购自Hyclone公司;胎牛血清购自GIBCO公司;Trizol购自life technology公司;反转录试剂盒购自TAKARA公司;SYBR绿色荧光定量PCR试剂盒、96孔PCR板均购自Roche公司;96孔细胞培养板购自NORMAX公司。
2 方法与结果
2.1 澳洲茄碱的提取与纯化 澳洲茄碱的提取与纯化方法参照文献[6]所述,最终获得HPLC级浓度为97.5%的澳洲茄碱粉末。称取50mg用DMSO溶解成浓度为44.5mg/mL的均一溶液,置于4℃冰箱避光保存、备用。
2.2 MTT法检测澳洲茄碱对小鼠黑色素瘤 B16细胞的抑制作用
2.2.1 细胞培养 小鼠黑色素瘤B16 细胞株由南京大学模式动物研究所刘耕老师实验室提供。细胞以含10%FBS及1万单位/mL双抗的DMEM全培养基培养于0.5% CO2、37℃及90%左右湿度的CO2培养箱中。细胞每三天按1∶3分盘传代。
2.2.2 MTT实验 黑色素瘤B16细胞以10000个/孔铺至96孔板内,空白对照、加溶媒DMSO组(最高终浓度为0.18%)、加药组(按10,20,40,60,80μg/mL,共5个梯度,溶媒DMSO最高终浓度为0.18%)各重复5个孔,共三板。以200μL DMEM全培养基培养20 h后,分别换成200μL空白、含溶媒或各浓度澳洲茄碱的DMEM全培养基, 24,48,72 h后各取一96空板,吸去培养基并加入200μL含5mg/mL MTT(溶于1×PBS并过滤)的新鲜DMEM全培养基,CO2培养箱中继续培养4 h。小心吸去培养液,加入150μL DMSO摇床摇5 min,用酶标仪振荡20 s后测各孔492nm下的OD值。每板细胞中同一细胞的各浓度药物的抑瘤率按下面公式计算:
细胞生长抑制率(%)=1-(OD药物-OD空白)/(OD溶媒-OD空白)×100
结果汇总于图1。从结果来看,澳洲茄碱对黑色素瘤B16细胞的抑制作用在处理后48 h基本上呈现与浓度成正比的趋势,并可以容易得出黑色素瘤B16 细胞的48h IC50约为35μg/mL。
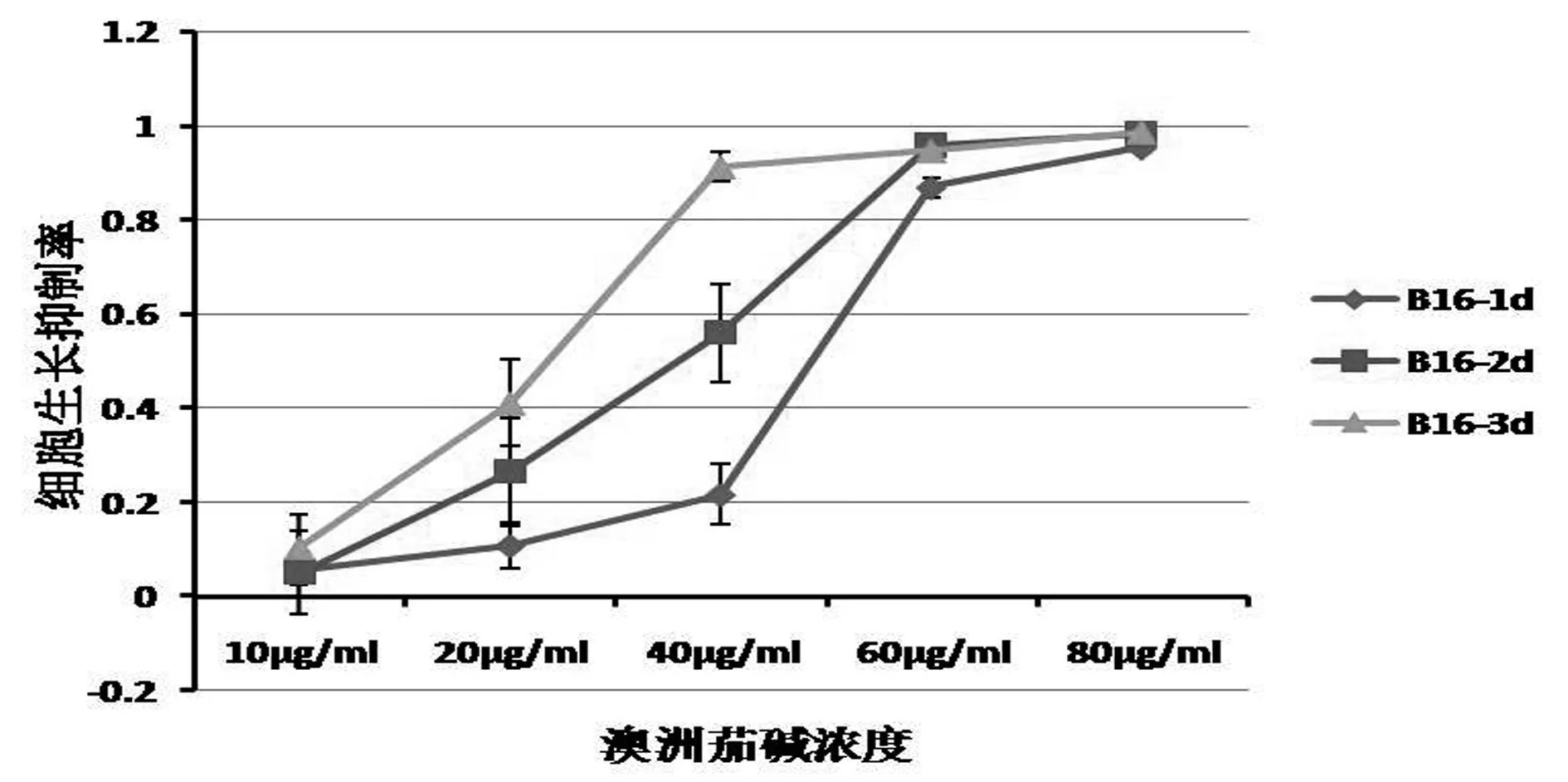
图1 MTT法检测澳洲茄碱对体外B16细胞的抑制作用

图2 澳洲茄碱及其溶媒处理48 h后B16细胞中p53通路下游各基因表达情况比较(*P<0.05)
2.3 荧光定量PCR分析 B16细胞按3×105个/皿铺到6孔板中,加药组和对照组(即DMSO组,终浓度为0.09%)各至少重复3孔,细胞用DMEM全培养基培养24 h后,换上含40μg/mL澳洲茄碱或等体积溶媒(DMSO)的DMEM全培养基继续培养24 h。细胞先用1×PBS洗两次,再各皿加1mL Trizol反复吹打至细胞完全脱壁再静置处理5分钟以保证细胞的充分裂解,然后在液氮中速冻、保存。按Trizol的说明书进行RNA的提取。各皿细胞总RNA经测OD260/280和电泳比较光密度等方法定量后,取0.5μg用TAKARA反转录试剂盒按试剂盒的方法反转录成总cDNA。每个10μL体系cDNA再用33μL miniQ稀释,取1.4μL以10μL体系重复三次按Roche的SYBR荧光定量PCR试剂盒说明书配成反应体系并在LightCycler®96 SW 1.1序列检测系统(Roche)上进行荧光定量PCR。检测和比较了药物处理组和对照组B16细胞中p53通路下游因子Puma,Bax和p21基因相对于β-actin的表达水平。所用引物序列为:β-actin:5'CTTCTGACCCATTCCCACCAT3'(f),5'GCTTCTTTGCAGCTCCTTCGT3'(r);Puma: 5'GCACCTAGTTGGGCTCCATTTCTG3'(f),5'GTACGAGCGGCGGAGACAAG3'(r);Bax:5' AGACAGGGGCCTTTTTGCTAC3' (f),AATTCGCCGGAGACACTCG(r);p21:5'AGGCAGCGTATATCAGGAG3' (f),5'CCTGACAGATTTCTATCACTCCA3'(r)。荧光定量PCR的程序为:第一步:95℃ 600s;第二步:95℃ 10s,60℃ 10s,72℃ 10s,共45个循环;第三步:37℃ 30s。实验数据用Excel和GraphPad软件进行t检验分析,并且以平均值±标准误差的形式展现。结果见图2。
3 讨论
本研究获得的MTT数据显示,澳洲茄碱相对溶媒DMSO的B16细胞生长抑制率呈剂量和时间依赖性。而从Q-PCR数据来看,终浓度为0.09%的DMSO处理48 h后的 Bax、p21表达水平皆较高,但从MTT数据来看相对而言并未造成对B16细胞的明显抑制,提示该处理可能一定程度上激活了p53但并不足以显著抑制B16细胞的生长,且其激活程度小于以等量DMSO为溶媒的澳洲茄碱(40μg/mL)处理相同时间的结果,而前者Puma的表达水平较低且不足后者一半,表明龙葵提取物澳洲茄碱能上调多种p53通路中下游因子基因的表达,其中对Puma基因表达增强明显,提示澳洲茄碱能通过p53、Puma等促进细胞凋亡而达到抑制黑色素瘤细胞生长的效果。本课题研究结果体现了龙葵提取物澳洲茄碱在治疗黑色素瘤疾病的潜在开发价值。
[1]王雪, 黄文华, 张晶, 等. 国内抗黑色素瘤天然药物的研究进展[C].海峡两岸暨 CSNR 全国第十届中药及天然药物资源学术研讨会论文集, 2012: 626-630.
[2]梅寒芳,金小宝,朱家勇.防御素2在恶性黑色素瘤B16细胞中的稳定表达及其生物学效应研究[J].第三军医大学学报,2011,33(14):1 467-1 470.
[3]杨华,郑勤.恶性黑色素瘤的免疫治疗现状与进展[J].现代肿瘤医学, 2012,19(11): 2 341-2 345.
[4]王尔兵, 王肇炎.恶性黑色素瘤的分子靶向药物治疗研究进展[J].医药导报, 2012,31(10): 1 333-1 336.
[5]曹熙敏, 范翠丽. 野生龙葵的开发利用研究进展[J].广东农业科学, 2011,38(3): 40-42.
[6]季宇彬,袁会成,高世勇,等. 龙葵多糖细胞毒活性物质基础研究[J].中草药, 2011,42(11): 2 275-2 278.
[7]罗习珍, 陈来, 刘建军, 等.高效液相色谱法测定龙葵中的澳洲茄胺[J].时珍国医国药, 2009. 20(2): 273-274.
