肾上腺髓质素对肾肿瘤细胞PI3K/Akt/eNOS/VEGF信号通路的作用
2014-08-29王东彬黎玮杨书文瞿长宝乔娜蔡文清
王东彬 黎玮 杨书文 瞿长宝 乔娜 蔡文清
·论著·
肾上腺髓质素对肾肿瘤细胞PI3K/Akt/eNOS/VEGF信号通路的作用
王东彬 黎玮 杨书文 瞿长宝 乔娜 蔡文清
目的研究肾上腺髓质素(ADM)对肾肿瘤细胞磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)/内皮型一氧化氮合酶(eNOS)/血管内皮生长因子(VEGF)信号通路的影响。方法将肾肿瘤细胞分为对照组、ADM组、VEGF组,ADM+VEGF受体抑制剂组,ADM+ADM shRNA组,每组设置24 h、48 h、72 h 3个时间梯度,western-blot检测对照组和ADM组细胞总蛋白中PI3K、Akt、eNOS、VEGF表达;检测VEGF组,ADM+VEGF受体抑制剂组和ADM+ADM shRNA组细胞总蛋白中PI3K、Akt、eNOS的表达。结果PI3K、Akt、eNOS、VEGF在ADM组各时间梯度组肾肿瘤细胞中表达明显高于其在对照组细胞的表达(P<0.05)。PI3K、Akt、eNOS在VEGF组和ADM+VEGF受体抑制剂组各时间组肾肿瘤细胞中表达明显高于其在对照组细胞中表达(P<0.05)。PI3K 、Akt 、eNOS在ADM+ ADM shRNA组各时间组肾肿瘤细胞中表达与其在对照组细胞中表达差异无统计学意义(P>0.05)。结论ADM可激活PI3K/Akt/eNOS/VEGF信号通路;VEGF受体抑制剂不能阻断ADM 激活PI3K/Akt/eNOS信号通路。ADM一方面通过VEGF发挥肾肿瘤血管生成作用,另一方面通过其受体激活PI3K/Akt/eNOS信号通路参与肾肿瘤血管生成作用。ADM可能成为抗血管治疗肾肿瘤新的靶点。
肾上腺髓质素;血管内皮生长因子;磷脂酰肌醇-3激酶;蛋白激酶B;内皮型一氧化氮合酶;肾肿瘤
抗VEGF治疗已经成为治疗进展期肾细胞癌最有效的治疗策略,已有多种药物应用于临床,但部分患者治疗效果不满意,表明在已知治疗靶点外,还存在其他血管生成因素。肾上腺髓质素(ADM)有希望成为下一个抗血管生成治疗肾细胞癌的靶点。本实验目的为明确ADM在肾细胞癌血管生成信号通路的作用以及此作用与血管内皮生长因子(VEGF)的关系。
1 材料与方法
1.1 细胞株 人肾癌786-0细胞由北京协和大学基础研究所提供。
1.2 主要试剂 ADM纯品和山羊抗兔二抗购于北京博奥森公司,兔抗人eNOS抗体购于美国ABCam公司。ADMshRNA,VEGF纯品,VEGF受体抑制剂,兔抗人Akt抗体,兔抗人PI3K抗体和小鼠抗人VEGF抗体购于美国santa cruz公司,RPMI1640细胞培养干粉购于美国Gibcobrl公司,胎牛血清购于北京华美公司,考马斯亮兰蛋白定量盒由上海科兴生物科技有限公司提供。
1.3 主要仪器 BIX-311二氧化碳培养箱,DG-3A电泳槽,DYY-Ⅲ7B 型转移电泳仪,UVP凝胶成相分析系统。
1.4 分组 取对数生长期,生长良好的786-0细胞分为对照组、ADM组(100 μmol/L)、VEGF组(50 μmol/L)、ADM+VEGF受体抑制剂组(ADM:100 μmol/L,VEGF受体抑制剂:100 μmol/L)、ADM+ADM shRNA组(ADM:100 μmol/L,ADM+ADM shRNA:1 μmol/L)。每组设24、48、72 h 3个时间点。5组细胞置于RPMI1640培养基,在含5%二氧化碳的饱和湿度的37℃孵箱中培养后收获细胞。
1.5 测定蛋白浓度 培养瓶内加入裂解液,冰上裂解30 min,4℃、12 000 r/min离心20 min,吸上清至一个新的清洁EP管中,采用考马斯亮蓝蛋白定量试剂盒,测定上清液蛋白浓度。
1.6 Western-blot检测各组细胞总蛋白中磷脂酰肌醇(PI3K)、蛋白激酶B(Akt)、内皮型一氧化氮合酶(eNOS)、VEGF的表达 每组取20 μg蛋白,裂解液补齐容量,沸水浸泡5 min。大齿梳最多可上50 μl,10%聚丙烯酰胺凝胶(SDS-PAGE)120 V电压下分离后转膜(PI3K:90 V、60 min;Akt:90 V、50 min;eNOS:120 V、150 min;VEGF:30 V、30 min)。5%脱脂奶粉浆膜封闭2 h后加入一抗(β-actin 1∶1 000,Akt 1∶1 000,PI3K 1∶1 000,eNOS 1∶1 000,VEGF 1∶400),室温孵育1.5 h,TBST充分漂洗后加入辣根酶标记的二抗(山羊抗兔二抗,抗体稀释浓度1∶7 500),孵育1.5 h,TBST再次充分漂洗,最后用ECL显色试剂显色。应用图像分析软件Bandscan(Glyko公司)对显色条带进行灰度分析。
1.7 结果判定 凝胶成像系统(UVP,美国)LabWorks 4.5软件对蛋白表达行半定量分析,以积分吸度(IOD)值表示。
2 结果
2.1 PI3K在5组肾肿瘤细胞中的表达 Western bolt检测PI3K在ADM处理组3个时间组肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。在VEGF处理组3个时间组肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。在ADM+VEGF受体抑制剂组3个时间组肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。PI3K在ADM+ADM shRNA组3个时间组表达与对照组比较,差异无统计学意义(P>0.05)。见表1。
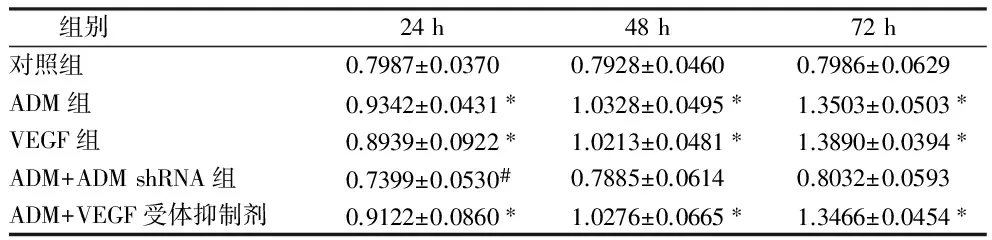
组别24h48h72h对照组0.7987±0.03700.7928±0.04600.7986±0.0629ADM组0.9342±0.0431∗1.0328±0.0495∗1.3503±0.0503∗VEGF组0.8939±0.0922∗1.0213±0.0481∗1.3890±0.0394∗ADM+ADMshRNA组0.7399±0.0530#0.7885±0.06140.8032±0.0593ADM+VEGF受体抑制剂0.9122±0.0860∗1.0276±0.0665∗1.3466±0.0454∗
注:与对照组比较,*P<0.05
2.2 AKT在5组肾肿瘤细胞中的表达 Western bolt检测AKT在ADM处理组3个时间点肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。在VEGF处理组3个时间点肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。在ADM+VEGF受体抑制剂组3个时间组肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。AKT在ADM+ADM shRNA组3个时间点表达与对照组比较,差异无统计学意义(P>0.05)。见表2。
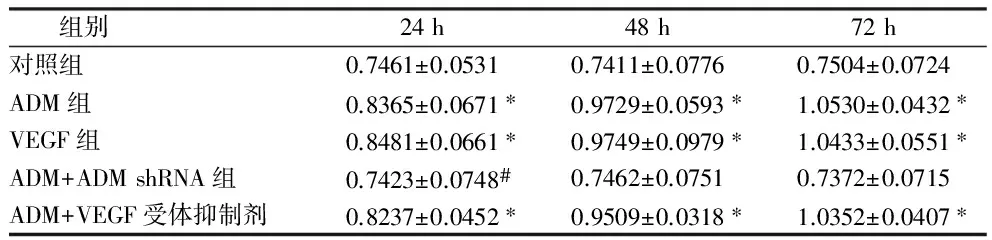
组别24h48h72h对照组0.7461±0.05310.7411±0.07760.7504±0.0724ADM组0.8365±0.0671∗0.9729±0.0593∗1.0530±0.0432∗VEGF组0.8481±0.0661∗0.9749±0.0979∗1.0433±0.0551∗ADM+ADMshRNA组0.7423±0.0748#0.7462±0.07510.7372±0.0715ADM+VEGF受体抑制剂0.8237±0.0452∗0.9509±0.0318∗1.0352±0.0407∗
注:与对照组比较,*P<0.05
2.3 eNOS在5组肾肿瘤细胞中的表达 Western bolt检测eNOS在ADM处理组3个时间组肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。在VEGF处理组3个时间组肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。在ADM+VEGF受体抑制剂组3个时间组肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。eNOS在ADM+ADM shRNA组3个时间组表达与对照组比较,差异无统计学意义(P>0.05)。见表3。
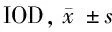
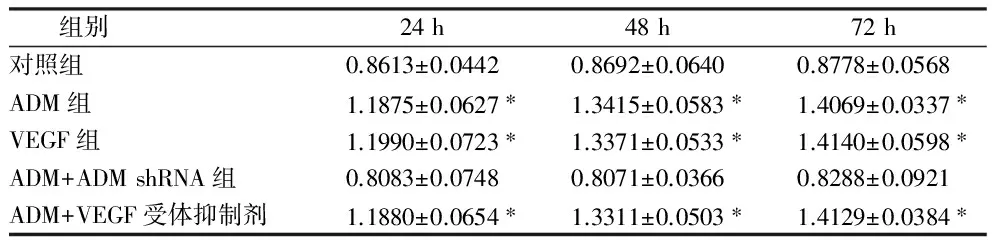
组别24h48h72h对照组0.8613±0.04420.8692±0.06400.8778±0.0568ADM组1.1875±0.0627∗1.3415±0.0583∗1.4069±0.0337∗VEGF组1.1990±0.0723∗1.3371±0.0533∗1.4140±0.0598∗ADM+ADMshRNA组0.8083±0.07480.8071±0.03660.8288±0.0921ADM+VEGF受体抑制剂1.1880±0.0654∗1.3311±0.0503∗1.4129±0.0384∗
注:与对照组比较,*P<0.05
2.4 VEGF在ADM处理组和对照组中的表达 Western bolt检测VEGF在ADM处理组24、48、72 h 3个时间组肾肿瘤细胞中表达明显高于其在对照组肾肿瘤细胞中表达(P<0.05)。VEGF在ADM+ADM shRNA组3个时间组表达与对照组,差异无统计学意义(P>0.05)。见表4。
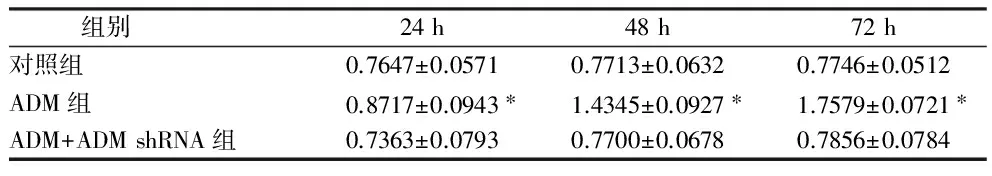
组别24h48h72h对照组0.7647±0.05710.7713±0.06320.7746±0.0512ADM组0.8717±0.0943∗1.4345±0.0927∗1.7579±0.0721∗ADM+ADMshRNA组0.7363±0.07930.7700±0.06780.7856±0.0784
注:与对照组比较,*P<0.05
3 讨论
肾细胞癌为典型多血管肿瘤,依赖于肿瘤新生血管生成满足其生长和进展过程中对营养物质的需求量不断增加和带走代谢废物,维持内环境稳定。抗血管生成是治疗肾肿瘤有效策略。已经有多种抗血管生成药物应用于肾细胞癌的治疗,并且取得令人满意的效果,这些药物主要是抗VEGF药物。ADM和VEGF一样在人正常组织和肿瘤组织中广泛表达[1],已经证实ADM作为肿瘤细胞自分泌和旁分泌因子促进肿瘤细胞的生长和进展,还促进周围内皮细胞增殖和改变血管的通透性促进肿瘤远处转移[2]。ADM在肾细胞癌生成和进展方面同样具有促进作用,ADM在体外低氧环境培养的肾肿瘤细胞中表达升高[3];ADM作用于肾肿瘤细胞可诱导VEGF mRNA表达明显升高,ADMR shRNA可抑制ADM这一作用[4];ADM和ADMR在肾细胞癌组织中表达明显高于其在正常肾组织中表达,并且ADM和ADMR高表达与肿瘤组织中微血管密度成正相关性[5]。以上研究表明产生和分泌ADM为肾肿瘤细胞自身保护机制,和肿瘤血管生成有关。
VEGF是目前发现最强大的血管生成诱导剂,通过激活各种信号转导通路促肿瘤血管生成,阻断与VEGF有关的信号通路可达到治疗肿瘤的作用。PI3K/AKT/eNOS与肿瘤进展 至关重要,如PI3K/AKT在卵巢上皮癌组织中表达与肿瘤临床分期、细胞组织学分化有显著相关性[6,7]。其在肿瘤血管生成方面的作用也得到共识,活化的AKT 可使eNOS磷酸化使之激活,产生NO,NO 与血管生成密切相关[8];PI3K/Akt 还可激活激酶HDM2调控VEGF和缺氧诱导因子1α的表达[9],促进细胞对VEGF 及其他血管生成因子的表达和分泌;VEGF可反馈性活化PI3K/AKT 信号通路,从而进一步刺激血管生成;抑制PI3K/AKT/eNOS通路,可抑制VEGF的促内皮细胞增殖,迁移和增加血管通透性的作用[10]。本研究结果发现ADM可激活人肾肿瘤细胞内PI3K/AKT/eNOS/VEGF信号通路;VEGF可激活肾肿瘤细胞内PI3K/AKT/eNOS通路。ADM作用于肾肿瘤细胞可诱导VEGF mRNA表达明显升高[4],表明ADM可能通过影响VEGF发挥PI3K/AKT/eNOS通路激活作用。本实验结果还发现VEGF受体抑制剂阻断VEGF的作用后,ADM仍可激活PI3K/AKT/eNOS通路;而通过记忆静默技术,抑制ADM的作用后,PI3K/AKT/eNOS信号通路活性受到抑制。表明ADM还可以通过其受体直接激活PI3K/AKT/eNOS参与肾肿瘤血管生成。
综上所述,ADM具有肾肿瘤血管生成作用,有助于肾肿瘤的发生和进展,ADM一方面通过影响VEGF参与肾肿瘤血管生成的调节,同时ADM还通过其自身受体,激活PI3K/AKT/eNOS通路,参与血管生成的调节。但ADM这一作用尚未在活体实验证实,ADM可能成为新的治疗肾肿瘤的靶点。
1 Kitamura K,Sakata J,Kangawa K,et al.Cloning and characterization of cDNA encoding a precursor for human adrenomedullin.Biochem Biophys Res Commun,1993,194:720-725.
2 Cuttitta F,Pio R,Garayoa M,et al.Adrenomedullin functions as an important tumor survival factor in human carcinogenesis.Microsc Res Tech,2002,57:110-119.
3 王东彬,黎玮,杨书文,等.低氧刺激对肾肿瘤细胞ADM基因表达的影响及意义.山东医药,2012,52:59-69.
4 敦双华,王东彬,乔娜,等.VEGF在肾癌细胞的表达及肾上腺髓质素对其影响.山东医药,2012,52:36-37.
5 王东彬,蔡文清,杨树文,等.肾上腺髓质素在肾肿瘤组织中的表达及其与肿瘤组织微血管密度的关系.中华实验外科杂志,2011,28:854-856.
6 尚素霜,程佳,张静,等.卵巢上皮癌中HER-2、TOPO-Ⅱα和PI3K的表达及临床意义.河北医药,2012,34:2256-2259.
7 程佳,杨晓龙,尚素霜,等.卵巢上皮性癌组织中磷酸化蛋白激酶B的表达及意义.河北医药,2013,35:1797-1799.
8 Gordan JD,Simon MC.Hypoxia-inducible factors: central regulators of the tumor phenotype.Curr Opin Genet Dev,2007,17:71-77.
9 Jiang BH,Liu LI.AKT signaling in regulating angiogenesis.Curr Cancer Drug Targets,2008,8:19-26.
10 Bhattacharya D,Singh MK,Chaudhuri S,et al.T11TS impedes glioma ngiogenesis by inhibiting VEGF signaling and pro-survival I3K/Akt/eNOS pathway with concomitant upregulation of PTEN in brain endothelial cells.J Neurooncol,2013,113:13-25.
EffectoftheadrenomedullinonthesignalingpathwayofPI3K/Akt/eNOS/VEGFinrenaltumorcell
WANGDongbin,LIWei,YANGShuwen,etal.
DepartmentofUrology,TheSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
ObjectiveTo investigate the effect of the adrenomedullin on the signaling pathway of PI3K/Akt/eNOS/VEGF in renal tumor cell.MethodsThe kidney tumor cells were divided into five groups,control group,ADM group,VEGF group,ADM+VEGF receptor inhibitor group,ADM+ADM shRNA group,moreover,every group was redivided three time gradient groups (24 hours,48 hours and 72 hours).The expression levels of PI3K,Akt,eNOS,VEGF in control group and ADM group and the expression levels of PI3K,Akt,eNOS in VEGF group,ADM+VEGF receptor inhibitor group,ADM+ADM shRNA group were detected by Western Blot,respectively.ResultsThe expressions levels of the PI3K,Akt,eNOS,VEGF in ADM groups were significantly higher than those of control group (P<0.05).The expression levels of PI3K,Akt,eNOS in VEGF groups and ADM+VEGF receptor inhibitor groups were significantly higher than those of control group (P<0.05).However there were no significant differences in the expression levels of PI3K,Akt,eNOS between ADM+ ADM shRNA groups and control group (P<0.05).ConclusionADM can activate PI3K/Akt/eNOS signaling pathway in renal tumor cell,which can not be blocked by VEGF receptor inhibitor.On one hand ADM regulates renal tumor angiogenesis by VEGF,on the other hand,by activating PI3K/Akt/eNOS signaling pathway to participate in renal tumor angiogenesis.ADM may become a promising anti-angiogenic target in the treatment of renal tumor.
adrenomedullin;vascular endothelial growth factor;phosphatidylinositol 3-kinase;protein kinase B;endothelial nitric oxide synthase;renal tumor
10.3969/j.issn.1002-7386.2014.23.001
项目来源:河北省医学科学研究重点课题(编号:020130510);吴阶平医学基金会临床科研专项资助基金(编号:320.6750.13250)
050000 石家庄市,河北医科大学第二医院
R 737.11
A
1002-7386(2014)23-3525-03
2013-11-06)
